miR-200c对三阴性乳腺癌上皮间质转化的抑制作用及其机制
马啸天,岳小欣,荣守华,张玉超,田 远,石 瑛,李君芳,贾莉婷
(1. 郑州大学第三附属医院检验科,河南 郑州 450052;2.河南省高等医学专科学校药学系,河南 郑州 451191;3.河南省漯河市中心医院,河南 漯河 462000)
基底样乳腺癌因其雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone,receptor,PgR)和人表皮生长因子受体2(HER2)表达阴性而被称为三阴性乳腺癌。三阴性乳腺癌细胞分化程度差,易出现早期复发和转移,并缺乏有效的治疗措施,患者预后较差。上皮间质转化(epithelial-mensenchymal transition,EMT)为其主要的细胞转移形式,主要表现为上皮细胞的极性丢失,细胞间失去黏附能力并获得间充质细胞特性,伴有迁移能力的增强[1-2]。EMT的发生发展来源于多个趋化因子和信号通路的共同作用,其中趋化因子vimentin和Wnt信号通路关键蛋白β-catenin常在三阴性乳腺癌中高表达,其蛋白的表达异常增高常被认为是EMT发生的标志性变化[3-4]。miR-200c为短小核苷酸编码序列,已被证明与肿瘤发生密切相关,主要通过结合相应靶基因3′非编码(3′UTR)区,抑制靶基因转录从而调节肿瘤生长,其在结直肠癌中可以降低vimentin的表达从而抑制EMT[5],在乳腺癌相关miRNA的基因分析中,miR-200c也常作为β-catenin的目标基因,起到肿瘤抑制的作用[3]。然而,miR-200c在三阴性乳腺癌中是否与vimentin和β-catenin表达有关联,尚未见相关报道。本课题组研究[6]证实:miR-200c能够结合EMT相应转录因子(slug)从而抑制三阴性乳腺癌EMT。本文作者在此基础上,探讨miR-200c是否可以通过调节β-catenin和vimentin表达水平,从而降低细胞的迁移和增殖能力,最终抑制三阴性乳腺癌EMT。
1 材料与方法
1.1 细胞和试剂三阴性乳腺癌细胞系MDA-MB-231和BT-549均购于上海ATCC细胞库。miR-200c质粒和negative control 由广州锐博生物科技公司合成,转染用试剂Lipo2000购自美国Invitrogen公司,RNA柱式提取试剂盒和荧光定量试剂盒购自上海生工生物工程公司,逆转录试剂盒购自日本东洋纺公司,vimentin和β-catenin单克隆抗体购自美国Cell-Signing-Technology公司,CCK8试剂盒购自日本同仁科技有限公司。
1.2 细胞培养MDA-MB-231和BT-549细胞均采用含有双抗的PRMI 1640完全培养基放置于37℃、5%CO2培养箱中进行培养,取对数生长期的细胞进行消化传代以及后续实验。所有实验均为3复孔,结果取均值,并重复3次。
1.3 实验分组和转染取对数生长期的细胞接种于6孔板,每孔接种2×105个细胞并进行培养,待细胞生长至孔面积的70%~80%时进行转染操作。根据转染物将其分为空白对照组、阴性对照组组(转染nagtive control/Lipo2000)、试剂对照组(转染Lipo2000)和实验组(转染miR-200c mimic/Lipo2000)。
1.4 RT-PCR法检测细胞中β-catenin和vimentin mRNA表达水平根据生工柱式提取说明书要求,待6孔板中的细胞融合之后,进行总RNA提取,并根据各组RNA的相对浓度和纯度将其逆转录为cDNA,采用RT-PCR法检测相应组别的Ct值。采用2-ΔΔt法计算vimentin和β-catenin mRNA相对表达水平。
1.5 Western blotting法检测细胞中vimentin和β-catenin蛋白表达水平取转染后48 h的各组细胞系,加入120 μL细胞裂解液裂解细胞并收集至EP管中充分震荡30 min,12 000 r·min-1离心6 min得到蛋白提取液,并进行电泳,电泳结束后将胶内蛋白电泳转移至PVDF膜上。用TBS 1∶1 000稀释一抗,室温孵育后4℃过夜。用脱脂奶粉稀释二抗,室温避光2 h,用TBST溶液充分洗涤,放入扫描仪扫描PVDF膜并拍照,计算相应条带的灰度值,以GAPDH为内参,用vimentin/GAPDH和β-catenin/GAPDH比值表示各组细胞中vimentin和β-catenin蛋白相对表达水平。
1.6 CCK8法检测细胞增殖率将对数生长期的细胞按5 000个/孔均匀接种至96孔板中,待细胞覆盖孔底面积70%时进行转染,终浓度为50 nmol·L-1。分别在转染后24、48和72 h取出细胞并加入CCK8试剂,检测不同时间段细胞的吸光度(A)值,表示细胞的增殖情况。以空白组作为运算基准计算细胞增殖率,细胞增殖率=(实验组A值-试剂对照组A值 ) /(空白组A值-试剂对照组A值)。
1.7 划痕实验检测划痕宽度恢复率将转染24 h后的6孔板中细胞更换无血清培养基并进行划痕实验,用高压消毒后的枪头对各组细胞划平行直线,用PBS缓冲液清洗3遍之后加入不含血清的培养基进行培养,分别于0和24 h观察细胞划痕相对宽度,采用Image Pro Plus 6.0软件计算划痕宽度。划痕宽度恢复率= (0 h划痕宽度-24 h划痕宽度)/ 0 h划痕宽度×100%。
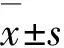
2 结 果
2.1 各组三阴性乳腺癌细胞中vimentin和β-catenin mRNA表达水平与空白对照组、阴性对照组和试剂对照组比较,实验组细胞中vimentin和β-catenin mRNA表达水平明显降低 (P<0.05)。 见表1。
表1 各组细胞中vimentin和β-catenin mRNA表达水平
Tab.1 Expression levels of vimentin and β-catenin mRNA in cells in various groups

表1 各组细胞中vimentin和β-catenin mRNA表达水平
GroupcontrolMDA⁃MB⁃231VimentinmRNAβ⁃cateninmRNABT⁃549VimentinmRNAβ⁃cateninmRNABlankcontrol1.000±0.1001.000±0.1001.000±0.1001.000±0.100Negativecontrol0.853±0.0600.850±0.0800.790±0.1000.822±0.080Reagentcontrol0.872±0.0800.928±0.0600.757±0.1300.808±0.110Experimental0.630±0.110∗△#0.599±0.140∗△#0.524±0.110∗△#0.466±0.130∗△#F8.66019.0719.33018.127P0.0070.0060.0050.000
*P<0.05 compared with blank control group;△P<0.05 compared with negative control group;#P<0.05 compared with reagent control group.
2.2 三阴性乳腺癌细胞中vimentin和β-catenin蛋白表达水平与空白对照组、阴性对照组和试剂对照组比较,实验组细胞中vimentin和β-catenin 蛋白表达水平明显降低 (P<0.05)。 见表2和图1。
表2 各组细胞中 vimentin和β-catenin 蛋白表达水平
Tab.2 Expression levels of vimentin and β-catenin proteins in cells in various groups

表2 各组细胞中 vimentin和β-catenin 蛋白表达水平
GroupMDA⁃MB⁃231Vimentinproteinβ⁃cateninproteinBT⁃549Vimentinproteinβ⁃cateninproteinBlankcontrol1.000±0.1001.000±0.1001.000±0.1001.000±0.100Negativecontrol0.858±0.0700.891±0.1100.918±0.1100.927±0.090Reagentcontrol0.849±0.1100.920±0.0900.986±0.0900.933±0.100Experimental0.521±0.090∗△#0.540±0.070∗△#0.698±0.130∗△#0.632±0.090∗△#F14.06313.6564.8488.448P0.0010.0020.0160.007
*P<0.05 compared with blank control group;△P<0.05 compared with negative control group;#P<0.05 compared with reagent control group.
2.3 各组三阴性乳腺癌细胞的增殖率与阴性对照组和试剂对照组比较,在48和72 h时实验组细胞增殖率明显降低(P<0.05)。见表3。
2.4 各组三阴性乳腺癌细胞迁移能力与空白对照组、阴性对照组和试剂对照组比较,实验组细胞划痕宽度恢复率明显减低(P<0.05)。见表4。
3 讨 论
EMT的发生是一个多步骤多因素的渐进过程,主要表现为E-cadherin表达缺失,导致组成细胞骨架的角蛋白转化为波形蛋白,从而启动EMT,而其调控因子和相关蛋白则成为了治疗三阴性乳腺癌的重要靶标[7-8]。
miR-200c为内源性非编码单链RNA,参与肿瘤细胞生长、增殖、凋亡、转移和侵袭,作为miR-200家族的一员,参与了乳腺癌EMT的基因调控[9]。而目前关于miR-200c调节EMT的研究大多集中在miR-200c靶向结合于E-cadherin转录抑制子(zeb1和slug)从而导致间质标志物vimentin的降低进而抑制EMT[10]。vimentin作为一类中间丝蛋白,广泛地存在于间充质细胞中,能调节黏附因子之间的相互作用导致细胞失去黏附,与细胞黏附因子E-cadherin表达相反,其表达增高常被认为是EMT的标志性改变[1,11]。本研究结果表明:miR-200c在三阴性乳腺癌细胞中可下调vimentin表达水平,与Gao等[12]在肺癌中的研究结果一致,该研究表明miR-200c可以靶向结合于ZEB1,使其不能够抑制 E-cadherin转录,导致vimentin表达降低,最终抑制EMT。
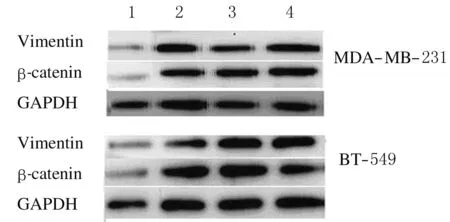
Lane 1:Experimental group; Lane 2:Negative control group; Lane 3:Reagent control group; Lane 4:Blank control group.
表3 不同时间点各组MDA-MB-231和BT-549细胞增殖率
Tab.3 Proliferation rates of MDA-MB-231 and BT-549 cells at different time points in various groups
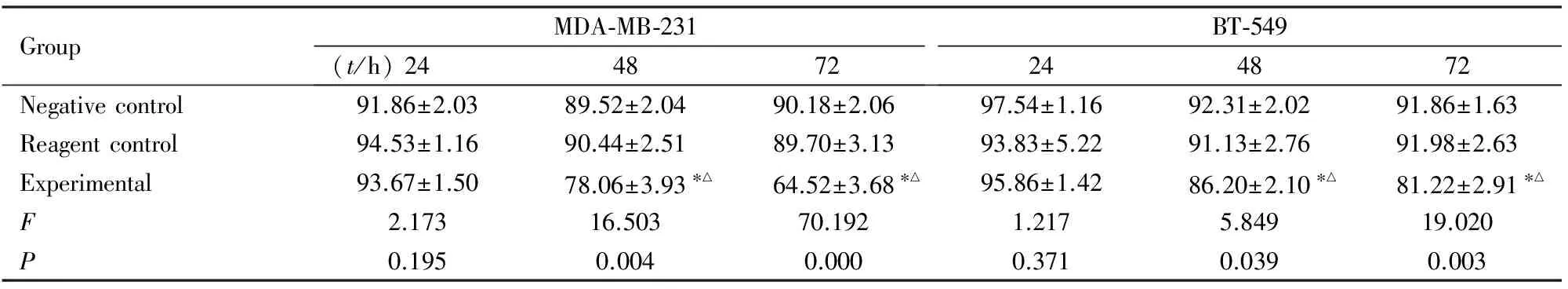
表3 不同时间点各组MDA-MB-231和BT-549细胞增殖率
GroupMDA⁃MB⁃231(t/h)244872BT⁃549244872Negativecontrol91.86±2.0389.52±2.0490.18±2.0697.54±1.1692.31±2.0291.86±1.63Reagentcontrol94.53±1.1690.44±2.5189.70±3.1393.83±5.2291.13±2.7691.98±2.63Experimental93.67±1.5078.06±3.93∗△64.52±3.68∗△95.86±1.4286.20±2.10∗△81.22±2.91∗△F2.17316.50370.1921.2175.84919.020P0.1950.0040.0000.3710.0390.003
*P<0.05 compared with negative control group;△P<0.05 compared with reagent control group.

表4 各组DA-MB-231和BT-549 细胞划痕宽度恢复率
*P<0.05 compared with blank control group;△P<0.05 compared with negative control group;#P<0.05 compared with reagent control group.
肿瘤细胞发生EMT受到多种调控机制与信号通路的作用,诱导EMT的信号通路通常导致vimentin等关键因子的表达变化以及细胞黏附能力和骨架结构的改变。Wnt信号通路是诱导细胞发生EMT的重要信号通路,β-catenin作为Wnt信号通路的关键蛋白,也是细胞内的一种多功能蛋白,与细胞黏附因子E-cadherin形成稳点复合物维持细胞间的稳定结构。当Wnt信号通路激活之后,β-catenin大量增高并解离与E-cadherin的稳定连接,导致细胞失去彼此间的黏附从而启动EMT[3,13]。本研究结果显示:转染miR-200c的三阴性乳腺癌细胞中的β-catenin和vimentin表达水平均明显降低。β-catenin作为Wnt信号通路关键蛋白,常与EMT间质标志物vimentin和EMT转录因子slug协同变化。 研究[14-16]结果表明:slug可通过激活β-catenin启动乳腺癌EMT,同时被激活的β-catenin又上调了slug的相对表达量,在EMT的发生过程中二者起着相互促进的作用,从而建立了Wnt信号通路与EMT之间的正反馈效应。因此本文作者推测:mirR-200c可能通过下调β-catenin和vimentin,进而调节Wnt信号通路相关基因最终抑制三阴性乳腺癌EMT。
本研究对转染后细胞迁移能力和增殖能力的检测结果显示:转染miR-200c的三阴性乳腺癌细胞迁移与增殖能力均明显减弱;本研究结果进一步表明:在三阴性乳腺癌中,miR-200c可能通过降低β-catenin和vimentin的表达水平,并削弱细胞的迁移能力与增殖能力,最终抑制三阴性乳腺癌EMT。本研究将Wnt信号通路中关键蛋白β-catenin和vimentin作为miR-200c调节EMT的切入点,结合迁移能力与增殖能力实验,进一步完善了miR-200c抑制三阴性乳腺癌EMT的机制。β-catenin作为wnt信号通路与EMT之间的连接桥梁,与EMT相关因子vimentin协同表达的同时,也调节着Wnt信号的活性,其与vimentin均可被miR-200c抑制,表明miR-200c可以通过调节β-catenin活性,从而抑制三阴性乳腺癌EMT,也为寻找三阴性乳腺癌的个体化治疗方案提供了有力依据。
[1] Liu F,Gu LN,Shan BE,et al.Biomarkers for EMT and MET in breast cancer:An update[J].Oncol Lett,2016,12(6):4869-4876.
[2] HeerbothS,HousmanG,Leary M,et al.EMT and tumor metastasis[J].Clin Transl Med,2015,4(6):1-13.
[3] HowardS,DerooT,Fujita Y,et al.A positive role of cadherin in Wnt/beta-catenin signalling during epithelial-mesenchymal transition[J].PLoS One,2011,6(8):e23899.
[4] Xu J,Chen Y,Huo D,et al.β-catenin regulates c-Myc and CDKN1A expression in breast cancer cells[J].Mol Carcinog,2016,55(5):431-439.
[5] Hur K,Toiyama Y,Takahashi M,et al.MicroRNA-200 cmodulates epithelial-to-mesenchymal transition (EMT) in human colorectal cancer metastasis[J].Gut,2013,62(9):1315-1326.
[6] 贾莉婷,田 远,石 瑛,等.miR-200c对乳腺癌BT549细胞迁移及Slug表达的作用[J].中国免疫学杂志, 2015,31(3):304-307.
[7] 刘行仁,白义凤,梁 良,等.miR-34a通过Snail诱导肺癌EMT及促进其转移的分子机制[J].中国免疫学杂志,2017,33(5):646-651.
[8] 邓海月,于 方,姜 红.直接肾素抑制剂阿利吉仑对肾纤维化小鼠上皮-间质转化的调节作用[J].吉林大学学报:医学版,2017,43(1):16-20.
[9] Radisky DC.miR-200c at the nexus of epithelial-mesenchymal transition,resistance to apoptosis,and the breast cancer stem cell phenotype[J].Breast Cancer Res:BCR,2011,13(3):110.
[10]Lv ZD,Kong B,Liu XP,et al.miR-655 suppresses epithelial-to-mesenchymal transition by targeting Prrx1 in triple-negative breast cancer[J].J Cell Mol Med, 2016,20(5):864-873.
[11]Davis FM,Azimi I,Faville RA,et al.Induction of epithelial-mesenchymal transition (EMT) in breast cancer cells is calcium signal dependent[J].Oncogene,2014,33(18):2307-2316.
[12]Gao HX,Yan L,Li C,et al.miR-200c regulates crizotinib-resistant ALK-positive lung cancer cells by reversing epithelial-mesenchymal transition via targeting ZEB1[J].Mol Med Rep,2016,14(5):4135-4143.
[13]朱智杰,阮君山,李 尧,等.Wnt信号通路诱导肿瘤细胞上皮间质转化的研究进展[J].中国药理学通报,2012,28(7):904-907.
[14]Prasad CP,Rath G,Mathur S,et al.Expression analysis of E-cadherin,Slug and GSK3beta in invasive ductal carcinoma of breast[J].BMC Cancer,2009,9:325.
[15]Stemmer V,de Craene B,Berx G,et al.Snail promotes Wnt target gene expression and interacts with beta-catenin[J].Oncogene,2008,27(37):5075-5080.
[16]许光伟,曹旭晨.β-catenin下调对乳腺癌MDA-MB-231细胞上皮间质转化及侵袭迁移能力的影响[J].天津医药,2015,43(9):981-984,1093.

