新辅助化疗对大肠癌患者临床特征的影响
吕国利 白 松 李 杨
大肠癌(colorectal cancer,CRC)是常见的下消化道恶性肿瘤,据权威统计2007全年世界各国新发患者数约为110余万,死亡病例高达60余万,居所有人体恶性肿瘤的第3位[1]。中国每年新发大肠癌患者超过15万,死亡比例达到17.4/10万人[2],发病比率高居全国所有人体罹患恶性肿瘤的第4位[3],且死亡比率位居第五[4,5]。随着中国居民生活方式、饮食习惯及工业化进程不断变化,全国大肠癌患者发病比率大幅度上升,21世纪初的前10年间,中国城镇居民发病率上升超过31%,而在乡村上升超过17%[6]。
外科手术仍然是大肠癌首要治疗手段,随着近些年新一代化疗药物不断更新及术后化疗方案的更新换代,已经为改善大肠癌患者预后及带瘤生存质量带来了新的福音。但是,大肠恶性肿瘤的复发概率及死亡率仍居高不下。因此,新辅助化疗就成为治疗大肠癌病患的新方法。新辅助化疗(neoadjuvant chemotherapy,NC)是指对大肠癌患者在行根治性手术前予化疗治疗。2010年美国国家综合癌症网络(简称NCCN)大肠癌临床实践指南(中国版)对大肠癌的术前化疗治疗限定在临床分期为T3并淋巴结N1/N2且不论局部浸润程度的患者,以及部分T4的肿瘤晚期患者,可通过新辅助化疗手段达到降期或降级,为完整切除肿瘤手术创造新的机会。因此,新辅助化疗在大肠癌患者治疗过程中的作用发挥较大的潜力。宋传健等[7]研究结果表明:新辅助化疗可诱导大肠癌患者的肿瘤细胞发生细胞凋亡,并可以使肿瘤组织周围血管壁水肿、内膜增厚甚至血栓形成等方式阻断肿瘤血供,引起肿瘤组织缺血、坏死。
本研究对对昆明医科大学第一附属医院胃肠外科2009~2011年3年间住院60例大肠癌患者进行术前辅助化疗,并对其临床资料进行回顾性分析,探索新辅助化疗对大肠癌患者临床特征的影响及临床治疗效果,进一步为大肠癌的治疗提供宝贵的实验室依据和评价标准。
1.资料与方法
1.1 研究对象 2009~2011年在昆明医科大学第一附属医院胃肠外科住院并进行术前辅助化疗治疗60例大肠癌患者。
1.1.1 入选标准:①所有患者均为原发性大肠癌且具有明确的术前內镜标本病理学诊断;②所有患者经完善检查后判定均能进行手术治疗,且签署术前化疗知情同意书;③病例资料记录完整;④患者可以持续随访。
1.1.2 排除标准:①良性肿瘤或癌前病变;②经术前检查判定不能行手术治疗或肝肾功能差不易行术前全身化疗的患者;③病例资料不完整者,或者不能持续随访者。
1.2 方法
1.2.1 新辅助化疗方案:60例大肠癌患者皆行新辅助化疗,化疗方案为:奥沙利铂、5-氟尿嘧啶(5-FU)和亚叶酸钙(CF)联合方案。化疗1个周期,化疗结束后2周手术。
1.2.2 临床数据获取及统计分析:通过对患者住院期间所有病历资料汇总及随访,获取本回顾性研究的各项临床数据,使用SPSS 16.0版本统计软件,对化疗前后的肿瘤标记物指标行配对t检验;对并发症的发生率进行描述统计方法;累积生存率用寿命表法来计算;各亚组生存率之间是否存在统计学差异用Log~Rank检验来比较,以P<0.05表示有统计学意义。
2.结果
2.1 患者的临床特征 新辅助化疗治疗60例大肠腺癌患者,均符合肿瘤全部为单发,其中位于升结肠8例、横结肠2例、降结肠10例、乙状结肠4例、直肠36例;年龄在33~84岁之间,平均年龄为62.7岁,其中<60岁23例,≥60岁37例,男性32例,女性28例;肿块直径1.8~8.9cm,其中直径≤3.0cm者25例,直径3.0~5.0cm者22例,直径≥5.0cm者13例;结直肠癌按Dukes分期:B期32例,C期28例;TNM分期:Ⅱ期32例,Ⅲ期28例;新辅助化疗前CEA阳性者46例,其中>20.0μg/L者33例,5.0~20.0μg/L者13例,阴性者14例;排便习惯及粪便性状改变者42例,腹痛者28例,梗阻8例,体重减轻者38例,直肠刺激症状22例;14例合并慢支炎、肺气肿、高血压、糖尿病等其他疾病(见表1)。

表1 患者临床特征
2.2 新辅助化疗对相关肿瘤标记物的影响 60例大肠癌患者化疗一个疗程(术前1天)后,患者血清CEA,CA19-9,CA125水平与化疗前进行比较。发现45例患者血清CEA水平较化疗前有所下降,前后比较差异有统计学意义(P<0.05);CA19-9,CA125水平前后比较差异无统计学意义(P>0.05)(见表2)。

表2 新辅助化疗前后血清肿瘤标记物的变化
注:CEA:癌胚抗原,CA125:糖链抗原125,CA19-9:糖链抗原19-9。*与化疗前比较P<0.05。
60例大肠癌患者中化疗前CEA水平14例为阴性,并且CEA值均<5μg/L;化疗前46例CEA阳性的患者,CEA值在5.27~345.02μg/L,行术前新辅助化疗一个疗程后进行复查,有38例(82.61%)患者有不同程度的下降,下降幅度1.2~124μg/L不等,其中下降超过50%的患者有24例(52.17%),占下降患者中63.16%,14例(30.44%)下降幅度小于50%,8例(17.39%)较化疗前有所升高,升高幅度在1.67~10.62μg/L(表3)。

表3 46例化疗前阳性的结直肠癌患者化疗后血CEA值的情况
2.3 新辅助化疗对肿瘤直径的影响 60例大肠癌患者中化疗前肿块直径在1.8~8.9cm之间,其中直径≤3.0cm者25例,直径在3.0~5.0cm者22例,直径≥5.0cm者13例;经过新辅助化疗一个疗程,手术切除后手工测量,其中有39例(65.00%)患者肿块有不同程度的缩小,范围在0.3~2.4cm之间,直径≤3.0cm组17例(68%),3.0~5.0cm组13例(59.09%),直径≥5.0cm组9例(69.23%),22例(56.41%)缩小超过1.0cm;用卡方检验计算前后各组间P值,P值均<0.05,可以认为不同直径的大肠癌肿块经新辅助化疗后肿瘤直径缩小率均存在统计学差异(见表4)。
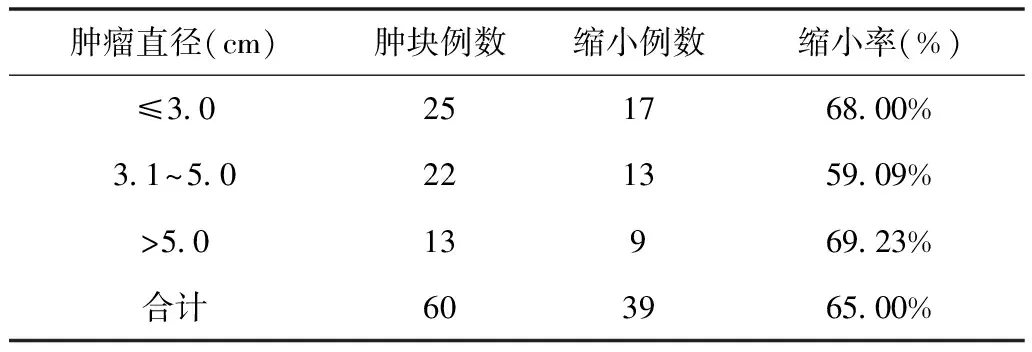
表4 不同直径大小肿瘤新辅助化疗后肿块缩小情况
2.4 新辅助化疗不良反应及并发症 60例大肠癌患者化疗一个疗程后共有32例患者出现化疗不良反应,其中有22例出现胃肠道不适症状,主要表现有恶心、呕吐、食欲不振;有4例发热;有18例患者出现白细胞降低;有2例出现皮肤瘙痒;有3例脱发;有1例皮肤潮红;有9例血压升高;肠穿孔0例,感觉神经异常0例,甲周改变0例,手足综合症0例(见表5)。
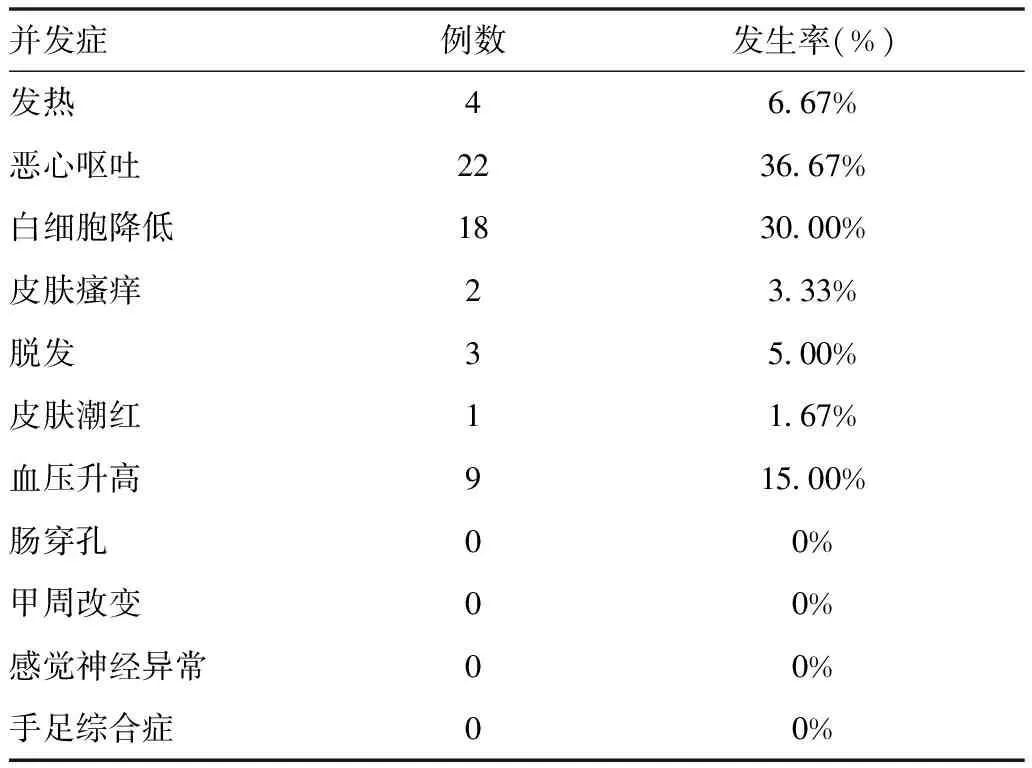
表5 60例结直肠癌患者新辅助化疗后并发症的分类及发生率
2.5 新辅助化疗后患者1年、2年、3年累积生存率 新辅助化疗治疗60例大肠癌患者中,在随访期内,共计随访到56例,失访4例,失访率6.67%,肠癌复发及全身转移者11例,死于其他疾病者2例,余为健康存活;生存时间9~35个月,随访时间6~37个月;经相应方法统计计算随访到的56例患者1年、2年、3年累积生存率分别为93.3%,86.5%与77.8%(累积生存曲线函数见图1)。

图1 结直肠癌患者累积生存曲线函数
2.6 各亚组生存率的比较 依据60例结直肠癌患者的临床特征分8个亚组,分别按性别、年龄、肿瘤位置、肿瘤大小、化疗前血清CEA值、病理分期、分化程度、有无合并症等进行分组;经过相应统计学方法分析后结果显示:性别、年龄、肿瘤位置、肿瘤直径、肿瘤分期、分化程度及有无合并症与预后有关,差异有统计学意义(P<0.05)。术前CEA值对预后无影响(P>0.05)。
2.6.1 根据不同性别分组新辅助化疗后生存率的比较:本组60例大肠癌患者按性别分为两组:男性和女性,不同性别组新辅助化疗治疗的大肠癌患者详细结果见表6-1。
2.6.2 根据不同年龄分组新辅助化疗后生存率的比较:本组60例大肠癌患者按年龄分组:<60岁和≥60岁, 两个年龄组新辅助化疗治疗的结直肠癌患者通过寿命表法计算1年、2年、3年生存率,并对两组用Log-Rank法进行比较P=0.031(见表6-2)。

表6-1 性别不同的两组各年生存率

表6-2 不同年龄组别生存率
2.6.3 肿瘤直径不同的大肠癌患者新辅助化疗后生存率的比较:60例患者按肿瘤直径大小分为三组:计算结果见表6-3。

表6-3 直径不同三组的各年生存率
2.6.4 肿瘤位置不同的大肠癌患者新辅助化疗后生存率的比较:本组67例患者按肿瘤位置分为两组:结肠组和直肠组。结果见表6-4。

表6-4 肿瘤位置不同的两组各年生存率
2.6.5 不同分期的大肠癌患者新辅助化疗后生存率的比较:60例患者按大肠癌分期分为两组:B期组和C期组,不同组新辅助化疗的大肠癌患者统计分析结果见表6-5。

表6-5 不同分期的两组各年生存率
2.6.6 病理分型不同的大肠癌患者新辅助化疗后生存率的比较:60例患者,按癌组织病理分型分为三组:高分化腺癌组、中分化腺癌组、低分化腺癌组。结果详见表6-6。
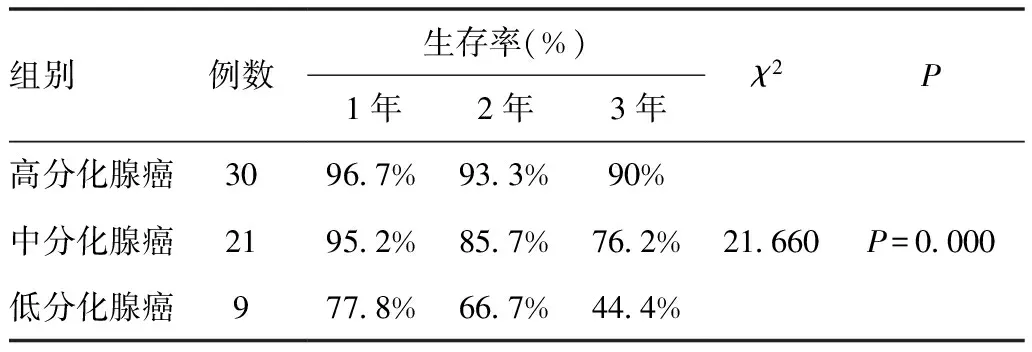
表6-6 不同病理分型的三组各年生存率
2.6.7 新辅助化疗前CEA阴、阳性的大肠癌患者化疗后生存率的比较:60例患者按CEA值分为两组:化疗前CEA阴性组和阳性组,不同组新辅助化疗的大肠癌患者的计算结果见表6-7。

表6-7 化疗前CEA阴、阳性两组的各年生存率
2.6.8 有无合并其他治疗的大肠癌患者治疗后生存率的比较:60例患者按有无合并其他疾病分为两组:单纯大肠癌组和合并其他疾病的大肠癌组。两组计算结果见表6-8。

表6-8 有无合并其他疾病的大肠癌术后各年生存率
3.讨论
大肠癌是临床最为多见的损害人们健康和生命的恶性肿瘤之一。世界范围内大肠癌发病概率正以2%的年增长速度增加,在亚洲以外的欧美等国家其发病率略低于肺癌[8,9],并且有研究者预测大肠癌极有可能成为全球发病率第一的肿瘤[10]。在亚洲和美洲,大肠癌以直肠癌为主,并且在我国具有独特的特征,年轻人直肠癌发病率较高,预后较差,且漏诊率和误诊率也很高[11,12]。对于大肠癌发生的机制已经研究了半个多世纪,早在上世纪50年代,有科学家就提出了其是一个多步骤、多环节的过程[13]。临床上对大肠癌的治疗以手术为主,但由于没有有效的早期诊断方法和抗肿瘤转移治疗的靶点,晚期大肠癌治疗效果较差[14]。近年,新的化疗药物及化疗方案的出现使大肠癌患者生存期的延长及生存质量的提高得到了较好的获益。即使根治性手术及全身的术后辅助化疗的临床应用,但大肠癌患者的复发率及死亡率仍然比较高。所以,新辅助化疗自然成了提升大肠癌治疗效果、减少其转移、降低其复发率和病死率的新手段。
3.1 新辅助化疗药物及方案的选择 大肠癌的辅助化疗方案是以氟尿嘧啶(5-FU)为基础的。ChauI等人[15]发现,持续静脉泵入5-FU+四氢叶酸(leucovorin,LV)与静脉滴注方案比较疗效有显著性差异,而不良反应相对较小。近年来奥沙利铂(Oxaliplatin,OXA)在大肠癌患者化学治疗中的疗效已得到广泛认可。在Ⅱ期、Ⅲ期大肠癌患者中应用FOLFOX4方案辅助化疗疗效的临床试验已在欧洲多中心随机对照试验(简称MOSA IC)得到了验证[16],并在美国临床肿瘤协会(简称ASCO)2002年年会上对该方案作为辅助化疗疗效的安全性做了首次报道。随后在ASCO年会上也陆续对应用FOLFOX4方案的大肠癌患者的3年、5年无病生存率以及Ⅲ期患者中6年总生存率均优于单纯应用5-FU/LV的患者做出了详尽的报道,表现出了奥沙利铂的临床治疗价值,进一步证实了大肠癌患者术后应用FOLFOX4方案在大肠癌患者中的优势。美国乳腺与肠道外科辅助治疗研究组(简称NSABP)在2007年的C207研究中也显示出单纯静脉应用5-FU/LV的临床疗效差于FOLFOX4方案,并且使大肠癌患者的无病生存期得到明显延长[17]。2009年美国国立综合癌症网络(NCCN)指南(中国版)对大肠癌患者的标准化疗方案推荐为FOLFOX 4方案。近年来我国已广泛应用此方案治疗大肠癌患者。因此我们的60例大肠癌患者的新辅助化疗均采用该方案。
3.2 新辅助化疗对患者血清CEA水平的影响 1965年癌胚抗原(carcinoembryonic antigen,CEA)由Gold和Pretman发现,是一种细胞内糖蛋白,目前在大肠癌的临床诊断和术后检测复发中公认的有意义的肿瘤标记物。CEA阳性在大肠癌患者中约占60%左右,有研究证实CEA的血清水平与肿瘤的病理分期有关[18],因此临床上我们可以通过对血清CEA阳性的人群进行追踪随访检测,可以尽可能早期发现肿瘤的发生发展以及评价预后,亦能够早期发现患者是否存在复发转移,此方面应加强关注。现阶段把CEA水平作为早期大肠癌的临床诊断价值仍不高。已有大量统计资料表明:大肠癌患者的血清CEA水平与Dukes分期呈正相关,随着患者Duke分期的早晚递增其血清CEA阳性率逐渐增加。目前对大肠癌患者血清CEA水平的检测主要用来判断预后和复发。王贻军等[19]报道了49例晚期大肠癌患者CEA水平与晚期结直肠癌姑息化疗疗效之间存在一定的关系,对晚期大肠癌姑息化疗后的效果评价,检测血清CEA水平有相应的临床意义,但由于病例数较少,结论值得进一步探讨。
本组60例结直肠癌患者,化疗前有14例<5μg/L,为阴性,共有46例≥5μg/L;经新辅助化疗1个疗程后,14例阴性患者中有7例CEA值升高,但均未超过5μg/L,化疗前46例CEA阳性的患者,CEA值在5.27~345.02μg/L,术前进行复查,有38例(82.61%)患者有不同程度的下降,下降幅度1.2~124μg/L不等,其中下降超过50%的患者有24例(52.17%),占下降患者中63.16%,14例(30.44%)下降幅度小于50%,8例(17.39%)较化疗前有所升高,升高幅度在1.67~10.62μg/L。进一步对升高的8例患者的临床资料进行整理分析发现:较化疗前相比,其肿瘤大小没有明显变化,甚至有所增大。任峰等[6]研究发现术前化疗可以使结直肠癌组织细胞增殖降低,凋亡指数增加。我们认为:8例血清CEA值升高患者可能与化疗药物的耐药性或敏感性不高有关。通过对60例结直肠癌患者新辅助化疗前后血清CEA值进行配对t检验(P<0.05),两组数据之间存在统计学差异,具有统计学意义。新辅助化疗可以降低结直肠癌患者血清CEA水平,进而控制结直肠癌的发生和发展。但化疗前血清CEA阴性的14例患者中有7例也有不同程度的升高,因此我们推断:新辅助化疗是否可以降低正常人的血清CEA水平值得今后进一步研究考证。
3.3 新辅助化疗对大肠癌患者生存率的影响 近年来以手术治疗为主,辅以术后化疗的治疗方法仍是治疗大肠癌的主要手段。有报道表明DukesA期的大肠癌患者术后5年生存率接近90%;分开来讲,结肠癌根治术后5年生存率约在70%上下,直肠癌约为60%左右。由于大部分患者就诊时已处于C期或D期,预后较差[20,21]。英国医学协会大肠癌化疗研究组的研究结果显示:在根治性手术加术后规律化疗的基础上辅以术前化疗,能使进展期大肠癌患者的生存率得到显著提高[22,23]。Mehta等[24]展开了一项Ⅱ期临床研究,对接受术前化疗的患者并没有延长手术住院时间,病患经济负担没有增加,临床疗效肯定。Uzcudun等[25]展开的相应临床研究也证实了上述观点,患者生存期得到较大获益。
虽然新辅助化疗对大肠癌患者的临床预后有了重大进展,但有一组临床实验显示:对于可切除的大肠癌伴有肝转移的患者,新辅助化疗后其生存率没有明显改变;但分层统计显示:行新辅助化疗并肿瘤病灶反应稳定的患者5年生存率高达85%,明显高于未行新辅助化疗的患者[26]。也有学者认为对进展期的大肠癌患者5年生存率低于10%,可考虑是否放弃手术治疗[27]。两种结果截然相反,结论值得商榷。亦有研究与本组研究结论相近:新辅助化疗可使部分不可Ⅰ期切除的肿瘤病灶转变为可切除[28]。
本组60例大肠癌患者,新辅助化疗治疗大肠癌患者1年、2年、3年累积生存率为93.3%,86.5%与77.8%,与国内外报道的水平相当或略高。我们分别按性别、年龄、肿瘤位置、肿瘤大小、化疗前血清CEA值、病理分期、分化程度、有无合并症等临床特征,分析各临床亚组与患者预后的关系,我们的结果是:年龄组:23例<60岁的患者1年、2年、3年累积生存率为100%,100%与95.7%,≥60岁患者分别为89.2%,78.4%与67.6%,两组比较P<0.05;性别组:男性患者1年、2年、3年累积生存率为90.6%,81.3%与68.8%,女性为96.4%,92.9%与89.3%,两组比较P<0.05;肿瘤直径大小组:直径≤3.0cm 1年、2年、3年累积生存率为96.0%,92.0%与88.0%,3.1~4.9cm为95.5%,86.3%与81.8%,≥5.0cm为84.6%,76.9%与53.8%,<5.0cm与≥5.0cm比较P<0.05;不同位置组:结肠癌1年、2年、3年累积生存率为100%,95.8%与83.3%,直肠癌为88.9%,80.6%与69.4%,两组比较P<0.05;不同病理分期:B期1年、2年、3年累积生存率为100%,96.9%与93.8%,C期为85.7%,75.0%与60.7%,两组比较P<0.05;不同病理分型:高分化腺癌1年、2年、3年累积生存率为96.7%,93.3%与90%,中分化腺癌为95.2%,85.7%与76.2%,低分化腺癌为77.8%,66.7%与44.4%,两两比较P<0.05;化疗前CEA水平:化疗前CEA阴性的患者1年、2年、3年累积生存率为92.8%,95.7%与78.6%,化疗前CEA阳性为93.5%,86.9%与78.3%,两组比较P>0.05;有无合并其他疾病:无合并其他疾病的患者1年、2年、3年累积生存率为100%,92.9%与85.7%,合并有其他疾病的为91.3%,86.9%与78.2%,两组比较P<0.05。在我们的结果中,虽然性别组新辅助化疗后1年、2年、3年累积生存率差异有统计学意义,但将不同的性别组在相同的年龄段、肿瘤位置、肿瘤直径等相同的条件下进一步分析,由于病例数太少,改组就没有临床意义。综上所述,我们得出结论:新辅助化疗治疗大肠癌患者1年、2年、3年累积生存率与患者年龄、肿瘤位置、肿瘤直径、肿瘤分期、分化程度及有无合并症等有密切相关,与术前CEA值无明显相关,差异有统计学意义(P<0.05)。秦海霞等[29]对56例≥75岁的高龄大肠癌患者行手术加术后化疗研究结果显示:1年、2年、3年生存率分别为83.3%,68.3%与55.4%,与本组≥60岁患者的1年、2年、3累积生存率相比低很多,体现了术前化疗的优越性。但也有研究显示新辅助化疗并不能提高无瘤生存率及延长总生存期[30]。秦海霞等[31]另外一组单因素研究显示:DukersA期1年、3年、5年生存率为100%,75%与37.5%,DukersB期为100%,79.16%与64.57%,DukersC期为97.16%,70.55%与56.05%,明显低于本组患者,高、中、低分化腺癌的生存率亦低于本组;我们可以认为,新辅助化疗在提高短期生存率方面使大肠癌患者获益。有研究证明新辅助化疗能够使结直肠癌患者获得较理想的生活质量及长期生存[32]。但由于本组研究随访时间较短,加之患者术后给予常规辅助化疗,因此不能有效地反应新辅助化疗对患者长期生存的临床作用,这一点可能需要新的评价方法来验证。
3.4 新辅助化疗并发症的分析 常规化疗药物在治疗结直肠癌的过程中,药物副作用不可避免,但因个体差异其表现不尽相同,本组研究的60例大肠癌患者中,化疗副损伤表现为:发热4例(6.67%),恶心、呕吐22例(36.67%),白细胞降低18例(30%),皮肤瘙痒2例(3.33%),轻微脱发3例(5%),皮肤潮红1例(1.67%),血压升高9例(15%),未出现肠穿孔、感觉神经异常及手足综合症等。孙秀梅等[33]一组研究显示:78例新辅助化疗大肠癌患者两周期后,白细胞减少的发生率为20.51%,血小板减少率为3.85%,恶心呕吐的发生率为32.05%,腹泻的发生率为25.64%,其结果与本组相比相关不良反应发生率相当,给予相应对症处理后,短时间内均有明显改善。本组研究中血压升高的病例占15%,可能是由于患者的基础疾病在新辅助化疗过程中病情反复引起。
综上所述,结直肠癌患者给予术前化疗可以有效降低患者血清CEA水平,并发症较少且轻微,表现出良好的临床疗效。同时本研究也为今后的肿瘤学研究提供了可信的实验室数据;但大肠癌患者预后的影响因素较复杂,要确定哪些为独立的影响因素及最重要的影响因素,还需要大样本多中心的临床对照研究。确定术前化疗患者的长期生存状况及该方法的优势,仍需长时间的临床观察及随访。
1 Garcia M,Jemal A,Ward EM,et al.Global Cancer Facts&Figures 2007[[M/OL].Atlanta,GA:American Cancer Society.2007:25-26.
2 He J,Gu D,Wu X,et al.Major causes of death among men and women in China[J].N Engl J Med,2005,353(11):1124-1134.DOI:10.1056/NEJMsa050467.
3 王继恒,李世荣.我国结直肠癌筛查和早期诊断十年回顾:1994~2005[J].胃肠病学,2006,11(4):245-250.DOI:10.3969/j.issn.1008-7125.2006.04.015.
4 孙燕.五十年来我国临床肿瘤学的发展、现状和策略//中国临床肿瘤教育专辑(2009)[M].中国协和医科大学出版社,2009:1-2.
5 Chau I,Cunningham D.Adjuvant therapy in colon cancer—what,when and how[J].Ann Oncol,2006,17(9):1347-1359.DOI:10.1093/annonc/mdl029.
6 董志伟,乔友林,李连弟,等.中国癌症控制策略研究报告[J].中国肿瘤,2002,11(5):250-260.DOI:10.3969/j.issn.1004-0242.2002.05.001.
7 宋传健,张洪伟,王为忠.新辅助化疗对胃癌细胞凋亡与增殖及其细胞免疫功能的影响[J].肿瘤防治杂志,2003,10(7):704-706.DOI:10.3969/j.issn.1673-5269.2003.07.011.
8 Jemal A,Siegel R,Ward E,et al.Cancer statistics,2009[J].CA Cancer J Clin,2009,59(4):225-249.DOI:10.3322/caac.20006.
9 Kakizoe T.Asian studies of cancer chemoprevention:latest clinical results[J].Eur J Cancer,2000,36(10):1303-1309.DOI:10.1016/s0959-8049(00)00107-6.
10 Potter JD,Slattery ML,Bostick RM,et al.Colon cancer:a review of the epidemiology[J].Epidemiol Rev,1993,15(2):499-545.DOI:10.1093/oxfordjournals.epirev.a036132.
11 Howe HL,Wu X,Ries LA,et al.Annual report to the nation on the status of cancer,1975~2003,featuring cancer among U.S.Hispanic/Latino populations[J].Cancer,2006,107(8):1711-1742.DOI:10.1002/cncr.22193.
12 Remontet L,Estève J,Bouvier AM,et al.Cancer incidence and mortality in France over the period 1978~2000[J].Rev Epidemiol Sante Publique,2003,51(1 Pt 1):3-30.
13 Potter JD.Colorectal cancer:molecules and populations[J].J Natl Cancer Inst,1999,91(11):916-932.DOI:10.1093/jnci/91.11.916.
14 Qian W,Hu LF,Chen F,et al.Infrequent MDM2 gene amplification and absence of gross WAF1 gene alterations in nasopharyngeal carcinoma[J].Eur J Cancer,B,Oral Oncol,1995,31B(5):328-332.DOI:10.1016/0964-1955(95)00034-8.
15 Chau I,Cunningham D.Adjuvant therapy in colon cancer—what,when and how[J].Ann Oncol,2006,17(9):1347-1359.DOI:10.1093/annonc/mdl029.
16 De Gramont A,Boni C,Navarro M,et al.Oxalip latin /5FU /LV in adjuvant colon cancer:Updated efficacy results of theMOSA IC trial,including survival,with a median follow2up of six years[J ].JClin Oncol,2007,25 (18S):a4007.
17 Kuebler JP,Wieand HS,O’ConnellMJ,et al.Oxalip latin combined with weekly bolus fluorouracil and leucovorin as surgical adjuvant chemotherapy for stage Ⅱ and Ⅲ colon cancer:results from NSABP C207[J ].J Clin Oncol,2007,25 (16):2198-2204.
18 Sakakura C,Hagiwara A,Yamazaki J,et al.Management of postoperative follow-up and surgical treatment for Krukenberg tumor from colorectal cancers[J].Hepatogastroenterology,2004,51(59):1350-1353.
19 Wang yijun,Xu shen.CEA level and the efficacy of chemotherapy between advanced colorectal cancer[J].Proceeding of Clinical Medicine,Mar,2010,19(3B):276-277.
20 Chadha MK,Kuvshinoff BW,Javle MM.Neoadjuvant therapy for gastric cancer[J].Oncology (Williston Park,NY),2005,19(9):1219-1227.
21 Hundahl SA,Phillips JL,Menck HR.The National Cancer Data Base Report on poor survival of U.S.gastric carcinoma patients treated with gastrectomy:Fifth Edition American Joint Committee on Cancer staging,proximal disease,and the "different disease" hypothesis[J].Cancer,2000,88(4):921-932.
22 Ng K,Meyerhardt JA,Fuchs CS.Adjuvant and neoadjuvant approaches in gastric cancer[J].Cancer J,2007,13(3):168-174.DOI:10.1097/PPO.0b013e318074e351.
23 Cunningham D,Allum WH,Stenning SP,et al.Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer[J].N Engl J Med,2006,355(1):11-20.DOI:10.1056/NEJMoa055531.
24 Mehta VK,Cho C,Ford JM,et al.Phase II trial of preoperative 3D conformal radiotherapy,protracted venous infusion 5-fluorouracil,and weekly CPT-11,followed by surgery for ultrasound-staged T3 rectal cancer[J].Int J Radiat Oncol Biol Phys,2003,55(1):132-137.DOI:10.1016/s0360-3016(02)03863-4.
25 Uzcudun AE,Batlle JF,Velasco JC,et al.Efficacy of preoperative radiation therapy for resectable rectal adenocarcinoma when combined with oral tegafur-uracil modulated with leucovorin:results from a phase II study[J].Dis Colon Rectum,2002,45(10):1349-1358.DOI:10.1097/01.DCR.0000027041.16638.28.
26 Benoist S,Nordlinger B.Neoadjuvant treatment before resection of liver metastases[J].Eur J Surg Oncol,2007,33(Suppl 2):S35-S41.DOI:10.1016/j.ejso.2007.09.022.
27 Adam R,Pascal G,Castaing D,et al.Tumor progression while on chemotherapy:a contraindication to liver resection for multiple colorectal metastases[J].Ann Surg,2004,240(6):1052-1061.DOI:10.1097/01.sla.0000145964.08365.01.
28 Pozzo C,Barone C,Kemeny NE.Advances in neoadjuvant therapy for colorectal cancer with liver metastases[J].Cancer Treat Rev,2008,34(4):293-301.DOI:10.1016/j.ctrv.2008.01.004.
29 秦海霞,南克俊,杨光,等.高龄大肠癌患者56例预后因素分析[J].第四军医大学学报,2003,24(20):封3-封3.DOI:10.3321/j.issn:1000-2790.2003.20.045.
30 秦海霞,南克俊,杨光.老年大肠癌生存分析[J].现代肿瘤医学,2003,11(5):357-359.DOI:10.3969/j.issn.1672-4992.2003.05.015.
31 罗丽莹,吕韶敏,刘文超.奥沙利铂联合氟尿嘧啶四氢叶酸治疗胃肠道恶性肿瘤43例[J].第四军医大学学报,2002,23(5):475-475.DOI:10.3321/j.issn:1000-2790.2002.05.040.
32 Sun X M,Gao F,Li G X,et al.Influence of new neoadjuvant chemotherapy on the prognosis and the protein expression of CD44v6 and p27 in patients with colorectal cancinoma[J].Chinese Journal of New Drugs,2011,20(17):1695-1698.

