不同频率电项针对PCPA致失眠大鼠睡眠时相及血清ACTH、CORT含量的影响
吴建丽,韩 璐,刘旭东,王永亮,张淑香,杜冬梅,王天琪,梅荣军*
(1.黑龙江中医药大学针灸研究所,哈尔滨 150040;2.黑龙江中医药大学第二临床医院,哈尔滨 150001;3.黑龙江中医药大学,哈尔滨 150040)
人类的睡眠和觉醒状态是随着昼夜周期的节律性而相互转化的,良好的睡眠是促进机体生长、恢复精力和体力的重要环节。随着生活节奏的加快和工作竞争压力的增大,失眠的发病率不断升高。调查表明,我国约有45.5%的人遭受失眠的困扰[1]。针刺被认为是临床治疗失眠行之有效的非药物疗法之一,其对失眠后脑电睡眠结构的修复及中枢神经递质、体内激素和肽类物质的内在调节机制一直是临床和科研工作者的重要研究课题。有实验研究表明针刺有促进睡眠的作用,其机制可能通过延长慢波和快动眼睡眠时间、增加睡眠深度来改善睡眠[2-3],同时针灸还可以调节褪黑素、生长激素、皮质酮、睡眠诱导肽等激素和肽类活性发挥催眠作用,调整睡眠周期[4-5]。本实验旨在通过PCPA法制备失眠大鼠模型,选用双侧项部腧穴结合不同频率电针刺激干预失眠大鼠,观察不同频率电项针对失眠大鼠睡眠时相及血清ACTH、CORT含量的影响,探讨电项针促眠的作用机制及不同刺激频率电项针的疗效差异。
1 材料和方法
1.1 实验动物 健康清洁级Wistar大鼠40只,雄性,9周龄,体质量(230±20)g,哈尔滨医科大学实验动物学部提供,实验动物生产许可证号:SCXK(黑)2013-001。实验前适应性饲养1周,室温保持在22 ℃左右,所用实验大鼠的使用和喂养遵守动物保护协会的规定。
1.2 主要试剂与仪器 4-氯-DL-苯基丙氨酸(Sigma公司进口的分装,Maya化学公司),水合氯醛(天津市凯通化学试剂有限公司),大鼠ACTH、CORT ELISA试剂盒(南京建成生物研究所),VERSA max酶标仪(美国Molecular Devices公司),HHS21-6电热恒温水浴锅(上海跃进医疗器械厂),一次性针灸针(北京中研太和医疗器械有限公司),牙科204型南韩打磨机(哈尔滨市道外区新世纪科学器材商),MedLab-U/4C501H生物信号采集系统(南京美易科技有限公司),6805-AⅡ型电针仪(汕头市医用设备厂有限公司)。
1.3 皮层电极埋置 参照文献[6]埋置大鼠皮层脑电电极,10%水合氯醛腹腔注射深度麻醉大鼠(3 mL/100 g),用脑立体定位仪固定,剃除头部毛发,碘伏消毒,剪开头部皮肤充分暴露颅骨,用30%的双氧水去除颅骨表面的脂类,充分暴露颅骨的冠状缝和人字缝。用牙科打磨机分别在颅骨(AP-2,R2;AP+2,R2)钻孔,用眼科镊将2个直径1 mm的眼镜螺丝植入钻孔内,使之接触不要刺穿硬脑膜,作为皮层电极;在额骨正中(AP+5,R0)钻孔,放入眼镜螺丝作为接地电极,记录脑电波形。所有螺丝术前制成微型3孔子母插座,电极用502胶水固定在颅骨上,然后缝合皮肤切口,连续3 d腹腔注射4万U青霉素。术后单笼饲养,恢复7 d。
1.4 制备模型 埋置电极7 d后,除空白组外,采用PCPA腹腔注射法制备大鼠失眠模型[7]。造模前进食水12 h,于每日上午9:00开始抓取大鼠,在腹腔部缓慢注入PCPA混悬液,剂量为10 mL/kg,1次/d,连续2 d。28~30 h后模型形成。大鼠出现昼夜节律消失,对周围声音、光刺激敏感,兴奋性增高,表明造模成功。
1.5 分组及处理 将40只大鼠随机分成空白组,模型组,电项针1组、电项针2组、电项针3组,每组8只。空白组:正常饮水进食,自由活动每日均抓取称重,固定四肢和躯干,保证同余下各组刺激相同,不做其他处理。模型组:造模前12 h禁食禁水,造模后恢复正常,每日称重和固定,保证相同刺激条件,不做其他处理。电项针Ⅰ、Ⅱ、Ⅲ组:造模前12 h禁食禁水,造模后恢复正常饮食,每日电项针针刺30 min,连续治疗7 d。所有大鼠在造模前1周进行埋置颅骨电极手术,在末次治疗后描记脑电。
1.6 针刺治疗方法 造模成功后第1天,除空白组和模型组,其余各组给予电项针治疗,穴位选取大鼠项部双侧“风池” 穴和“供血” 穴。用0.25 mm×25 mm一次性毫针,直刺7~10 mm,连接电子脉冲治疗仪,导线分别上下连接同侧针柄,刺激频率电项针Ⅰ组为2 Hz、电项针2组为50 Hz、电项针3组为100 Hz,针刺30 min。取穴方法参照《实验针灸学》[8]。
1.7 指标检测
1.7.1 脑电采集与分析 正式描记脑电的前一天将3孔微型插座的子母端连接,对大鼠进行适应性训练,持续时间3 h。末次治疗后在电磁屏蔽室对所有大鼠进行脑电描记,每只大鼠连续记录脑电3 h。描记脑电前设置MedLab-U/4C501H生物信号采集系统参数,放大倍数200倍,上限频率30 Hz,下限频率2 s,采样速度250 ms/div,勾选硬件50 Hz陷波,脑电清晰未见重叠。脑电分析采用目测法,以20 s为一分段单元进行睡眠分析,如一单元存有2种以上睡眠期,则以主导分期判断为这一单元性质。根据大鼠脑电图及有关文献[9-10]标准,此睡眠周期包括觉醒期(wake,W)、慢波睡眠期(slow wave sleep,SWS)、快波睡眠期(fast wave sleep,FWS)3个睡眠时相,总睡眠时间(Total sleep time,TST)是SWS和FWS之和。
2 结果
2.1 电项针对大鼠睡眠时相的影响 从表1中可知,模型组大鼠SWS1、SWS2、FWS、TST各期时间与空白组比较均明显减少,这表明制作失眠模型成功。各电项针治疗组分别与模型组比较,其结果为:1)3个治疗组对失眠大鼠SWS2、FWS、TST时间均有延长作用,差异具有统计学意义(P<0.05,P<0.01),电项针1组和2组对SWS1期的增加具有极显著性意义(P<0.01);2)3个不同刺激频率治疗组比较,结果显示电项针1组对各期睡眠时间的延长明显优于电项针2组和3组(P<0.01)说明电项针改善睡眠作用随着刺激频率的增加而减弱,低频刺激促眠作用有优于高频刺激的趋势,低频电项针恢复失眠大鼠睡眠节律的作用最强。
2.2 电项针对大鼠血清ACTH、CORT含量的影响 与空白组相比,模型组大鼠血清中ACTH和CORT含量显著升高,差异有统计学意义(P<0.01)。与模型组相比,各电项针治疗组血清中ACTH和CORT含量均降低,其中电项针1组和2组与模型组比较差异具有统计学意义(P<0.01,P<0.05)。3个治疗组之间比较,电项针1组ACTH和CORT含量改变优于电项针2和3组(P<0.01,P<0.05)。(见图1-2)
1.7.2 血清ACTH、CORT含量的测定 各组描记脑电后,用10%水合氯醛腹腔麻醉,剪开腹部皮肤,迅速找到腹主动脉采血3~5 mL,置于离心管内,静止20 min后,在低温离心机上以3 000 r/min的速度离心10 min,取上清也置于EP内,在-20 ℃冰箱保存待测。应用ELISA方法在VERSA max酶标仪上测定血清内ACTH、CORT的含量,试剂盒由南京建成生物研究所提供,严格按照说明书操作。

表1 不同频率电项针对大鼠脑电图睡眠时相的影响(x± s ,n = 8)

图1 各组大鼠血清中ACTH含量比较(x± s,8只大鼠/组)
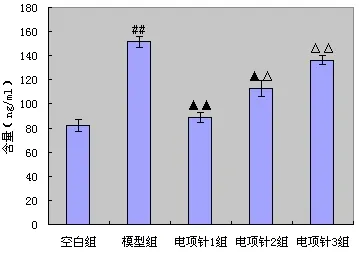
图2 各组大鼠血清中CORT含量比较(x± s,8只大鼠/组)
3 讨论
现代医学表明,失眠是由于大脑皮层的兴奋与抑制功能失调而引起的以睡眠始发和睡眠维持障碍为临床表现的一组疾病[11-12]。研究表明,失眠是导致内源性应激反应的一种重要因素,它能强烈兴奋下丘脑-垂体-肾上腺轴(HPA轴)影响体内多种激素的水平,引起机体内分泌系统、心脑血管系统、神经系统功能发生紊乱从而产生诸多病症[13-15]。西医多采用苯二氮卓类药物抑制大脑兴奋性来治疗失眠,但长期应用会出现成瘾性、耐药性、依赖性及反跳性失眠等不良反应[16-17]。
电项针疗法是高维滨教授利用多年临床经验结合现代解剖学理论创立治疗脑源性疾病的新方法。高教授在仔细研究了项部“风池”和“供血”穴的解剖结构后,发现二穴下有与睡眠-觉醒密切相关的脑干网状结构,通过针刺二穴并给予电流刺激,通过脑干上行激活系统使大脑皮层兴奋性增强,恢复兴奋与抑制过程的平衡,改善失眠状态,调整觉醒-睡眠周期[18-19]。
研究表明,脑电波是判断睡眠深度、反映睡眠各阶段特征变化的一种有效手段,能客观的记录实际睡眠维持时间、睡眠效率、睡觉结构等客观指标[20]。本实验利用生物信号采集系统描记大鼠的睡眠脑电,分别观察了正常大鼠、造模后大鼠及3种不同频率治疗组大鼠的脑电变化,并对结果进行分析。结果发现,PCPA致失眠大鼠TST明显减少,各频率针刺组均能通过延长失眠大鼠SWS1、SWS2和FWS期来延长TST,并且调整睡眠各期的比例与正常大鼠相近,提示电项针对失眠大鼠的睡眠有改善作用;同时发现2 Hz频率刺激组对各期睡眠时间的延长明显优于50 Hz和100 Hz,提示电项针促眠作用随着刺激频率的增加而降低,低频刺激恢复失眠大鼠睡眠节律的作用最强。
睡眠是中枢神经系统的自我调节过程,与机体内分泌激素之间存在明显的相关性。研究发现[21],HPA轴激活可以促进ACTH、CORT的合成和分泌,提高大脑皮层应激性并维持觉醒状态,这是引起失眠的重要原因。本实验结果显示,模型组大鼠血清ACTH、CORT含量明显增多,说明造模后,影响了血清激素的分泌,是大鼠失眠的原因之一。经过电项针治疗后,3个治疗组大鼠血清ACTH、CORT的含量均较模型组减少,说明电项针能抑制HPA的兴奋,促进睡眠。同时本实验通过比较2 Hz、50 Hz及100 Hz电项针刺激疗效,发现2 Hz治疗组大鼠血清ACTH、CORT含量降低的更为明显,说明不同的刺激频率治疗失眠具有不同的效应差异,低频电项针对睡眠的调节作用最好。
[1]朱尧,夏伟,刘溦溦,等.中医论治失眠研究进展[J].吉林中医药, 2016, 36(3):320-324.
[2]汤滴微.针刺“内关”对PCPA失眠大鼠基底节前脑腺苷含量及海马腺苷受体表达影响的研究[D].成都:成都中医药大学, 2015.
[3]张建新.针灸结合酸枣仁汤治疗失眠的实验研究[J].辽宁中医药大学学报, 2011, 13(5):221-222.
[4]郑美凤,何芙蓉,林煜芬,等.浅针山根穴治疗原发性失眠的疗效观察及对血清褪黑素的影响[J].浙江中医药大学学报, 2014, 38(7):902-905.
[5]陈桦,唐汉庆,郑建宇,等.针刺联合壮医药线点灸对睡眠剥夺大鼠相关神经递质的影响[J] .世界科学技术-中医药现代化, 2015, 17(10):2088-2093.
[6]许光辉,李廷利,郭冷秋,等.红景天苷对失眠大鼠睡眠周期的影响[J].医学研究生学报, 2008, 21(10):1036-1039.
[7]肖成荣,马增春,李海静,等.PCPA失眠大鼠模型的制作及其机制[J].毒理学杂志, 2007, 21(4):326.
[8]余曙光,徐斌.实验针灸学[M] .北京:人民卫生出版社,2016:285-290.
[9]Van Lier H, Drinkenburg WH,et al.Effects of diazepam and zolpidem on EEG beta frequencies are behavior-specific in rats [J] . Neuropharmacology, 2004, 47(2):163-174.
[10]卞宏生.昼夜节律对大鼠的睡眠模式和能量代谢的影响及褪黑素的干预作用研究[D] .哈尔滨:黑龙江中医药大学, 2015.
[11] Lovato N,Lack L,Wright H,et al.Working memory performance of older adults with insomnia [J].J Sleep Res,2013, 22(3):251-257.
[12]姚新,孟晴,张红石.中医药膳配合耳穴压籽对脑卒中患者睡眠障碍的影响[J] .长春中医药大学学报, 2017,33(1):92-93.
[13]顾思臻,窦丹波.中医中药对PCPA失眠大鼠模型HPA轴相关单胺类神经递质及激素影响的研究进展[J].上海中医药大学学报, 2015, 29(1):83-86.
[14]窦锡彬,张红参,李克明,等.壮医药线点灸联合针刺对失眠患者血浆Orexin及HPA轴的影响[J].右江民族医学院学报, 2013, 35(1):9-11.
[15]杨佳琳,宋红涛,张理义,等.睡眠剥夺对青年人神经内分泌激素的影响[J].中华保健医学杂志, 2014, 16(6):439.
[16]赵君,熊安.盐酸曲唑酮对苯二氮卓类药物依赖性失眠患者的药学分析[J] .抗感染药学, 2016, 13(5):1012-1014.
[17]张瀚元,刘兴山.失眠的中西医治疗[J] .长春中医药大学学报, 2015, 31(5):966-967.
[18] 栾依含,高维滨,胡霖霖,等.电项针治疗女性失眠症的临床观察[J].针灸临床杂志, 2012, 2(7):35-36.
[19]陈东,张健.高维滨教授临床验案举隅[J].中国中医急症,2011, 20(4):575-591.
[20]路英智,任清涛,宗莉,等.失眠症患者的多导睡眠图的量化标准研究[J].神经病学与神经康复学杂志, 2013,10(3):151-154.
[21]肖爱娇,王河宝,刘海云.热敏灸对失眠大鼠模型血清内分泌激素水平的影响[J].江西中医学院学报, 2013,25(4):32-36.

