Cu基催化剂催化甲醇水蒸气重整制氢研究进展
陈明旭,梅占强,陈柯臻,罗永明
经过多年的发展,氢能源已广泛地应用于石油提炼、氨氮行业、金属加工等领域[1],是最具发展潜力的可替代能源[2]。目前制氢技术主要有蒸汽重整制氢、电解水制氢、太阳能分解水制氢、生物制氢、核能制氢等[3-4]。蒸汽重组制氢所用的燃料主要包括甲烷、甲醇、乙醇和石油等[5]。
Cu基催化剂具有良好的性能,广泛地应用于甲醇重整制氢中。文献报道的催化剂大多催化活性已经很好[6],甲醇转化率几乎都能达到100%[7];因此,研究重点逐渐从提高甲醇转化率和H2选择性,转变到如何有效降低CO的选择性和积碳[8]。采用了适当的表征手段探寻CO和积碳的生成机理,并通过添加助剂和改善制备方法来降低CO和积碳的影响[9]。
本文归纳了Cu基催化剂上甲醇水蒸气重整制氢反应的三个不同催化反应机理;综述了催化剂制备方法对反应温度、甲醇转化率、氢选择性、CO选择性及氢产量等指标的影响;归纳了Cu基催化剂失活的主要原因为热力学烧结、积碳烧结、硫化物中毒和氯化物中毒等;讨论了不同载体对催化剂的结构和热稳定性的影响。
1 反应机理
1.1 平行反应过程
早期的研究认为甲醇会同时生成CO和CO2[10],反应机理见式 (1)~(3)。
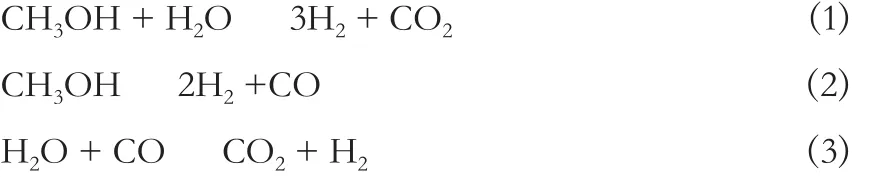
1.2 分解变换过程
该研究指出甲醇水蒸气重整反应主要由甲醇裂解反应和水汽转化反应组成,分别见式(4)~(5)。

认为CO主要来自于甲醇的直接分解反应,因此当反应趋于平衡时,CO的总浓度应与水汽转化反应中的浓度相等或稍大。然而,Amphelett等[11]在实验中检测到的CO浓度却比使用该研究计算得到的低很多,一开始认为是部分反应生成的CO在Cu催化剂表面形成了积碳,但是在反应期间并没有明显检测到催化剂失活[12-13];这说明甲醇的直接分解并非CO的主要来源。
1.3 分解逆变换过程
随着对反应机理研究的越发深入,发现并证实了中间产物甲酸甲酯的存在,Takahashi等[14]通过实验提出了另一种机理,见式(6)~(8)。
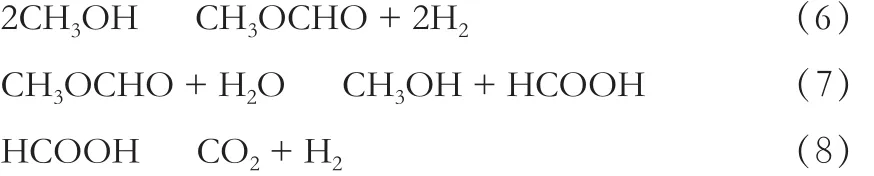
甲醇在水蒸气的作用下首先生成甲酸甲酯和H2,甲酸甲酯再经过一系列的反应生成CO2和H2[15-16];式(7)是控速反应,另外,通过逆水汽转化(RWGS)反应会生成极少量的CO,见式(9)。
CO2+ H2CO + H2O (9)
该理论认为甲醇并不会直接产生CO,而是先产生甲酸甲酯等中间产物[17-18];CO是由随后的RWGS反应生成的。然而 Tonner等[19]在对甲醇脱氢反应的研究过程中发现,H2和CO在催化剂上的吸附热较小,说明CO并不是由RWGS反应产生,猜测可能是甲酸甲酯去羰基化的产物。
另外,一些研究结果显示在甲醇重整制氢的过程中,Cu催化剂上的活性位点发挥的作用已经得到了解释,Patel等[20]研究指出,在反应的过程中,第一类活性位点主要催化甲醇重整制氢的反应,第二类活性位点主要催化RWGS反应[21],展示了这种机理的过程[22]。具体而言,第一类活性位点是将反应过程中生成的含碳化合物中的羟基脱去,使其成为甲酸或甲酸盐,第二类活性位点是用于促进活性H的生成,使其进一步生成OH,OH可进一步生成表面活性氧[23]。以往研究认为Cu基催化剂的活性位点就是金属Cu,然而,有研究表明除了金属Cu外,在催化剂的表面也发现了大量Cu2O,且催化剂的催化活性越强,Cu2O含量越高,这说明Cu2O具有反应的活性。Idem等[24]将这种现象归于Cu2O易于断裂醇类的OH键,促进了甲醇的裂解;相比较而言,金属Cu起到了断裂C—H键的作用;两者共同构成了活性中心,然而对Cu2O和金属Cu对于活性中心贡献的大小依然在争论中。
综上所述,虽然甲醇重整制氢的反应机理还在讨论中,但甲醇首先在Cu催化剂表面脱氢生成甲氧基,随后产生甲酸甲酯等中间产物,再生成H2,CO2,CO等,CO还可能来自于RWGS反应,Cu催化剂中的活性位点不仅有金属Cu,还有Cu2O,两者都对提高催化剂的活性起到了作用。
为了提高H2产量,同时减少CO的生成,降低对燃料电池电极的影响,以助于车载燃料电池的小型化[25-27],必须获得高性能的Cu基催化剂。对于甲醇重整制氢而言,催化剂的性能直接影响制氢的效果。
2 制备方法对制氢效果的影响
Talkhoncheh 等[28]分别采用硝酸尿素燃烧合成法和均匀沉淀法合成了CuO/ZnO/ZrO2/Al2O3催化剂和CuO/ZnO/Al2O3/ZrO2/CeO2催化剂,并与传统的共沉淀法和湿式浸渍法相对比,讨论了制备方法对催化剂性能的影响。实验结果表明,采用硝酸尿素燃烧合成法和均匀沉淀法获得的Cu基催化剂催化甲醇分解的效果更加理想,且这种现象在低温下更加显著。在220 ℃下,利用尿素燃烧合成法制备的催化剂甲醇转化率可达90%,而采用均匀沉淀法制备的催化剂则可将甲醇完全转化。在200 ℃以下,温度越低,两种制备方法获得的催化剂的性能差距越大,但均匀沉淀法的效果更好,这可能是因为催化剂的结构通过均匀沉淀后获得优化,裂解甲醇的效果更好。Ajamein 等[29]在 N2氛围下采用微波辅助法合成了CuO/ZnO/Al2O3催化剂,在220 ℃时,可实现甲醇完全转化;H2选择性达到80%,CO选择性仅有5%,在200 ℃以下未检测到催化剂对CO有选择性,超过300 ℃,CO选择性没有显著增长。归纳部分由其他方法制备的CuO/ZnO/Al2O3催化剂的性能可知,由共沉淀法获得的催化剂即使在高温下甲醇依然无法完全转化,而通过湿式浸渍法得到的催化剂在300 ℃时可将甲醇完全转化。采用微波辅助法实现甲醇完全转化所需温度更低,且CO极少产生,基于BET和TEM表征可知,微波辅助法强化了CuO和ZnO之间的相互作用,减小了CuO的粒径,增大了结构晶格中活性Cu相的分布。Xu等[30]分别采用共沉淀法和活性炭纳米铸造法制备了Cu-Zn-Al-Ga催化剂,分别命名为CuZnAlGa-C和CuZnAlGa-A,并讨论了制备方法对催化剂性能的影响。BET表征结果显示,相比于共沉淀法,活性炭纳米铸造法合成的CuZnAlGa中金属Cu,Zn,Ga的含量更高,活性Cu的分散效果更好,金属-载体的相互作用更显著。在活性评价实验中,在275 ℃时,两种催化剂均达到最佳工作状态,CuZnAlGa-C的甲醇转化率和产氢量分别达到75%和70%,并伴随有3%(w)的HCHO和微量CO,相比而言,CuZnAlGa-A的甲醇转化率达86.1%,产氢量达74.6%,1%(w)的HCHO,未检测到CO。CuZnAlGa-C运行5 h后逐渐失活,60 h后甲醇转化率和产氢量分别跌至70%和68%,HCHO的产量增加到5%(w)。采用CuZnAlGa-A的制氢过程中,运行70 h后,甲醇转化率和产氢量均无明显下降,HCHO含量稳定在1%(w)。对运行后的催化剂进行XRD和TPO表征,发现两种催化剂的表面都存在不同程度的异质性碳沉积,在CuZnAlGa-A表面的碳沉积多属于无定形碳,容易气化,沉积不够稳定[31];CuZnAlGa-C的表面则大多被石墨碳覆盖,石墨碳在高温下才能被气化,因此更加稳定[32],对催化剂的性能产生显著影响。
综上所述,制备方法对催化剂性能的影响不可忽视。良好的制备方法能够改善Cu基催化剂的物理化学性质,提高其中的活性Cu相的分散水平;降低反应活化能,使催化剂在较低的温度下就可达到最佳催化效果;可一定程度提高反应活性,加快积碳气化。
3 载体对性能的影响
载体(Al2O3、Ga2O3、ZrO2、CeO2和碳纳米管(CNT)等)会不同程度提高催化剂的性能。近年来,研究人员合成了大量具有良好催化效果的Cu基催化剂(如Cu/ZnO,CuO/Al2O3,CuO/ZnO/Al2O3,CuO/CeO2等),认为这些催化剂发挥良好催化效果与所使用的载体密切相关。
3.1 优化催化剂的结构
对于负载型催化剂而言,采用合适的载体可加强Cu与载体间的相互作用,改善Cu不能良好地分布于催化剂表面、催化剂的孔道狭窄及Cu比表面积较小等问题,一定程度提高甲醇的转化率及H2和CO的选择性。Witoon等[33]研究发现ZrO2载体是由三种多晶型组成的,分别为单斜晶型、立方晶型和四方晶型。其中单斜晶型中羟基的浓度和碱度最大,能够提高Cu的分散度,增大催化剂的比表面积和Cu的反应活性,从而提高CuO/ZrO2催化剂在甲醇重整制氢过程中的活性[34-39]。Huang等[37]采用固态反应法制备了Cu2Al2O4催化剂,BET表面测试发现与Cu基商业催化剂相比,Cu2Al2O4具有较小的晶体粒径(27.4 nm),并在320 ℃时H2产生速率显著增高;还有一些载体具有改善金属分布,减小金属粒径的作用,Yang等[38]在活性炭载体研究的基础上,将Cu负载在CNT上,发现由于CNT的特殊性质,使金属Cu的粒径大大降低,并改善了Cu在载体表面的分布情况,H2产量高达98.7%,Basov[39]将Ni和Cu按原子比为1∶4负载在ZrO2上,合成的Ni-Cu/ZrO2催化剂的比表面积和平均粒径分别高达175 m2/g和37 nm,在325 ℃时,H2产量高,且CO的产量极低,完全可保证燃料电池的稳定运行。这是由于添加了ZrO2后,表面高度分散的Cu提高了甲醇在催化剂表面的吸附效果,使主反应更显著,副反应较弱,从而减少了CO产量。
3.2 提高催化剂在高温下的表现
甲醇水蒸气重整制氢通常需要在250~350 ℃下长期运行,催化剂中的负载金属可能会发生烧结或含碳化合物发生反应,在催化剂的表面形成积碳,导致金属比表面积和BET比表面积迅速下降,制氢效果受到严重影响;另外,过多的水蒸气还会进一步加大这一影响。Palo等[40]利用均匀沉淀法制备了CuO/ZnO/Al2O3催化剂以改善传统Cu-Zn催化剂在高温下易发生烧结的缺点,在最佳条件下,甲醇转化率接近100%,且长周期运行几乎未见下降。相比之下,商业CuO/ZnO催化剂的甲醇转化率仅有60%,并几乎反应一开始就在下降;在高温下,负载的Cu还可能发生减活化作用,甚至可能发生自燃,完全失去催化活性。针对商业Cu基催化剂运行温度高,Cu容易发生自熔的问题,Khzouz等[41]制备了Ni-Cu/Al2O3催化剂,并应用于甲醇以及甲烷的水蒸气重整制氢的实验中,发现反应温度更低,甲醇为275~325 ℃、甲烷为600~650 ℃。Wan等[42]在研究中提到商业Cu/ZnO催化剂中Cu吸附甲醇并将其转化为含甲基的物质,ZnO则将这些物质转化为甲酸盐,将Cu/ZnO负载在CeO2载体上,由于CeO2具有高氧储存容量,可减少CO的浓度,提高Cu/ZnO的热稳定性。
对于高性能Cu基催化剂,载体通常会不同程度提高催化剂的物理化学性能,降低反应温度;载体还具有高氧储存能力,加快副产物转化为H2和CO2,减缓催化剂失活的速度。
4 Cu基催化剂的失活
4.1 热力学烧结
热力学烧结导致Cu基催化剂失活的主要原因是Cu对高温的忍受能力有限。Lindstrom等[43]结合实验提出了金属的热稳定性顺序:Ag < Cu < Au <Pd < Fe < Ni < Co < Pt < Rh < Ru < Ir < Os < Re。 采用Cu基催化剂进行甲醇重整制氢时,一般只能在300 ℃以下运行。在此温度范围内,大多数Cu基催化剂中Cu不会快速烧结,能正常运行,而且对CO的选择性不高,也不会产生大量碳氢化合物。然而,即使是在这种温度下,长期运行依然会导致一些Cu催化剂孔道坍塌,进而逐渐失活。Cu基催化剂多含有CeO2,ZnO,Al2O3,Cr2O3等氧化物,可一定程度减少催化剂受热力学的影响[44-45],但Cu基催化剂的失活与制备方法也有一定关系。
4.2 积碳导致失活
积碳和热力学烧结有一定关系,高温既可能导致热力学烧结,也可能引发一系列副反应导致积碳的产生。发生积碳最重要的原因是Cu本身无法有效断裂C—O键,或者形成C—C键,导致在反应过程中形成的碳氢化合物不能有效地转化为CO2和H2,最终成为积碳。Remiro等[46]探讨了积碳的形成机理,积碳的形成是C活性前体稳定化的结果,C活性前体反应活性较强,在Cu基催化剂表面与多种物质发生反应;CO在高温下会发生反应生成单质碳,也进一步加重了积碳。有文献报道,制备过程中材料受到污染也可能导致积碳,若掺杂了(如Fe,Mn等)过渡金属,可能会催化甲醇发生脱氢反应,产生积碳;Cu催化剂中添加含酸性位点的氧化物(如Al2O3)也会加快生成单质碳[47]。
4.3 硫化物中毒
Cu基催化剂本身稳定性不强,低浓度的硫化物就能够阻塞其活性位点;Cu还可能会与S结合生成大块的CuS,CuS还会吸附在催化剂的表面,进而影响其性能,而且高温还会加快CuS的形成。
Cu催化剂中添加ZnO可有效抑制H2S中毒。H2S通过与ZnO反应,形成的ZnS分为微晶锌(α-ZnS)和闪锌(β-ZnS)。Cu催化剂表面和H2S的反应与催化剂表面的多种含氧物质密切相关。在低温环境中,各种具有反应活性的氧分子会聚集在Cu(110)晶面周围,一般由5~6个氧原子构成,或两个氧原子组合在一起形成二聚体,形成稳定的—O—Cu—O—Cu—O—链,即使氧浓度极低时也会快速发生反应,破坏Cu催化剂表面的稳定结构,导致后续催化剂中毒;当环境中存在硫化物时,链中的氧原子会被硫原子代替,其反应活化能(小于18 kJ/mol)和反应温度(-195~100 ℃)都极低,反应几乎会自发进行。
4.4 氯化物中毒
氯化物中毒可引发Cu基催化剂的严重失活,原因可能为:1)与催化剂中Cu发生反应,阻塞活性位点或改变其性质,导致活性位点失去催化活性反应;2)由于Cu本身热稳定性不强,容易发生烧结,极少量的含氯物质都会加速这一过程;3)因为与硫化物发生反应,从而已经发生部分失活的催化剂,再接触到氯化物会导致失活加剧;4)本来起保护作用的ZnO与氯化物反应,生成ZnCl2,它的熔点较低,在运行温度下就可能发生烧结,从而覆盖在活性位点上,堵塞孔道,引发催化剂失活。
氯化物对Cu基催化剂的影响极可能是毁灭性的。催化剂中的金属Cu与极微量的HCl发生反应,就可以大量生成块状CuCl2(熔点为430 ℃),在运行温度下就可能发生烧结,并导致催化剂迅速失活。另外,相似机理生成的ZnCl2(熔点更是低至283 ℃)迁移性极好,使催化剂活性位点被广泛破坏,严重影响制氢过程的稳定运行。ZnO,Al2O3,MgO不仅不能起到保护催化剂的作用,更会因为与HCl反应,生成各自相应的氯化物,覆盖活性组分,反而加快了失活的速度。
另外,还有一些原因可能导致催化剂中毒,如物理磨损,主要是由于在运行过程中,催化剂长期受到高速气流的冲击、磨损,反应活性逐渐下降;物理磨损通常不是失活的主要原因。
为了减少失活对催化剂的影响,一般可采用的手段为:1)减少非反应组分的含量;2)选择合适的制备方法,优化催化剂结构;3)控制反应温度,使催化剂在合适的温度区间运行;4)控制气体流速,减少催化剂的物理磨损;5)添加合适的助剂,保护活性组分等。
5 结语
Cu基催化剂在甲醇重整制氢方面表现出优异的活性,但是如何延长Cu基催化剂的使用寿命依然是要攻克的难题之一,探索如何提高Cu基催化剂的热稳定性,减少催化剂积碳是解决该难题所要面临的重要挑战。
[1] Matsumura Y. Durable Cu composite catalyst for hydrogen production by high temperature methanol steam reforming[J].J Power Sources,2014,272:961-969.
[2] Dodds P E,Staffell I,Hawkes A D,et al. Hydrogen and fuel cell technologies for heating:A review[J].Int J Hydrogen Energy,2015,40(5):2065-2083.
[3] Lu Jichang,Li Xiaofeng,He Sufang,et al. Hydrogen production via methanol steam reforming over Ni-based catalysts:Influences of lanthanum(La) addition and supports[J].Int J Hydrogen Energy,2016,42:3647-3657.
[4] Sharma S,Ghoshal S K. Hydrogen the future transportation fuel:From production to applications[J].Renew Sustain Energy Rev,2015,43:1151-1158.
[5] Brown L F. A comparative study of fuels for on-board hydrogen production for fuel-cell-powered automobiles[J].Int J Hydrogen Energy,2001,26(4):381-397.
[6] Wang Guoqiang,Wang Feng,Li Longjian,et al. Methanol steam reforming on catalyst coating by cold gas dynamic spray[J].Int J Hydrogen Energy,2016,41(4):2391-2398.
[7] Tsodikov M V,Chistyakov A V,Yandieva F A,et al. Conversion of biomass products to energy sources in the presence of nano-catalysts and membrane-catalyst system[J].Catal Ind,2011,3(1):4-10.
[8] Wan Yu,Zhou Zhiming,Cheng Zhenmin. Hydrogen production from steam reforming of methanol over CuO/ZnO/Al2O3catalysts:Catalytic performance and kinetic modeling[J].Chin J Chem Eng,2016,24(9):1186-1194.
[9] Eblagon K M,Concepción P H,Silva H,et al. Ultra selective low temperature steam reforming of methanol over PdZn/ZnO catalysts—Influence of induced support defects on catalysts performance[J].Appl Catal,B,2014,s154/155(1):316-328.
[10] Lwasa N,Masuda S,Ogawa N,et al. Steam reforming of methanol over Pd/ZnO:Effect of the formation of PdZn alloys upon the reaction[J].Appl Catal,A,1995,125(1):145-157.
[11] Amphelett J C,Evans M J,Mann R F,et al. Hydrogen production by the catalytic steam reforming of methanol. Part 2:Kinetics of methanol decomposition using girdler G66B cataltst[J].J Chem Eng,1985,63(4):605-611.
[12] Lattner J R,Harold M P. Autothermal reforming of methanol:Experiments and modeling[J].Catal Today,2007,120(1):78-79.
[13] Eswaramoorthi I,Sundaramurthy V,Dalai A K. Partial oxidation of methanol for hydrogen production over carbon nanotubes supported Cu-Zn catalysts[J].Appl Catal,A,2006,313(1):22-34.
[14] Takahashi K,Takezawa N,Kobayashi H. Novel catalytic performance of SnO2for the steam reforming of methanol[J].Appl Catal,A,1982,2:363-366.
[15] Jiang C J,Trimm D L,Wainwright M S,et al. Kinetic mechanism for the reaction between methanol and water over Cu-ZnOAl2O3catalyst[J].Appl Catal,A,1993,97(2):145-158.
[16] Idem R O,Bakhshi N N. Production of hydrogen from methanol:Experimental studies[J].Ind Eng Chem Res,1994,33(9):2056-2065.
[17] Wang D,Ma L,Jiang C J,et al. The effect of zinc oxide in Raney copper catalysts on methanol synthesis,water gas shift,and methanol steam reforming reaction[J].Stud Surf Sci Catal,1996,101(96):1379-1387.
[18] Takezawa N,Iwasa N. Steam reforming and dehydrogenation of methanol:Difference in the catalytic functions of copper and group Ⅷ metals[J].Catal Today,1997,36(1):45-56.
[19] Tonner S P,Trimm D L,Wainwright M S,et al. Dehydrogenation of methanol to methyl formate over copper catalysts[J].Ind Eng Chem Prod Res Dev,1984,23(3):384-388.
[20] Patel S,Pant K K. Selective production of hydrogen via oxidative steam reforming of methanol using Cu-Zn-Ce-Al oxide catalysts[J].Chem Eng Sci,2007,62(18/20):2079-2084.
[21] Conner W C,Falconner J L. Spillover in heterogeneous catalysts[J].Chem Rev,1995,95(3):759-788.
[22] Frank B,Jentoft F C,Soerijanto H,et al. Steam reforming of methanol over copper-containing catalysts:Influence of support material on microkinetics[J].J Catal,2007,246(1):177-192.
[23] Shishido T,Yamamoto Y,Morioka H,et al. Production of hydrogen from methanol over Cu/ZnO and Cu/ZnO/Al2O3catalysts prepared by homogeneous precipitation:Steam reforming and oxidative steam reforming[J].J Mol Catal A:Chem,2007,268(1/2):185-194.
[24] Idem R O,Bakhshi N N. Kinetic modeling of the production of hydrogen from the methanol-steam reforming process over Mn-promoted coprecipitated Cu-Al catalyst[J].Chem Eng Sci,1996,51(14):3697-3708.
[25] Palo D R,Dagle R A,Holladay J D. Methanol steam reforming for hydrogen production[J].Chem Rev,2007,107(10):3992-4021.
[26] Ramirez D,Beites L F,Blazquez F,et al. Distributes generation system with PEM fuel cell for electrical quality improvement[J].Int J Hydrogen Energy,2008,33(16):4433-4443.
[27] King J M,O’Day. Applying fuel cell experience to sustainable power products[J].J Power Sources,2000,86(1/2):16-22.
[28] Talkhoncheh S K,Haghighi M,Minaei S,et al. Sythesis of CuO/ZnO/Al2O3/ZrO2/CeO2nanocatalysts via homogeneous precipitation and combustion methods used in methanol steam reforming for fuel cell grade hydrogen production[J].RSC Adv,2016,6(62):57199-57209.
[29] Ajamein H,Haghighi M. Influence of ambient gas on microwave-assisted combustion synthesis of CuO-ZnO-Al2O3nanocatalyst used in fuel cell grade hydrogen production via methanol steam reforming[J].Ceram Int,2016,42(16):17978-17989.
[30] Xu Tongkuan,Zou Jie,Tao Weitong,et al. Co-nanocasting synthesis of Cu based composite oxide and its promoted catalytic activity for methanol steam reforming[J].Fuel,2016,183:238-244.
[31] Sajjadi S M,Haghighi M,Rahmani F. Dry reforming of greenhouse gases CH4/CO2over MgO-promoted Ni-Co/Al2O3ZrO2nanocatalyst:Effect of MgO addition via sol-gel method on catalytic properties and hydrogen yield[J].J Sol-Gel Sci Technol,2014,70(1):111-124.
[32] Aghaei E,Haghighi M. Effect of crystallization time on properties and catalytic performance of nanostructured SAPO-34 molecular sieve synthesized at high temperatures for conversion of methanol to light olefins[J].Powder Technol,2015,269:358-370.
[33] Witoon T,Chalorngtham J,Dumrongbunditkul P,et al. CO2hydrogenation to methanol over Cu/ZrO2catalysts:Effects of zirconia phases[J].Chem Eng J,2016,293:327-336.
[34] Chang C C,Wang J W,Chang C T,et al. Effect of ZrO2on stream reforming of methanol over CuO/ZnO/ZrO2/Al2O3catalysts[J].J Chem Eng,2012,192:350-356.
[35] Agrell J,Birgersson H,Boutonet M,et al. Production of hydrogen from methanol over Cu/ZnO catalysts promoted by ZrO2and Al2O3[J].J Catal,2003,219(2):389-403.
[36] Han Yong,Zhu Junfa. Surface studies on the zirconia-based model catalysts[J].Top Catal,2013,44(49):1525-1541.
[37] Huang Y H,Wang S F,Tsai A P,et al. Reduction behaviors and catalytic properties for methanol steam reforming of Cubased spinel compounds CuX2O4(X=Fe,Mn,Al,La)[J].Ceram Int,2014,40(3):4541-4551.
[38] Yang Hungming,Liao Pingheng. Preparation and activity of Cu/ZnO-CNTs nano-catalyst on steam reforming of methanol[J].Appl Catal,A,2007,317(2):226-233.
[39] Basov N L. Membrane catalysis in the dehydrogenation and hydrogen production process[J].Russ Chem Rev,2013,82(4):352-368.
[40] Palo D R,Dagle R A,Holladay J D. Methanol steam reforming for hydrogen production[J].Chem Rev,2007,107(10):3992-4021.
[41] Khzouz M,Wood J,Pollet B,et al. Characterization and activity test of commercial Ni/Al2O3,Cu/ZnO/Al2O3and prepared Ni-Cu/Al2O3catalysts for hydrogen production from methane and methanol fuels[J].Int J Hydrogen Energy,2013,38(3):1664-1675.
[42] Wan Yu,Zhou Zhiming,Cheng Zhenmin. Hydrogen production from steam reforming of methanol over CuO/ZnO/Al2O3catalysts:Catalytic performance and kinetic modeling[J].Chin J Chem Eng,2016,24(9):1186-1194.
[43] Lindstrom B,Pettersson L J. Hydrogen generation by steam reforming of methanol over copper-based catalysts for fuel cell application[J].Int J Hydrog Energy,2001,26(9):923-933.
[44] Agrell J,Boutonnet M,Fierro J L G. Production of hydrogen from methanol over binary Cu/ZnO catalyst. Part Ⅱ. Catalytic activity and reaction pathway[J].Appl Catal,A,2003,253(1):213-223.
[45] Purnama H,Ressler T,Jentoft R E,et al. CO formation/selectivity for steam reforming of methanol with a commercial CuO/ZnO/Al2O3catalyst[J].Appl Catal,A,2004,259(1):83-94.
[46] Remiro A,Valle B,Aguayo A T,et al. Operating conditions for attenuating Ni/La2O3-αAl2O3catalyst deactivation in the steam reforming of bio-oil aqueous fraction[J].Fuel Process Technol,2013,115:222-232.
[47] Valle B,Castano P,Olazar M,et al. Deactivating species in the transformation of crude bio-oil with methanol into hydrocarbons on a HZSM-5 catalyst[J].J Catal,2012,285(1):304-314.
——会偷偷侵蚀你的发动机!

