富硒平菇水溶性蛋白提取及抗氧化活性
,, , ,,,,*
(1.天津科技大学食品工程与生物技术学院,天津 300457; 2.山西农业大学食品科学与工程学院,山西太谷 030801)
硒是人体生命活动的一种必需微量元素,主要参与酶的合成和细胞膜的保护,适量的硒对于抗氧化、抗癌等具有积极的作用[1-3]。硒蛋白是富硒食物中主要的含硒成分之一,具有抗氧化、抗癌等生物活性。对富硒食用菌中硒蛋白的提取、纯化及抗氧化活性已有报道[4-7],田敏爵对富硒猴头硒蛋白不同溶剂提取效果比较后发现,水提取液中蛋白质含量最低[8],张卓研究得出尽管水溶性含硒蛋白在不同溶剂提取液中占的比例较低,但其同浓度下抗氧化活性最高[9]。水作为溶剂提取含硒蛋白能够保持较好的蛋白活性,具有操作简单、避免使用较多化学试剂等优点。目前对富硒平菇中硒蛋白的提取及抗氧化活性鲜见报道,因而本研究采用单因素实验和正交实验优化富硒平菇中水溶性蛋白提取的工艺参数,同时对水溶性蛋白的体外抗氧化活性进行评价,为评价富硒平菇的抗氧化功能特性、开发功能性富硒平菇提供理论依据。
1 材料与方法
1.1 材料与仪器
富硒平菇 硒含量为622.47 mg/g的干样,山西紫团生态农业有限公司;标准牛血清蛋白溶液、考马斯亮蓝G-250、95%乙醇、铁氰化钾、三氯乙酸、三氯化铁、浓盐酸、磷酸氢二钠、磷酸二氢钠、双氧水、硫酸亚铁、三羟基氨基甲烷(Tris)、水杨酸、2,2-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)(ABTS)、过硫酸钾等 均为分析纯。
MP200B电子天平 上海精密科学仪器有限公司;320-S pH计 梅特勒-托利多仪器(上海)有限公司;SHY-2A水浴恒温振荡器 江苏金坛市金城国胜实验仪器厂;SHZ-Ⅲ旋转蒸发仪 上海亚荣生化仪器厂;723可见分光光度计 上海菁华科技仪器有限公司;TDL离心机 上海安亭科学仪器厂。
1.2 实验方法
1.2.1 水溶性蛋白提取 称取一定量的富硒平菇干样,FW135高速粉碎机粉碎后过80目筛,按照一定料液比加入适量的蒸馏水,一定提取温度下在磁力搅拌器中搅拌提取一定时间,抽滤至干,收集滤液,将残渣重新提取2次,合并滤液。根据溶液体积准确称量一定量的硫酸铵,边搅拌边向烧杯中缓慢加入硫酸铵至其饱和度为95%,分离沉淀部分并上3500 Da透析袋透析[5],最后冷冻干燥得水溶性蛋白样品(SeP)。
1.2.2 单因素实验 在对不同提取温度(0、20、30、40、50 ℃)进行单因素实验时,固定料液比1∶30,提取时间4 h;在进行不同料液比(1∶10、1∶20、1∶30、1∶40、1∶50)单因素实验时,将提取温度和提取时间固定在40 ℃、4 h;对不同提取时间(2、3、4、5、6 h)进行单因素实验时,固定料液比为1∶30、提取温度为40 ℃。
1.2.3 正交实验 结合单因素实验得出富硒平菇中水溶性蛋白的最佳提取工艺条件范围,为最大程度接近最佳工艺参数,以水溶性蛋白浓度为实验指标,采用3因素3水平正交实验进一步缩小范围,水平设置见表1。

表1 正交实验方案Table 1 Design of orthogonal experiment
1.2.4 蛋白浓度的测定 分别取0.2 mg/mL的牛血清标准蛋白溶液1、2、3、4、5、6 mL于6个试管中,再加入蒸馏水至10 mL,混匀后移取混合液1 mL与5 mL考马斯亮蓝G-250染液在室温下反应10 min,在595 nm波长下测其吸光值,绘制标准曲线(每个梯度都做3次平行实验)。
分别准确移取硫酸铵沉淀并透析后获得的上清液1 mL于试管中,按照上述方法测定595 nm波长处的OD值,根据标准曲线计算样品溶液中的蛋白质浓度。参考铁梅[10]的方法测定总硒含量。
水溶性蛋白浓度通过样品测定吸光度值结合标准曲线计算获得。

1.2.5 水溶性蛋白抗氧化活性的测定
1.2.5.1 还原力 分别取1 mL不同浓度梯度的水溶性蛋白样品液于5支试管中,加入2.5 mL磷酸盐缓冲液(0.2 mol/L,pH=6.6),再加入2.5 mL 1%铁氰化钾溶液,混合均匀后在50 ℃条件下恒温水浴。静置20 min后加入10%三氯乙酸2.5 mL,处理样液以5000 r/min离心15 min,以1∶1∶0.2取上清液、蒸馏水、0.1%三氯化铁溶液[11]混匀,在700 nm处测吸光值,以蒸馏水为空白。

1.2.5.3 羟自由基清除率 在试管中加入2 mL样液,然后依次加入6 mmol/L的硫酸亚铁溶液和过氧化氢溶液各2 mL,静置10 min后再加入6 mmol/L的水杨酸2 mL混匀,37 ℃水浴30 min后测定其在510 nm处的吸光值,记为A;空白组用2 mL蒸馏水代替样液,测得的吸光值记为B;对照组用2 mL蒸馏水代替水杨酸,测得的吸光值记为C[13-14]。不同浓度梯度的水溶性蛋白溶液对羟自由基清除率按如下公式计算。
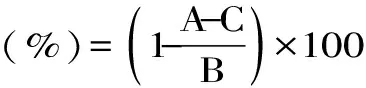
1.2.5.4 ABTS自由基清除率 用2.45 mmol/L过硫酸钾溶液配制7 mmol/L ABTS溶液,室温下避光放置12~16 h,然后用磷酸盐缓冲溶液稀释使其734 nm下吸光度值为0.70±0.02,0.3 mL样品溶液与3.7 mL稀释后的ABTS溶液混合后在20 ℃下避光放置20 min,然后测定其在734 nm的吸光度值[15]。其中样品和ABTS溶液混合后的吸光度值为A,而蒸馏水代替样品后的吸光度值记为B,清除率计算公式如下。

1.3 数据处理
采用软件SAS 9.0(SAS Institute Inc,USA)进行数据分析,Sigma plot 10.0作图。
2 结果与分析
2.1 蛋白标准曲线
由图1可知,标准曲线在蛋白浓度0~0.12 mg/mL范围内具有良好的线性。
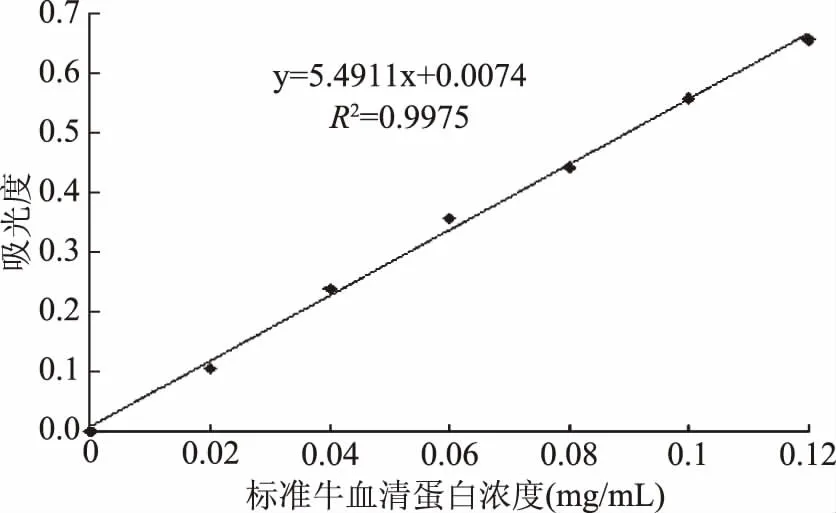
图1 牛血清蛋白标准曲线Fig.1 Standard curve of bovine serum albumin
2.2 提取时间对水溶性蛋白浓度的影响
由图2可知,在其他条件不变的情况下,富硒平菇水溶性蛋白浓度随着提取时间的延长呈现先增加后趋于平缓的趋势,在提取时间低于4 h时水溶性蛋白浓度较低,主要是因为平菇中的蛋白还没有充分溶解出来,提取时间超过4 h后,随着提取时间的延长水溶性蛋白浸出量达到饱和状态,浓度不再增加。因此选择4 h为最佳提取时间。

图2 提取时间对水溶性蛋白浓度的影响Fig.2 Effect of extracted time on the content of water soluble protein
2.3 提取温度对水溶性蛋白浓度的影响
由图3可知,在其它条件不变的情况下,富硒平菇水溶性蛋白浓度随着提取温度的增加呈上升趋势,在30~50 ℃时变化平缓,同时考虑到高温条件下硒蛋白会变性,因而确定40 ℃为最佳的提取温度。
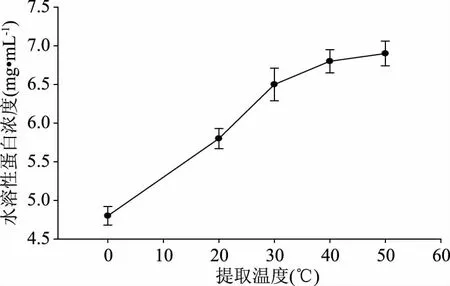
图3 提取温度对水溶性蛋白浓度的影响Fig.3 Effect of extracted temperature on the content of water soluble protein
2.4 料液比对水溶性蛋白浓度的影响
由图4可知,富硒平菇中水溶性蛋白浓度随着料液比的增加呈现上升趋势,当料液比为1∶30时达到最高,之后呈波动性下降,考虑到后续的沉淀、透析、浓缩工艺,选择1∶30作为合适的料液比。
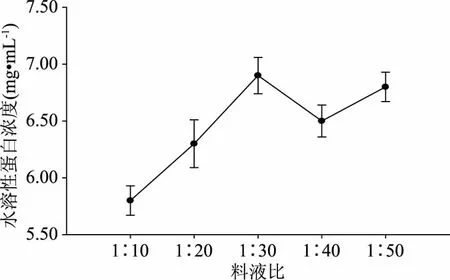
图4 料液比对水溶性蛋白浓度的影响Fig.4 Effect of lipid-to-solid ratio on the content of water soluble protein
2.5 正交实验
结合单因素实验结果,以各因素选取的最佳水平作为正交实验的中心点,为更接近因素水平最佳组合,在正交实验设计中将料液比和提取时间两因素的水平范围进一步缩小,以水溶性蛋白浓度为指标,以料液比、提取时间及提取温度为考察因素,进行正交设计,结果见表2。

表2 正交实验结果Table 2 Results of orthogonal experiment
根据极差R的大小,确定影响因素的主次顺序,可以看出A因素(提取温度)为最重要因素,其次是B因素(料液比),C因素(提取时间)影响最小。通过理论分析得到,富硒平菇水溶性蛋白提取的最佳工艺条件为A1B2C2,9组实验中指标最高组合为A1B2C2,二者一致,因而确定最佳工艺条件为A1B2C2,即提取温度为30 ℃,料液比为1∶30,提取时间4 h。在此条件下进行验证实验,最终提取得到的水溶性蛋白浓度为(8.5±0.29) mg/mL,硒含量为325.7 μg/g。
在富硒平菇中,硒通过与蛋白质、核酸、多糖等结合形成多种含硒化合物。提取硒蛋白的方法有水提、醇提、碱提等多种方法,考虑到提取方法的简便性、实验操作的安全性以及硒蛋白抗氧化研究对提取物纯度的要求,本文选择水提法。尽管水提法得到的硒蛋白含量相对较少,但是水提法引入的杂质几乎为零[4,16]。孙灯艳等[4]对富硒灵芝中的水溶性硒蛋白进行提取,得到的最佳提取条件为pH=9,温度为60 ℃,料液比(w/v)为1∶35,提取时间为9 h,提取次数为3次,在此条件下,蛋白提取的得率为51.56%,蛋白质含量为83.7%,硒含量为533 μg/g。本实验结果中的水溶性蛋白为全部蛋白质的一部分,因而其含量较低,相关研究者也证实水溶性蛋白含量较其它溶剂提取的蛋白含量较低,含硒量较低的原因可能与原料本身富硒的量不同以及提取方法的不同有关。
2.6 水溶性蛋白的抗氧化活性
2.6.1 还原力 在还原力的测定过程中,抗氧化物质提供电子,自由基获取电子失去活性变为稳定的分子。在700 nm下,抗氧化物质的吸光度值越大还原力越强。如图5所示,在0.2~1.0 mg/mL浓度范围内,随着水溶性蛋白浓度的增加,还原力逐渐增大,当水溶性蛋白浓度为1.0 mg/mL时,还原力值达到1.38,但在相同浓度下VC还原力为1.67。水溶性蛋白中的抗氧化活性除与其中的蛋白有关,还与其含有的硒元素有关,因而水溶性蛋白在较低浓度下抗氧化活性相对较高。
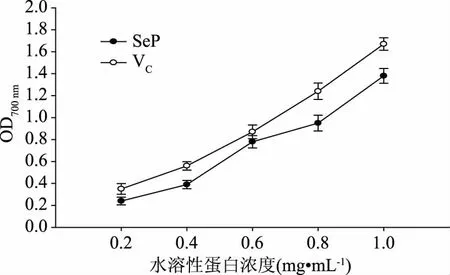
图5 水溶性蛋白的还原力Fig.5 Reduce power of water soluble protein with different contents
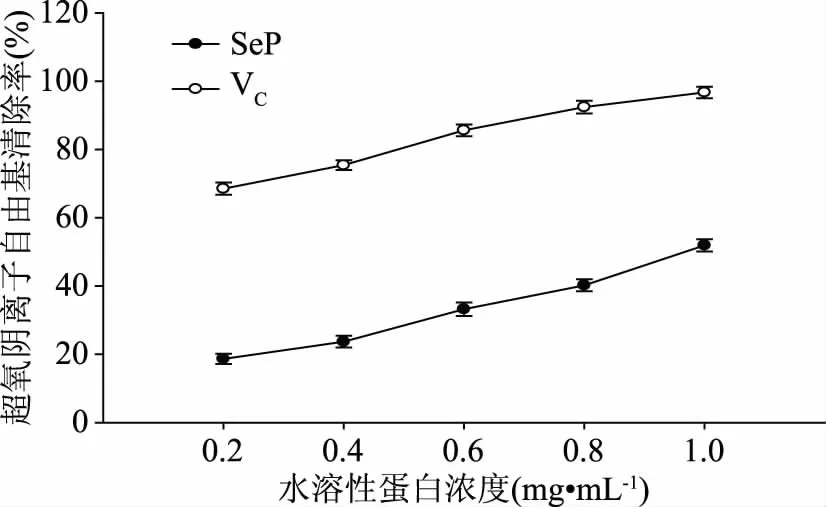
图6 水溶性蛋白对超氧阴离子自由基的清除率Fig.6 Scavenging rate for superoxide anion free radical of water soluble protein with different contents
2.6.3 羟自由基清除率 羟自由基是机体内经常会存在的一类有害自由基,羟自由基会透过细胞膜与蛋白、脂质、多糖以及核酸发生反应进而对机体造成伤害,因而羟自由基的清除对保护机体的健康有重要的意义。在对羟自由基清除过程中,水溶性蛋白通过提供氢原子或自由电子与羟自由基形成稳定的络合化合物,从而降低羟自由基的含量。由图7可知,水溶性蛋白在0.2~1.0 mg/mL浓度范围内对羟自由基的清除率随着浓度的增加而增强,其中在0.2~0.6 mg/mL范围内变化平缓,在0.6~1.0 mg/mL范围内变化较明显,但都明显低于同浓度下VC的清除率。当浓度为1.0 mg/mL时,水溶性蛋白和VC对羟自由基的清除率分别为56.4%和90.2%。杨奇[12]报道富硒金针菇、虫草硒蛋白对羟自由基的清除率随硒蛋白浓度的增加而增加,且清除率显著高于同浓度下空白蛋白和无机亚硒酸钠,说明硒与食用菌蛋白在清除自由基方面有协同作用。

图7 水溶性蛋白对羟自由基的清除率Fig.7 Scavenging rate for hydroxyl free radical of water soluble protein with different contents
2.6.4 ABTS自由基清除率 由图8可知,在所选蛋白浓度范围内,水溶性蛋白对ABTS自由基的清除力随浓度增加而增加,由0.2 mg/mL时的31.7%增加到1 mg/mL的56.2%,但同浓度下清除率都远远低于VC,其变化规律与对羟自由基和超氧阴离子自由基的清除率相似。

图8 水溶性蛋白对ABTS自由基的清除率Fig.8 Scavenging rate for ABTS free radical of water soluble protein with different contents
3 结论
通过单因素实验结合正交实验确定了富硒平菇中水溶性蛋白提取的最佳工艺条件为料液比1∶30,提取时间4 h,提取温度30 ℃,在此条件下提取得到的水溶性蛋白浓度为(8.5±0.29) mg/mL。水溶性蛋白对自由基的清除能力随着浓度的增加而增大,
1.0 mg/mL的水溶性蛋白对超氧阴离子自由基、羟自由基、ABTS阳离子自由基的清除率分别为56.2%、51.9%、56.4%,反映还原力的OD700值达到1.38。
[1]仝宗喜,康世良.硒及硒蛋白生物学作用的研究进展[J]. 动物医学进展,2002,23(6):17-19.
[2]赵镭.灵芝生物富硒及富硒灵芝硒蛋白的分离纯化和抗氧化性研究[D].北京:中国农业大学,2004.
[3]关玉梅.硒与缺硒对机体的影响[J].微量元素与健康研究,2002,19(4):82-83.
[4]孙灯艳,王晓岚,张连富.富硒灵芝中可溶性硒蛋白的提取工艺研究[J].食品工业科技,2008,29(3):219-221.
[5]王莲芳,窦春霞,张连富.富硒食用菌中硒蛋白提取工艺研究[J].食品与发酵工业,2007,33(1):122-126.
[6]杜明,赵镭,陈芳. 富硒灵芝中高抗氧化活力、高硒含量的水溶性硒蛋白的纯化[J]. 食品与发酵工业,2006,32(2):108-112.
[7]杜明,胡小松,赵广华.富硒灵芝中不同粗蛋白的抗氧化活性及其协同作用研究[J].食品工业科技,2006,27(9):11-113.
[8]田敏爵,李好. 富硒猴头菌中含硒蛋白提取工艺研究[J]. 现代农业科技,2010(19):320-322.
[9]张卓,赵萍,郭健.富硒花生中含硒蛋白的提取及其抗氧化性的研究[J].食品工业科技,2012,33(4):323-326.
[10]铁梅,李宝瑞,邢志强,等. 富硒大豆中蛋白提取工艺优化及HPLC-MS联用测定硒代蛋氨酸[J].食品科学,2015,36(8):6-11.
[11]Oyaizu,M. Studies on products of browning reaction:Antioxidative activities of products of browning reaction prepared from glucosamine[J].Japanese Journal of Nutrition,1986,44(6):307-315.
[12]杨奇,郭阳,徐锐. 富硒食用菌硒蛋白清除氧自由基作用研究[J]. 食品研究与开发,2014,35(13):1-4.
[13]Halliwell B. Oxidative damage,lipid peroxidation and antioxidant protection in chloroplasts[J]. Chemistry and Physics of Lipids,1987,44(2-4):327-340.
[14]Li Q,Yu N,Wang Y,et al. Extraction optimization of Bruguiera gymnorrhiza polysaccharides with radical scavenging activities[J].Carbohydrate Polymers,2013,96(1):148-155.
[15]Shi J J,Zhang J G,Sun Y H,et al. Physicochemical properties and antioxidant activities of polysaccharides sequentially extracted from peony seed dreg[J]. International Journal of Biological Macromolecules,2016,91,23-30.
[16]陈季旺,姚惠源,张晓勇,等.米糠可溶性蛋白的提取工艺和特性研究[J]. 中国油脂,2003,28(2):46-50.

