在线固相萃取-液相色谱-串联质谱法测定动物源食品中阿维菌素和伊维菌素的残留量
宓捷波,张 然,王 飞,许 泓,葛宝坤,何 佳
(1.天津出入境检验检疫局,天津300461; 2.天津科技大学,天津300222)
阿维菌素类(AVMs)药物是从链霉菌的发酵菌丝中提取分离的大环内酯类抗生素,其对动物体内外寄生的线虫、节肢动物以及农作物上的害虫、螨类都有极强的驱杀作用,在农牧业生产中应用广泛[1-2]。但由于其毒性与硫磷农药相仿,属高毒化合物,我国、欧盟以及日本均规定了阿维菌素类药物的最高残留限量(MRLs)[3-5]。我国规定阿维菌素在牛、羊组织及奶中的 MRLs为20~100μg·kg-1,伊维菌素在猪、牛、羊组织及奶中的MRLs为10~100μg·kg-1;日本规定在猪、牛、羊中阿维菌素的MRLs为10~100μg·kg-1;欧盟则规定肉及可食用水中阿维菌素的MRLs为10μg·kg-1。
目前,动物源食品中阿维菌素类药物的测定多采用 高效 液 相 色 谱-串 联 质 谱 法[6-8](HPLC-MS/MS),与 液 相 色 谱 法 (HPLC)[9-11]、酶 联 免 疫 法(ELISA)[12-13]相比,HPLC-MS/MS无需衍生化反应,灵敏度高、定性定量准确。但HPLC-MS/MS的前处理技术通常为离线的固相萃取(offline-SPE),操作繁琐、耗时。近年来,在线前处理技术以其快速、高通量的特点在生物、医药等领域得到了广泛的应用[14-15]。然而,由于动物源食品基质较为复杂,禁限用药物的检出限较低,所以在线前处理技术在动物源食品检测领域的应用相对较少。本工作利用双通道在线固相萃取系统,通过固相萃取柱、上样、洗脱等条件的优化,建立测定动物源食品中阿维菌素和伊维菌素残留量的在线净化-液相色谱-串联质谱法。
1 试验部分
1.1 仪器与试剂
Agilent 1200-API4000型液相色谱-三重四极杆质谱仪;Symbiosis Pico双通道在线SPE液相系统;96 孔-HySphere C18HD 萃 取 柱 (2mm ×10mm,7μm)及方法开发萃取柱;ZORBAX SB-C18色谱柱(2.1mm×15mm,1.8μm);Ultra-turrax T25型高速均质器;Avati J-26XPI型高速离心机。
混合标准储备溶液:分别称取阿维菌素和伊维菌素标准品10mg,用甲醇溶解并定容至10mL,得1.000g·L-1标准储备溶液,于4℃避光存放。然后移取阿维菌素和伊维菌素标准储备溶液各10μL于100mL容量瓶中,用甲醇定容,配成的混合标准储备溶液,于4℃避光保存。
乙腈、甲醇、甲酸均为色谱纯;乙酸铵、三乙胺和氨水均为分析纯;试验用水为去离子水。
1.2 仪器工作条件
1)色谱条件 乙腈为流动相A,含0.2%(体积分数,下同)甲酸的10mmol·L-1乙酸铵溶液为流动相B,流量400μL·min-1,柱温为25℃。梯度洗脱程序:在线SPE活化、上样和洗涤阶段,A保持35%;0~2min,洗脱液转移阶段,A保持35%;2~4min,A由35%变化为95%;4~6.5min,A 保持35%。整个色谱分离时间为4.5min。
2)质谱条件 电喷雾正离子源(ESI+)模式,气帘气压力为207kPa,辅助气1的压力为345kPa,辅助气2的压力为379kPa,碰撞气压力为69kPa,喷雾电压为4 500V,离子源温度为550℃。多反应监测模式扫描。
1.3 试验方法
称取试样2.50g于50mL离心管中,加入乙腈5mL,均质30s,再加入0.15%(体积分数)三乙胺溶液5mL,以5 000r·min-1转速离心5min,取上清液1mL,过0.22μm微孔滤膜,待分析。
在双通道在线固相萃取系统上进行固相萃取小柱的相应处理,其中活化、上样和洗涤步骤在一个通道进行,弃去流出液,而洗脱转移步骤在另一通道进行,液体直接转移至色谱柱。
对HySphere C18HD萃取柱采用高压输送泵进行操作,具体步骤为:以甲醇1mL和2%(体积分数,下同)氨水的甲醇溶液1mL依次进行活化处理,流量5 000μL·min-1,进样量100μL;再依次以2%氨水的甲醇溶液-2%氨水(2+8)混合液1mL、2%氨水的甲醇溶液-2%氨水(5+5)混合液1mL和水1mL进行洗涤,流量5 000μL·min-1;最后以甲酸-甲醇(1+99)混合液400μL进行洗脱转移,流量200μL·min-1,液体全部进入液相色谱柱,全程共需要3min。
2 结果与讨论
2.1 质谱条件的优化
阿维菌素类药物在ESI+模式下,往往以[M+Na]+和[M+NH4]+加合准分子离子峰形式出现,见图1。
图1中m/z895.5,897.5分别为阿维菌素和伊维菌素的[M+Na]+离子,而m/z 890.5,892.5则为[M+NH4]+离子。由图1可以看出,以[M+Na]+形式存在的离子更占优势。但是,由于[M+Na]+离子结构稳定,不易进一步裂解[7,16],且裂解后产物离子的丰度低,信号不稳定。
图2为1mg·L-1阿维菌素标准溶液分别以[M+Na]+和[M+NH4]+形式进一步裂解的质谱图,图2中显示[M+NH4]+形式的前体离子和产物离子丰度高,信号稳定,而[M+Na]+形式的相应离子丰度及信号均较差。因此,试验中采用[M+NH4]+作为检测的前体离子,具体的质谱参数优化结果见表1,其中“*”为定量离子对。
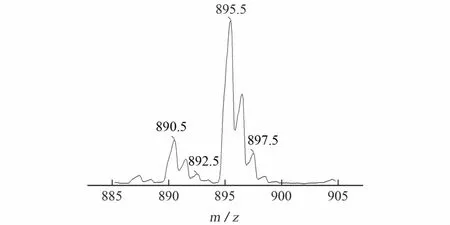
图1 阿维菌素和伊维菌素的[M+Na]+和[M+NH4]+加合离子峰质谱图Fig.1 Mass spectrum of avermectin and ivermectin in the forms of[M+Na]+and[M+NH4]+
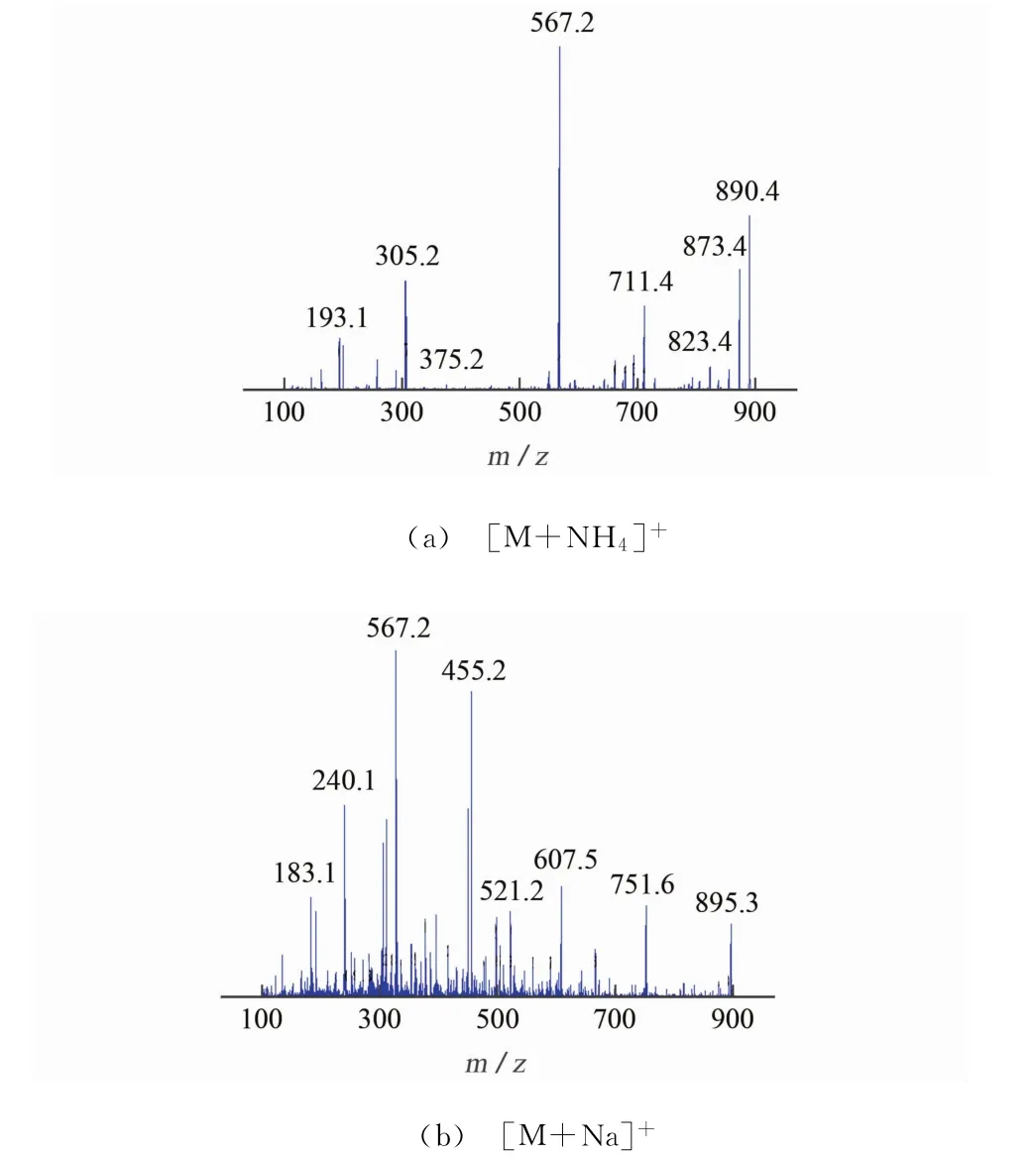
图2 阿维菌素的[M+NH4]+和[M+Na]+加合离子的二级质谱图Fig.2 Secondary mass spectra of avermectin and in the forms of[M+NH4]+and[M+Na]+
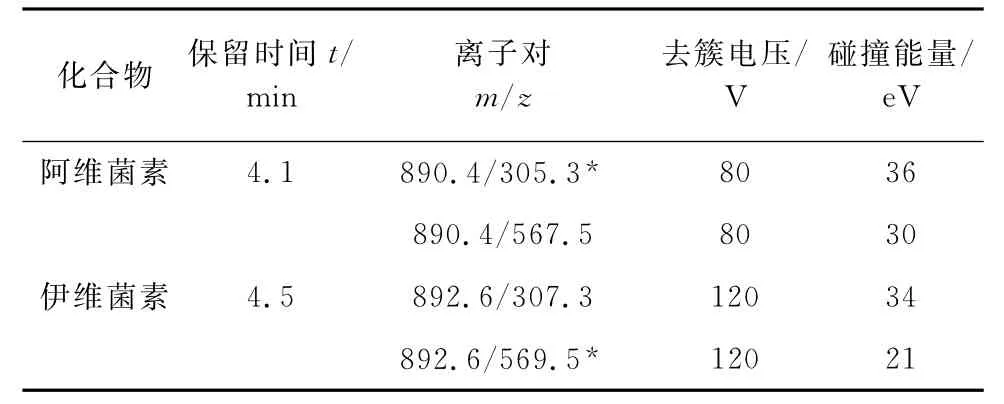
表1 阿维菌素和伊维菌素的质谱参数Tab.1 MS parameters of avermectin and ivermectin
2.2 在线SPE柱的选择
阿维菌素类药物相对分子质量大,含糖链,极性相对较弱,文献[5,8,10-11]中多采用 C8、C18、氨基柱作为离线SPE柱进行净化。为了考察不同SPE柱对动物源食品中阿维菌素类药物净化效果的影响,试验对 C8、Resin SH、Resin GP和 C18HD 等4种在线SPE柱进行比较,结果见图3。

图3 不同在线SPE柱的萃取效果比较Fig.3 Comparison of the extraction efficiency of different on-line SPE columns
由图3可知,C8、Resin SH 和 Resin GP对目标物的保留较差,C18HD柱的保留和净化效果最好,所以试验选择C18HD柱作为在线SPE柱。
2.3 在线洗脱条件的选择
与离线SPE相比,在线SPE需要将高比例有机相的洗脱液直接引入分析柱,如果洗脱液的流量和用量控制不当,会导致目标物的扩散和流失。试验在流量固定200μL·min-1的情况下,对甲酸-甲醇(1+99)洗脱液的用量进行了优化,结果见图4。

图4 洗脱液用量对阿维菌素和伊维菌素测定的影响Fig.4 Effect of eluent volume on the determination of avermectin and ivermectin
由图4可知:洗脱液用量为200μL时,目标物均未检出,表明洗脱强度不够;当洗脱液用量为400μL时,阿维菌素和伊维菌素的峰面积最大;但随着洗脱液体积的增加,目标物的峰面积反而减小,这可能由于洗脱时间过长,目标物逐渐在分析柱上扩散流失。固定400μL洗脱液用量,试验考察了100,150,200,300μL·min-1流量对目标物分离的影响。结果表明:当流量为200μL·min-1时,目标物峰形最佳。所以,试验选择流量为200μL·min-1,洗脱液用量为400μL。
对于洗脱后流动相的选择,试验比较了甲醇和乙腈对阿维菌素的分离洗脱情况,结果发现:当采用乙腈作为流动相进行梯度洗脱时,阿维菌素的响应值比甲醇作为流动相时更高。因此,试验选择乙腈作为流动相。
2.4 工作曲线与测定下限
为了消除基质效应,以空白猪肉基质提取液稀释混合标准储备溶液,得到0,0.50,1.0,2.0,5.0,10μg·L-1的工作溶液系列,进行在线固相萃取和液相色谱-串联质谱分析,以化合物的峰面积比(y)为纵坐标,其质量浓度(x)为横坐标绘制工作曲线。阿维菌素和伊维菌素的质量浓度在10μg·L-1内呈线性,线性回归方程分别为y=1 270 x+728和y=396 x+266,相关系数均大于0.99。
通过在空白样品中进行加标测定,根据提取离子色谱峰的信噪比(S/N)大于10确定方法的测定下限,阿维菌素和伊维菌素的测定下限均为5.0μg·kg-1,可以满足目前国内外对阿维菌素类药物残留限量的要求。
2.5 精密度与回收试验
依据欧盟指令2002/657/EC关于方法确证回收率的要求,分别在空白猪肉、牛肉和香肠样品中添加5.0,10,15μg·kg-1等3个浓度水平的阿维菌素和伊维菌素,按试验方法进行测定,精密度与回收试验结果见表2。
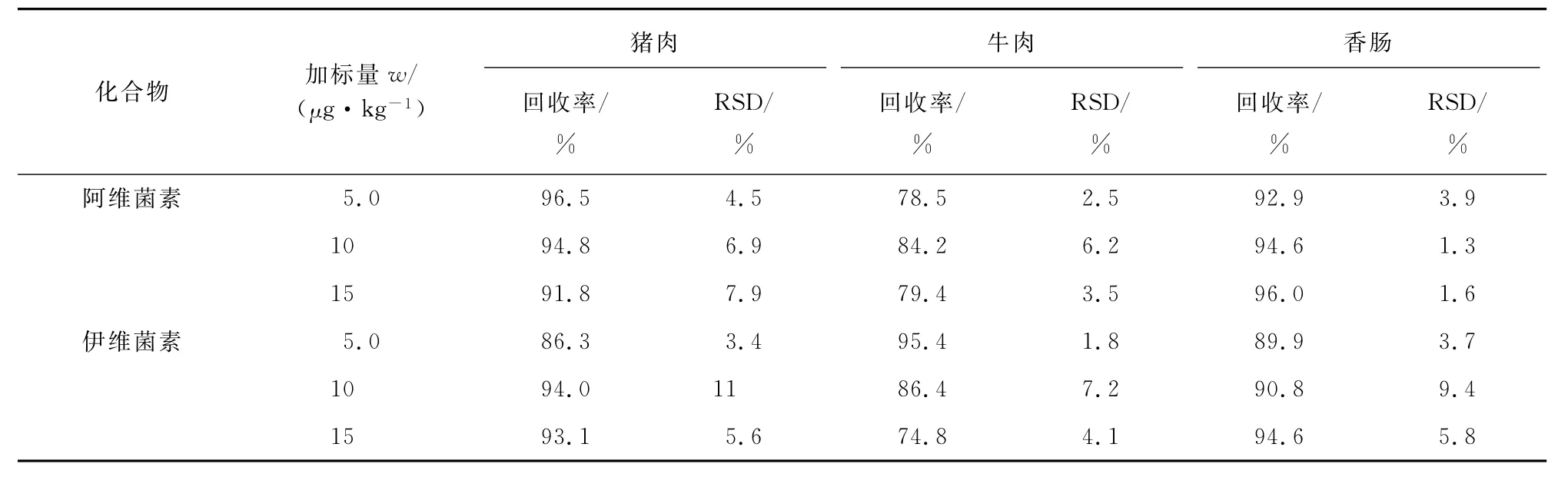
表2 精密度与回收试验结果(n=6)Tab.2 Results of tests for precision and recovery(n=6)
由表2可知:加标回收率在74.8%~96.5%之间,测定值的相对标准偏差(RSD)不大于11%,可以满足分析样品需要。
图5为猪肉基质中添加5.0μg·kg-1阿维菌素类药物的提取离子色谱图,与空白基质图比较,目标物出峰明显,不存在干扰。
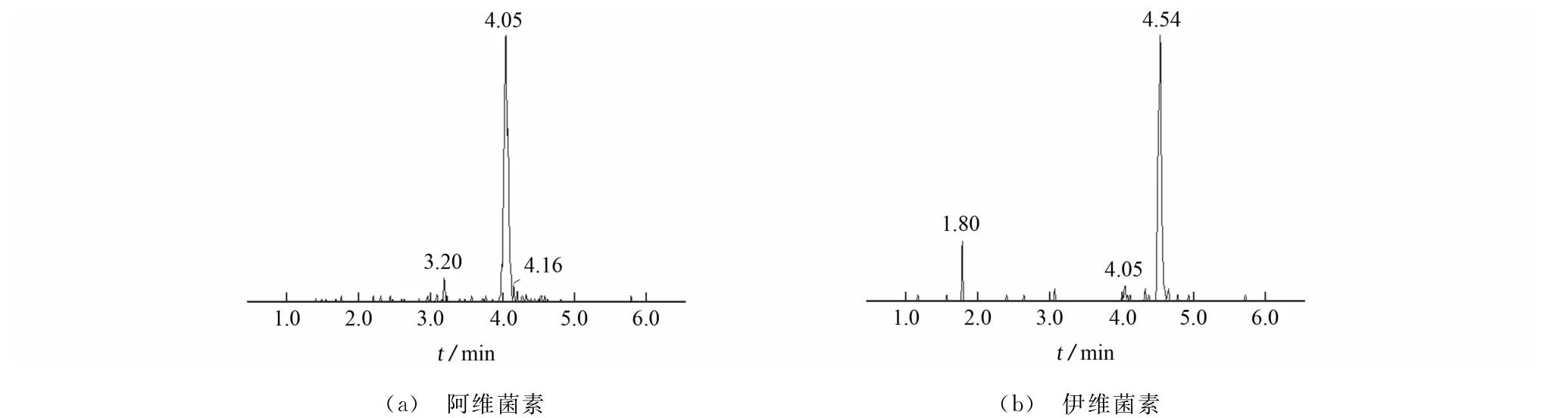
图5 猪肉基质中添加5.0μg·kg-1阿维菌素和伊维菌素的提取离子色谱图Fig.5 Extracted ion chromatograms of avermectin and ivermectin in pork spiked with 5.0μg·kg-1
2.6 在线净化与离线净化方法的比较
在空白猪肉样品中添加10μg·kg-1的阿维菌素和伊维菌素,分别采用离线和在线方法进行回收率测定,其中离线方法的提取液过C18SPE柱,经上样、洗脱、氮吹、复溶等步骤后上机测定,比较结果见表3。

表3 离线与在线方法的比较Tab.3 Comparison of offline and online methods
由表3可知,离线和在线试验的回收率相近,均符合测定要求,但在样品前处理时间上在线方法明显比离线方法短。
2.7 实际样品分析
按试验方法对天津口岸进出口的21批次猪肉和5批次香肠中的阿维菌素类药物的残留进行测定,所测样品中均未检出阿维菌素类药物残留。
本工作利用双通道在线固相萃取系统,通过SPE小柱和洗脱条件的优化,建立了测定动物源食品中阿维菌素类药物残留的在线固相萃取-液相色谱-串联质谱法。与传统的离线固相萃取方法相比,本方法将固相萃取、复溶转移和分离测定等多个步骤简化为一个环节,整个固相萃取-转移-分离-测定过程仅需要7.5min,有效地提高了效率,降低了浓缩复溶等环节人为污染的风险。本方法适用于猪肉、牛肉和香肠中阿维菌素和伊维菌素的检测,其测定下限均为5.0μg·kg-1,能够满足国内外对动物源食品中阿维菌素和伊维菌素残留的测定要求。
[1] MCKELLAR Q A,BENCHAOUI H A.Avermectins and milbermycins[J].J Vet Pharmacol Ther,1996,19(5):331-351.
[2] SHOOP W L,MORZIK H,FISHER M H.Structure and activity of avermectins and milbemycins in animal health[J].Vet Parasitol,1995,59(2):139-156.
[3] 中华人民共和国农业部公告第235号 动物性食品中兽药残留最高残留限量[S].2002.
[4] ROUDAUT B.Multiresidue method for the determination of avermentin and moxidectin residues in the liver using HPLC with fluorescence detection[J].Analyst,1998,123(12):2541-2544.
[5] ALI M S,SUN T,MCLEROY G E,et al.Simultaneous detection of eprinomectin,moxidectin doramectin and ivermectin in beef liver by LC with folurorescence detection[J].J AOAC Int,2000,83(1):31-38.
[6] HOWELLS L,SAUER M J.Multiresidue analysis of avemectins and moxidectin by ion trap LC-MS[J].Analyst,2001,126(2):155-160.
[7] 宫小明,董静,孙军,等.动物源食品中阿维菌素类药物残留的QuEChERS-液质联用法测定[J].分析测试学报,2010,29(9):933-937.
[8] 赵东豪,贺利民,聂建荣,等.猪肉组织中阿维菌素类药物残留的高效液相色谱-串联质谱法测定[J].分析测试学报,2008,27(8):862-865.
[9] 尹敬敬,陆宏达.反相高效液相色谱法测定虾肌肉组织中阿维菌素残留量[J].理化检验-化学分册,2011,47(3):318-320.
[10] NAGATA T,MIYAMOTO F,HASEGAWA Y,et al.Simultaneous determination of residual antiparasitic lactones in bovine muscle and liver by liquid chromatography with fluorescence detection[J].J AOAC Int,2003,86(3):490-493.
[11] 贾方,杨霖,孙雷,等.柱前衍生-高效液相色谱法测定牛筋中阿维菌素和伊维菌素[J].理化检验-化学分册,2011,47(11):1302-1304.
[12] SHI W,HE J,JIANG H,et al.Determination of multiresidue of avermectins in bovine liver by an indirect competitive ELISA[J].J Agric Food Chem,2006,54(17):6143-6146.
[13] KONDO M,YAMASHITA H,UCHIGASHIMA M,et al.Development of an enzyme-linked immunosorbent assay for residue analysis of the insecticide emamectin benzoate in agricultural products[J].J Agric Food Chem,2009,57(2):359-364.
[14] PASTORIS A,CERUTTI L,SACCO R,et al.Automated analysis of urinary catecholamines by high performance liquid chromatography and on-line sample pretreatment[J].J Chromatogr B,1995,664(2):287-293.
[15] SCHELLEN A,OOMS B,VAN DE LAGEMATT D,et al.Generic solid phase extraction liquid chromatography tandem mass spectrometry method for fast determination of drugs in biological fluids[J].J Chromatogr B,2003,788(2):251-259.
[16] 赵肖华,曹赵云,牟仁祥,等.液相色谱-串联质谱法测定蔬菜、水果中5种阿维菌素类药物残留量[J].分析测试学报,2012,31(10):1266-1271.

