硫酸酸化-气相色谱-质谱法测定植物提取物中的4种多环芳烃
, , ,
(陕西嘉禾生物科技股份有限公司, 西安 710086)
多环芳烃(PAHs)是一类由两个或两个以上苯环组成的碳氢化合物,其化学结构稳定,难以降解,是一类具有致癌、致畸和致基因突变的持久性有机污染物。环境中的多环芳烃主要来源于煤、石油和木材等含碳有机物的不完全燃烧,其具有半挥发性,能够随大气污染物迁移,容易沉降在植物表面,并在后期加工过程中进入提取物中。目前已发现200多种PAHs,其中苯并[a]蒽、屈、苯并[b]荧蒽和苯并[a]芘是毒性最强的4种[1-5]。2015年欧盟规定,从2016年4月1日起,将对所有出口欧盟的食品、药品和膳食补充剂进行这4种多环芳烃的检测,并规定这4种多环芳烃的总量不能超过50 μg·kg-1,苯并[a]芘单项不能超过10 μg·kg-1[6]。我国国家标准限定粮食和肉制品中苯并[a]芘的残留量应在5 μg·kg-1以下,植物油中苯并[a]芘的限量为10 μg·kg-1[7-8]。
目前,对于多环芳烃的检测,样品前处理的方法主要有皂化法、固相萃取小柱净化法、凝胶色谱法和酶联免疫吸附法等[9-23]。这些样品前处理方法周期长、成本高、操作复杂;且采用气相色谱-质谱法检测时,由于多环芳烃类化合物不易电离,导致响应值非常低,无法满足检测要求。这些问题严重影响了多环芳烃的检测,为产品的质量安全和出口带来了巨大的隐患。本工作建立硫酸酸化-气相色谱-质谱法测定植物提取物中4种多环芳烃,由于硫酸酸化的作用,使得4种多环芳烃在质谱检测时,电离效率明显增强,提高了质谱对多环芳烃检测的灵敏度。
1 试验部分
1.1 仪器与试剂
Agilent 7890A/5975C型气相色谱-质谱仪;KQ-100B型超声波清洗器;Organomation型氮吹仪;Millipore型超纯水机;0.2 μm微孔滤膜;10~1 000 μL移液枪。
标准储备溶液:200 mg·L-1,称取4种PAHs标准品各10 mg,置于50 mL棕色容量瓶中,用环己烷溶解并定容。使用时用环己烷稀释至所需质量浓度。
苯并[a]蒽、屈、苯并[b]荧蒽、苯并[a]芘标准品纯度不小于97%。
环己烷为色谱纯,硫酸为分析纯,试验用水为超纯水。
1.2 仪器工作条件
1) 色谱条件 HP-5MS色谱柱(30 m×0.25 mm,0.25 μm);载气为氦气(纯度不小于99.999%),流量1.5 mL·min-1;传输线温度280 ℃;进样口温度280 ℃,进样量2.0 μL,进样方式为不分流进样。升温程序:初始温度60 ℃,保持3 min;以25 ℃·min-1速率升温至110 ℃;再以20 ℃·min-1速率升温至200 ℃;以3 ℃·min-1速率升温至230℃;以5 ℃·min-1速率升温至250 ℃;以4 ℃·min-1速率升温至320 ℃,保持5 min。
2) 质谱条件 电子轰击(EI)离子源,电离能70 eV;离子源温度230 ℃;选择离子监测(SIM)模式。
4种PAHs的保留时间及质谱参数见表1。
1.3 试验方法
称取植物提取物5.000 0 g于离心管中,加环己烷25 mL超声提取两次,合并提取液,减压浓缩至干,残渣加环己烷5 mL溶解,加硫酸(80+20)溶液0.5 mL,充分振摇酸化除杂,静置分层后,将上层液用0.2 μm微孔滤膜过滤后,在仪器工作条件下进行测定。

表1 4种PAHs的保留时间及质谱参数Tab. 1 Retention times and MS parameters of 4 PAHs
2 结果与讨论
2.1 硫酸浓度的选择
称取相同的3份阴性植物提取物样品各5.000 0 g,加入多环芳烃标准储备溶液,使4种PAHs的加标量约为10 μg·kg-1,搅拌均匀,再加入环己烷25 mL,超声提取后,将提取液浓缩定容至5 mL,再分别加入硫酸(98+2)溶液、硫酸(80+20)溶液、硫酸(50+50)溶液各0.5 mL进行酸化除杂处理,按仪器工作条件进行测定,并计算多环芳烃的回收率,结果见表2。

表2 采用不同浓度硫酸酸化处理时4种PAHs的回收率Tab. 2 Recovery of 4 PAHs when different concentration of sulfuric acid was used for acidifaction
由表2可知,采用硫酸(80+20)溶液酸化所得回收率最高。因此,试验选择硫酸(80+20)溶液进行样品酸化除杂。
2.2 色谱行为
选取硫酸(80+20)溶液对混合标准溶液进行酸化,分别得到酸化前后的色谱图,见图1。

(a) 酸化前

(b) 酸化后 1-苯并蒽;2-屈;3-苯并[b]荧蒽;4-苯并[a]芘图1 硫酸酸化前后混合标准溶液的色谱图Fig. 1 Chromatograms of the mixed standard solution with and without acidification with sulfuric acid
由图1可知,酸化以后各化合物的响应值明显增大。
2.3 工作曲线与检出限
配制质量浓度分别为0,8.00,16.0,32.0,64.0,80.0 μg·L-1的混合标准溶液系列,各取5 mL于刻度试管中,加入硫酸(80+20)溶液0.5 mL,充分振摇酸化,静置分层后,将上层液用微孔滤膜过滤后,在仪器工作条件下进行测定。用所得的峰面积为纵坐标,相应的质量浓度为横坐标绘制工作曲线。以能检测到3倍于噪声峰高的质量分数作为检出限。4种多环芳烃的线性回归方程、相关系数和检出限见表3。

表3 4种多环芳烃的线性参数和检出限Tab. 3 Linearity parameters and detection limits of the 4 PAHs
由表3可知:4种多环芳烃的线性关系良好,且检出限能满足限量要求的检测。
2.4 精密度与回收试验
根据样品基质的复杂程度,选出具有代表性的4种植物提取物分别在3个添加水平进行加标回收试验,每个添加水平做6次平行试验,结果见表4。
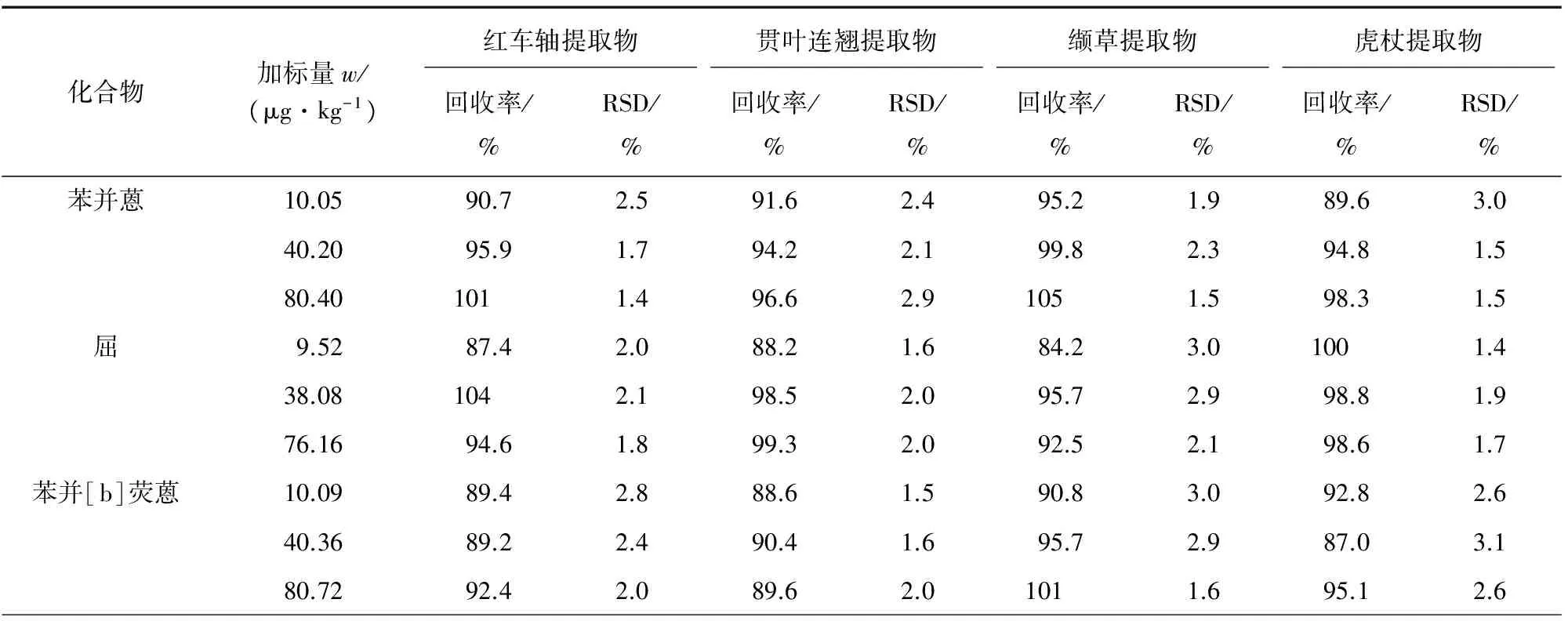
表4 精密度和回收试验结果(n=6)Tab. 4 Results of tests for precision and recovery(n=6)

表4(续)
由表4可知:4种提取物中4种PAHs的加标回收率在84.2%~105%之间,相对标准偏差在1.4%~3.9%之间。
2.5 样品分析
用所建的方法对葛根、越橘、银杏等10种植物提取物样品进行分析,结果见表5。

表5 10种植物提取物样品中4种PAHs的测定结果Tab. 5 Determination results of 4 PAHs in 10 plant extract samples μg·kg-1
由表5可知:10种植物提取物样品中均检出4种PAHs,且4种PAHs的总质量比在19.59~142.69 μg·kg-1内,苯并[a]芘的质量比在2.03~17.58 μg·kg-1内。
本方法将样品用环己烷提取后,采用硫酸(80+20)溶液对样品进行酸化处理,然后进行气相色谱-质谱法测定,其操作简单,所用时间短,样品除杂效果明显,同时增强了4种PAHs的电离效率,提高了其在质谱上的灵敏度。该方法针对植物提取物的复杂基质的处理特地开发,灵敏度高,可以很好地满足植物提取物中4种PAHs的检测。
[1] US Environmental Protection Agency (USEPA). Guidelines for carcinogen risk assessment: EPA/630/P03/00IF[R]. Washington DC: USEPA, 2005.
[2] NAKATA H, UEHARA K, GOTO Y, et al. Polycyclic aromatic hydrocarbons in oysters and sediments from the Yatsushiro Sea, Japan: Comparison of potential risks among PAHs, dioxins and dioxin-like compounds in benthic organisms[J]. Ecotoxicology and Environmental Safety, 2014,99(2):61-68.
[3] KRÜGER O, KALBE U, MEIßNER K, et al. Sorption effects interfering with the analysis of polycyclic aromatic hydrocarbons (PAH) in aqueous samples[J]. Talanta, 2014,122(5):151-156.
[4] 田玉霞,孟橘.食用油中多环芳烃的研究进展[J].中国油脂, 2012,37(3):69-73.
[5] 王欣,周智慧,赵晓联.苯并[a]芘危害性及其检测技术[J].粮食与油脂, 2011,3(3):48-49.
[6] COMMISSION REGULATION (EU) 2015/1933 of 27 October 2015 Amending Regulation (EC) No 1881/2006 as regards maximum levels for polycyclic aromatic hydrocarbons in cocoa fibre, banana chips, food supplements, dried herbs and dried spices[S].
[7] GB 2716-2005 食用植物油卫生标准[S].
[8] GB 2762-2012 食品安全国家标准:食品中污染物限量[S].
[9] 汤富彬,莫润宏,钟冬莲,等.皂化提取-高效液相色谱法测定油茶籽油中苯并[a]芘残留[J].油脂安全, 2012,37(2):62-64.
[10] 倪进治,王军,李小燕,等.超高效液相色谱荧光检测器测定土壤中多环芳烃[J].分析试验室, 2010,29(5):25-28.
[11] 董桂贤,王朝霞,周晓鸽,等.超高效液相色谱法同时测定植物油中15种多环芳烃[J].卫生研究, 2014,43(4):620-623.
[12] 李念念,周光宏,徐幸莲,等.高效液相色谱-荧光法测定腊肉中的苯并芘残留[J].食品科技, 2013,33(1):319-323.
[13] 胡奇杰,沈黎炜,戚民,等.高效液相色谱法测定肉制品中的苯并芘[J].食品研究与开发, 2016,31(6):146-149.
[14] GB/T 24893-2010/ISO 15753:2006 动植物油脂多环芳烃的测定[S].
[15] 刘艳琴,王浩,杨红梅.凝胶渗透色谱-高效液相色谱法测定植物油中的苯并芘[J].食品安全与检测, 2013,38(10):327-329.
[16] 马君刚,张煌涛,于红,等.GPC-HPLC-FLD法测定动植物油脂中的苯并[a]芘[J].食品科学, 2012,33(10):278-281.
[17] 宫哲,王德慧,赵德智,等.苯并芘的分离与检测研究进展[J].化学通报, 2015,78(9):786-791.
[18] 王峰,张志杰,林慧,等.高效液相色谱-二极管阵列检测器-荧光检测器法测定植物油中的18种多环芳烃[J].食品科学, 2014,35(6):142-145.
[19] 徐文君,王峰,朱晓军,等.气质联用法测定食用植物油中的多环芳烃[J].江苏农业科学, 2014,42(11):339-341.
[20] 王晓东,王歆睿,李红,等.气相色谱-串联质谱法测定食用植物油中痕量多环芳烃[J].现代科学仪器, 2013,4(2):137-140.
[21] 徐小民,蔡增轩,任一平,等.食用植物油中苯并[a]芘的在线凝胶色谱-气质联用测定[J].中国卫生检验杂志, 2012,22(7):1479-1483.
[22] 马玲,张旭龙,刘银,等.凝胶色谱净化-气相色谱-质谱法同时测定烧烤肉制品中19种多环芳烃[J].理化检验-化学分册, 2014,50(1):72-75.
[23] 房丽萍,邱赫男,王伟,等.土壤和沉积物中多环芳烃分析技术研究进展[J].理化检验-化学分册, 2015,51(9):1339-1346.

