HgS沉淀平衡体系中Hg2+的测定
, , , * (. 新疆维吾尔自治区矿产实验研究所, 乌鲁木齐 830000; . 新疆师范大学 化学化工学院污染监测与控制重点实验室, 乌鲁木齐 8300)
硫化物沉淀法除汞基于S2-与Hg2+形成难溶HgS,通过混凝沉降使HgS与水分离达到除汞的目的,其工艺主要由反应和混凝沉降工段组成;出水剩余总汞包括Hg2+、胶态及悬浮态HgS;出水剩余Hg2+含量可反映反应工段除汞效果,胶态及悬浮态HgS含量可反映混凝沉降工段除汞效果,而总汞可反映工艺总体除汞效果。准确测定HgS沉淀体系中Hg2+,可为沉淀反应热力学及动力学研究提供可靠数据,为评价反应工段处理效果及工艺参数提供可靠依据。实际上,相对胶态及悬浮态HgS,Hg2+在环境中更易迁移转化[1-2],对环境影响更大,对其进行准确测定意义更大。目前,废水中汞的测定的标准[3-5]中缺少Hg2+测定方法,仅从达标排放考虑,制定了总汞、溶解态汞的测定方法。
微量、痕量Hg2+的测定主要以光谱法为主,如双硫腙分光光度法、原子荧光光谱法、冷原子吸收光谱法都是国家标准中测定消解液中Hg2+的标准方法,实为水样中总汞。选择性测定水样中Hg2+的方法主要分为直接测定和间接测定。直接测定如郑直[6]以离子液体萃取自来水、地下水中的Hg2+,然后采用分光光度法测定,方法检出限低,线性范围较宽,准确度较高,但对水样水质要求较高,试样中微小颗粒物会对测定产生较大影响。喻秀[7]制备了一种新型离子选择电极,在酸性条件下用于Hg2+的测定,但该方法检出限高于1 mg·L-1,且电极使用寿命短。间接测定法如吕诗言等[8]利用Hg2+对CdTe:Mn/ZnS量子点的磷光猝灭作用测定Hg2+,方法检出限为0.86 mg·L-1。贺胜男等[9]利用Hg2+置换组装在光波导表面的对巯基苯胺-金纳米颗粒探针中的金,致使金-硫键断裂,部分对巯基苯胺随金纳米粒子脱离光波导表面,光波导分光光谱发生变化,以此来对Hg2+进行测定,具有较高的选择性。何全[10]利用M-S键的断裂与Hg-S键形成过程中,散射光增强的强度与Hg2+浓度呈线性关系,采用共振光散射法检测获得较为满意的结果。张瑞华[11]利用Hg2+作为罗丹明6G的荧光猝灭剂,在Hg2+质量浓度8~10 μg·L-1内获得了较好的测定准确度,值得注意的是罗丹明6G荧光强度对酸度极为敏感。其他方法还有膜传感器法、酶传感器法[12]等。
* 通信联系人。chenpingxj@sina.com
对HgS沉淀体系,消解使样品中胶态及悬浮态HgS转化为Hg2+,测定样品中Hg2+时,样品不应消解。本工作利用实验室Hg2+配水进行化学沉淀处理,以沉淀平衡体系为对象,以冷原子吸收微分测汞仪为测试仪器,通过对比不同的预处理方法对汞测定结果的影响,获得准确测定HgS体系样品中Hg2+的方法,同时针对体系中Cl-浓度较高的特点,开展Cl-影响试验。
1 试验部分
1.1 仪器与试剂
JLBG-220型冷原子吸收微分测汞仪;雷磁PHS-3C型pH计;BDC-2000型电动搅拌机;HP-01型无油真空泵;ETHOS A型微波消解仪;AL104型电子天平;Zetasizer Nano-ZS90型粒度分析仪。
Hg2+标准储备溶液:1 000 mg·L-1。
盐酸、硝酸、氯化亚锡、氯化钾为优级纯,氯化汞、氢氧化钠、硫化钠为分析纯,试验用水为去离子水。
试验器皿为硅玻璃或塑料制品,使用前用硝酸(1+1)溶液浸泡过夜后,用水清洗干净,于95 ℃干燥2 h。
1.2 仪器工作条件
冷原子吸收微分测汞仪波长253.7 nm,恒定进气流量。
1.3 试验方法
在3 L烧杯中加入pH为8.5、质量浓度为3.50 mg·L-1的Hg2+溶液2 L,保持搅拌器转速300 r·min-1,加入质量分数为4.2%的Na2S溶液20 mL,搅拌反应13 min后,体系达到平衡。采用Zetasizer Nano-ZS90型粒度分析仪测定原液粒度,平衡体系理论总汞质量浓度为3.46 mg·L-1。
从体系中分取18份50 mL原液,分为6组,每组3个平行。预处理方式分别为:不过滤-不消解、0.45 μm膜过滤-不消解、0.22 μm膜过滤-不消解、不过滤-消解、0.45 μm膜过滤-消解、0.22 μm膜过滤-消解。预处理后,参照标准方法[5],将溶液分别转移至微波消解罐中,加入硝酸5 mL、盐酸5 mL进行消解。微波消解升温程序:120 ℃保持2 min;150 ℃保持2 min;180 ℃保持5 min。消解后在仪器工作条件下测定Hg2+。
2 结果与讨论
2.1 标准曲线与检出限
将Hg2+标准储备溶液逐级稀释,配制Hg2+质量浓度分别为0,5.00,10.00,20.00,30.00,40.00 μg·L-1的标准溶液系列,参照国家标准方法[5]测定,以测得的吸光度对Hg2+的质量浓度进行线性拟合,Hg2+的质量浓度在40.00 μg·L-1以内呈线性,线性回归方程为y=0.009 2x+0.008 9,相关系数为0.999 7。
方法检出限以平行11次测得的空白值的标准偏差的3倍比方法灵敏度得到,为0.06 μg·L-1。
2.2 HgS体系中Hg2+的测定
不同预处理下,体系空白均未检出;由于HgS粒径小,能够长期均匀分布在体系中,沉淀平衡时体系各形态汞分布均匀。平衡体系原液、滤液及消解液中总汞、溶解态汞、Hg2+的测定结果见表1。表1中不过滤-消解下测定结果为总汞,过滤-消解下测定结果为溶解态汞,不消解下测定结果为Hg2+。
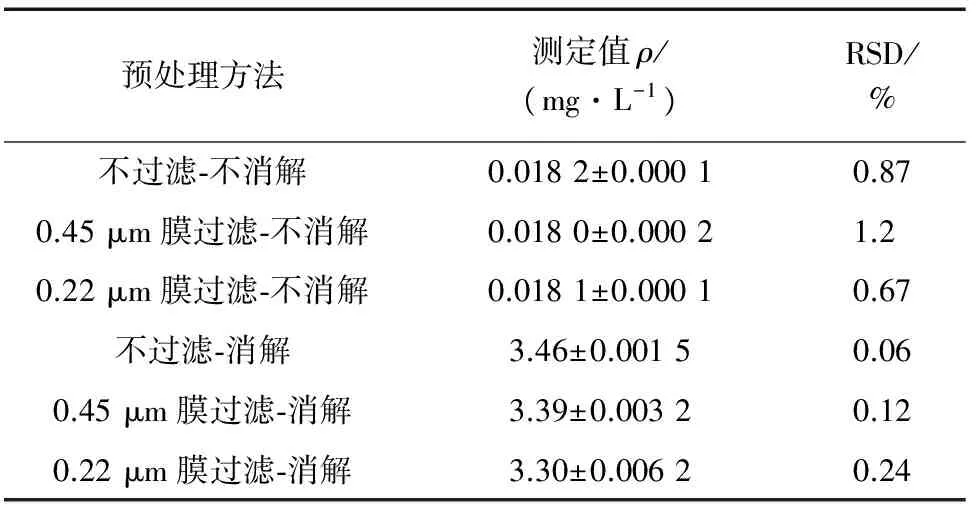
表1 不同预处理下汞的测定结果(n=3)Tab. 1 Determination results of mercury under different pretreatment conditions(n=3)
由表1可知:各预处理方法下测定值的相对标准偏差(RSD)均很小,在0.06%~1.2%之间,说明精密度很高,随机误差很小。不过滤-消解获得总汞质量浓度(3.46±0.001 5) mg·L-1与理论值(由体系加入Hg2+量计算得到)一致,说明总汞测定准确度高;0.45 μm膜过滤-消解获得的溶解态汞质量浓度略大于0.22 μm膜过滤-消解,同时均略小于总汞质量浓度,说明体系中有少量悬浮态HgS被滤膜滤去,滤去量随滤膜孔径减小而少量增加;不过滤-不消解、0.45 μm膜过滤-不消解、0.22 μm膜过滤-不消解下Hg2+测定结果一致,说明胶态、悬浮态HgS对冷原子吸收光谱法测定Hg2+无影响,测定结果准确,HgS在Hg2+转化为单质汞的原子化过程中难以溶解。
2.3 干扰试验
在pH 8.5条件下,考察不同质量浓度Cl-和不同时间对Hg2+测定的影响。利用pH 8.5溶液,配制一定质量浓度的KCl溶液,以此溶液为稀释液,配制Hg2+质量浓度均为1.00 mg·L-1,而Cl-质量浓度呈梯度变化的样品溶液,做3个平行,静置一定时间后再摇匀,迅速取样稀释100倍,利用冷原子吸收光谱法测定汞,稀释后试样理论Hg2+质量浓度为10.00 μg·L-1。
在pH 8.5条件下,不同质量浓度的Cl-加入体系后不同时间下的Hg2+的测定结果见表2,Cl-加入体系2 h后,Hg2+的测定结果见表3。
由表2可知:不同Cl-质量浓度下,在2 h内各试样中Hg2+质量浓度随时间延长呈现逐渐减小趋势;其中Cl-质量浓度为0时,Hg2+质量浓度的减小可以看作容量瓶吸附作用和测定过程造成的损失。由表3可知:根据Hg2+测定结果平均值与理论值之间的相对误差分析,Cl-质量浓度在60 g·L-1以内时,相对误差在-16%~-8.7%之间,波动较小,RSD在2.1%~6.8%之间;当Cl-质量浓度大于70 g·L-1时,相对误差较大,且相对标准偏差在Cl-质量浓度大于80 g·L-1时大于15%。分析原因可能是:Hg2+~Cl-体系中,汞离子存在的形式有[HgCl]+、[Hg2Cl2]、[HgCl3]-、[HgCl4]2-,离子的分布系数分别为lgK1=6.74,lgK2=6.48,lgK3=0.85,lgK4=1.00,且lgK2与lgK3差距很大;在pH 8.5条件下当Cl-质量浓度不大于70 g·L-1时,体系中汞离子形态主要为[Hg2Cl2],[Hg2Cl2]的溶度积Ksp=1.3×10-18,依然在方法检出限之上;而当Cl-质量浓度大于70 g·L-1时,Hg2+与Cl-深度络合为可溶但难离解的[HgCl3]-和[HgCl4]2-,减弱了测定时SnCl2的还原效果导致测定结果减小,同时使平行试样测定精度下降。
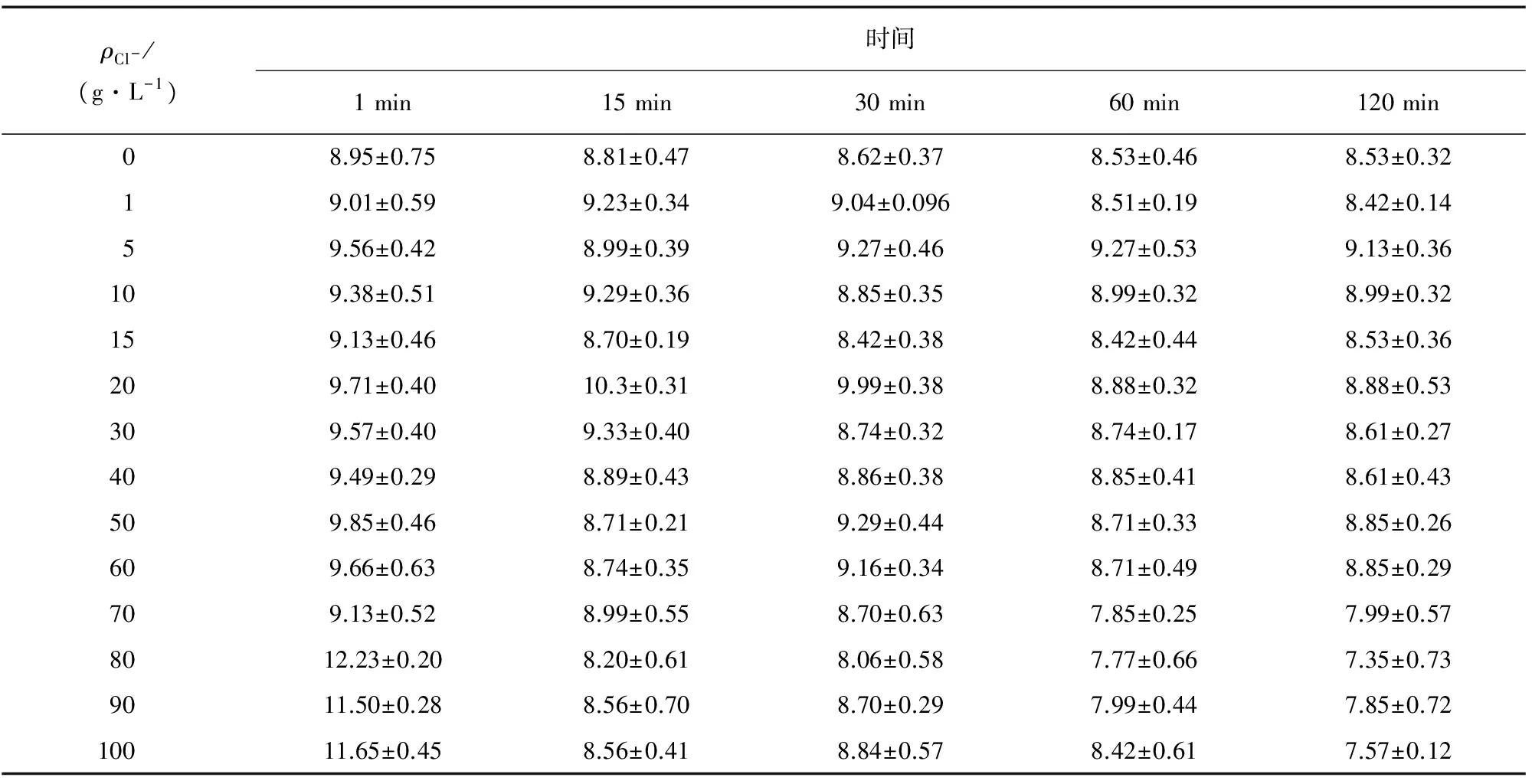
表2 不同质量浓度的Cl-加入体系后不同时间下的Hg2+的测定结果Tab. 2 Determination results of Hg2+ at different time after addition of different mass corentration of Cl- μg·L-1
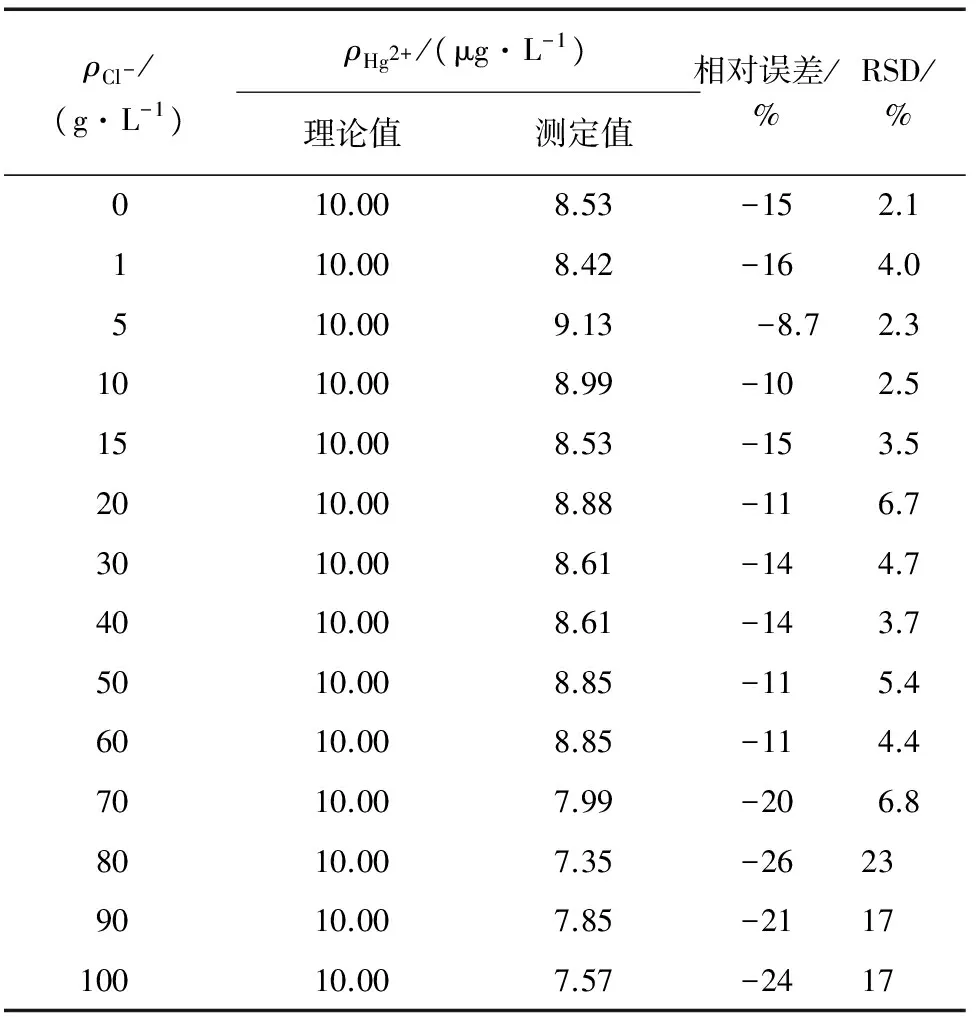
表3 干扰试验结果(n=3)Tab. 3 Results of interference test(n=3)
以HgS沉淀平衡体系为对象,以冷原子吸收微分测汞仪为测试仪器,对比6种过滤-消解组合方法对Hg2+测定结果的影响,同时探讨了Cl-质量浓度对Hg2+测定的影响。结果表明:各方法精密度均很高;不过滤-消解获得的总汞浓度与理论值一致,方法准确度高;少量悬浮态HgS被滤膜滤去,滤去量随滤膜孔径减小而增加;过滤及HgS存在对Hg2+测定无影响,Cl-质量浓度不大于60 g·L-1对测定无影响。推荐原液Cl-质量浓度不大于60 g·L-1时直接采用冷原子吸收法测定其中Hg2+。
[1] 张玉涛.光照和DOM对水体中汞转化的影响机制及动力学研究[D].重庆:西南大学, 2011.
[2] 张玉涛,程劲松,李琳,等.溶解性有机质对水体汞还原反应影响机制研究进展[J].三峡大学学报(自然科学版), 2015,37(1):101-104.
[3] HJ 694-2014 水质 汞、砷、硒、铋和锑的测定 原子荧光法[S].
[4] GB/T 7469-87 水质 总汞的测定 高锰酸钾-过硫酸钾消解法 双硫腙分光光度法[S].
[5] HJ 597-2011 水质 总汞的测定 冷原子吸收分光光度法[S].
[6] 郑直.离子液体萃取光度法测定汞、铜和铁含量的研究[D].长春:吉林大学, 2011.
[7] 喻秀.新型汞离子选择性电极的制备及三联吡啶钌在1-丁基-3-甲基咪唑离子液体中的电致化学发光研究[D].成都:四川大学, 2007.
[8] 吕诗言,叶泰,姜欣.CdTe:Mn/ZnS量子点的合成及其磷光法检测水体中超痕量汞离子的研究[J].化学学报, 2011,69(7):831-837.
[9] 贺胜男,马永梅,李丹丹,等.光波导分光光谱检测痕量Hg2+[J].激光与光电子学进展, 2013(7):171-177.
[10] 何全.硫化物/金纳米粒子应用于汞离子光谱分析的研究[D].湘潭:湖南科技大学, 2010.
[11] 张瑞华.罗丹明6G荧光猝灭法在线测定汞离子的研究[D].石家庄:河北科技大学, 2014.
[12] 汤琳,曾光明,沈国励,等.基于抑制作用的新型葡萄糖氧化酶传感器测定环境污染物汞离子的研究[J].分析科学学报, 2005,21(2):123-126.

