双柱双进样气相色谱法测定花椰菜中的5种有机磷农药残留
, , ,
(1. 山西省分析科学研究院, 太原 030006; 2. 山西省食品质量安全监督检验研究院, 太原 030006)
花椰菜,又称菜花、花甘蓝、球花甘蓝,是一种十字花科蔬菜,为甘蓝的变种。2016年5月24日安全信息网发表文章《蔬菜农残排行,前五都是常吃的!去毒方法要记牢》将花椰菜农药残留列为第3名。目前有机磷农药的测定方法主要有气相色谱法[1-2]、气相色谱-质谱法[3-4]、气相色谱-串联质谱法[5-6]和液相色谱-串联质谱法[7-8]。气相色谱法作为一种更为普遍的检测方法,在检测中应用更为方便,但是有文献报道检测有机磷农药残留过程中发现花椰菜基质效应造成色谱图干扰峰多[9-11],这有可能导致定性定量不准确。
本工作以双柱双进样方式气相色谱法测定花椰菜中有机磷农药残留。采用脉冲不分流大体积进样5 μL、以DB-17色谱柱初筛,发现疑似阳性样品再用不分流进样1 μL,以HP-5色谱柱佐证,两者检验结果一致,可排除测定中共出峰的干扰,以解决气相色谱法测定花椰菜中有机磷农药残留时存在的基质干扰问题。
1 试验部分
1.1 仪器与试剂
Agilent 7890B型气相色谱仪,配Agilent改进型火焰光度检测器(FPD+)和7693型全自动样品进样器;N-EVAP-12型氮吹浓缩装置;IKA-T25型匀浆机;KQ-500E型超声波清洗器;HL-200型粉碎机;20 mL螺口圆底带刻度的玻璃试管;0.22 μm有机滤膜;XW-80A型漩涡混合器。
灭线磷、甲拌磷、甲拌磷砜、甲拌磷亚砜、三唑磷标准储备溶液:1.000 g·L-1,使用前用丙酮配制成混合标准溶液。
乙腈、丙酮为色谱纯;氯化钠为分析纯。
1.2 仪器工作条件
DB-17毛细管色谱柱(30 m×0.32 mm,0.25 μm),固定相为50%苯基50%甲基聚硅氧烷。柱升温程序:初始温度80 ℃,保持3 min;以8 ℃·min-1速率升温至180 ℃,保持5 min;以10 ℃·min-1速率升温至280 ℃,保持12 min。柱流量5 mL·min-1;脉冲不分流进样,脉冲压0.552 MPa,开阀时间0.75 min;进样量5 μL。
HP-5毛细管色谱柱(30 m×0.32 mm,0.25 μm),固定相为5%苯基甲基聚硅氧烷。柱升温程序:初始温度80 ℃;以15 ℃·min-1速率升温至150 ℃,保持3 min;以10 ℃·min-1速率升温至280 ℃,保持5 min。柱流量4 mL·min-1;不分流进样;进样量1 μL。
载气为氮气;进样口温度220℃ ;检测器温度300 ℃;氢气流量60 mL·min-1;空气流量60 mL·min-1,尾吹气流量60 mL·min-1。
1.3 试验方法
将花椰菜样品可食部分粉碎,于-20 ℃保存过夜去生物活性,称取25 g于150 mL烧杯中,加乙腈50 mL高速匀浆2 min,用锡箔纸盖好,超声提取10 min,用滤纸过滤到装有5 g氯化钠的100 mL具塞量筒中,剧烈振荡1 min,静置30 min使乙腈相和水相分层,移取乙腈相20 mL于玻璃试管中,于70 ℃水浴中氮吹浓缩至近干,用丙酮定容至5 mL,漩涡振荡混匀,过0.22 μm有机滤膜,按仪器工作条件进行测定。
2 结果与讨论
2.1 色谱行为
混合标准溶液和花椰菜阳性样品的色谱图见图1和图2。

(a) DB-17色谱柱

(b) HP-5色谱柱 1-灭线磷;2-甲拌磷;3-甲拌磷砜; 4-甲拌磷亚砜;5-三唑磷图1 混合标准溶液在不同色谱柱上的色谱图Fig. 1 Chromatograms of the mixed standard solution on different chromatographic columns

(a) DB-17色谱柱

(b) HP-5色谱柱 2-甲拌磷;3-甲拌磷砜;4-甲拌磷亚砜;5-三唑磷图2 阳性样品在不同色谱柱上的色谱图Fig. 2 Chromatograms of positive samples on different chromatographic columns
2.2 色谱柱的选择
化合物在不同极性的色谱柱中保留时间不同,根据此特点选用两根极性不同的色谱柱进行定性[12]。试验先后考察了5根具有不同长度、内径、液膜厚度的色谱柱,分别为非极性DB-1色谱柱(25 m×0.32 mm,0.12 μm)、弱极性HP-5色谱柱(30 m×0.32 mm,0.25 μm)、中等极性DB-17色谱柱(30 m×0.32 mm,0.25 μm)、DB-17色谱柱(30 m×0.53 mm,1.0 μm)和DB-1701色谱柱(30 m×0.25 mm,0.25 μm)。进样1 μL加标浓度为0.02 mg·L-1的空白样品溶液,结果发现:甲拌磷亚砜响应值低,样品基质峰多,甲拌磷、甲拌磷砜和甲拌磷亚砜折算成甲拌磷后在蔬菜中的限量值是0.01 mg·kg-1[13],影响结果判定。对升温程序、载气流量、进样量、检测器温度等参数优化后,能满足样品基质峰和目标物峰以及目标物峰之间分离度大于1.5时,测定下限小于限量值的只有DB-17色谱柱(30 m×0.32 mm,0.25 μm)和HP-5色谱柱(30 m×0.32 mm,0.25 μm)。
以脉冲不分流进样2 μL加标浓度为0.02 mg·L-1的空白样品溶液,甲拌磷亚砜在DB-17色谱柱上比HP-5色谱柱上峰面积大,因此试验选择DB-17色谱柱采用脉冲不分流进样方式。在满足检出限的前提下,分析时间越长,分离效率越好。所以选择DB-17色谱柱作为筛查目标化合物的色谱柱。花椰菜样品中的农药残留可能不止5种,最好的分离效率能较容易检出目标以外的有机磷农药。
2.3 进样量的优化
虽然进样量大可以提高灵敏度,但是也很容易造成色谱柱超载和衬管超载,色谱柱超载会减低分离度,使峰形畸变,影响柱性能。对于浓度很低的有机磷农药残留,超载问题只与溶剂有关。所以只要有效地消除溶剂影响,就可以加大进样量,以提高灵敏度。FPD检测器是高选择性检测器,测有机磷农药安装的是磷滤光片,只对含磷的有机物有信号响应,本试验进样5 μL丙酮溶剂对定性定量不造成影响。衬管超载会造成精密度过低,影响试验稳定性。毛细管色谱柱进样口的衬管体积都不超过1 mL,液体溶剂样品通过进样口被注入衬管瞬间汽化体积膨胀近千倍,进样量超过1 μL容易造成衬管超载样品外溢。脉冲不分流技术是在液体样品进样的一瞬间汽化时,关闭进样口分流阀,同时进样口载气以脉冲压力方式避免因汽化后的样品外溢,防止衬管过载,当样品全部进入色谱柱后打开分流阀,进样口载气压力恢复正常。
对加标浓度为0.02 mg·L-1的花椰菜空白样品,进样量从1 μL增加到6 μL,各进样6次,考察目标物分离度、峰面积及其相对标准偏差(RSD)。以满足分离度大于1.5,RSD小于2%时峰面积最大的进样量作为优化进样量,优化进样量为5 μL。在两种色谱柱条件下,选择不同进样量可以互相佐证定量的准确性。
2.4 标准曲线和检出限
移取标准储备溶液配制成质量浓度分别为0.02,0.05,0.10,0.15,0.20 mg·L-1的标准溶液系列,按试验方法进行测定,以农药的质量浓度为横坐标,相应的峰面积为纵坐标绘制标准曲线。结果表明:各农药的质量浓度在0.02~0.20 mg·L-1内与对应的峰面积呈线性关系,其线性回归方程和相关系数见表1和表2。
以3倍信噪比计算得各农药的检出限(3S/N)见表1和表2。
2.5 精密度和回收试验及显著性检验
分别使用DB-17和HP-5色谱柱,在花椰菜空白样品中进行不同浓度水平的加标回收试验,计算回收率和测定值的相对标准偏差,结果见表3。
以两根色谱柱定量测定的回收率为数据进行配对样本显著性检验,结果见表3。

表1 使用DB-17色谱柱得到的线性参数及检出限Tab. 1 Linearity parameters and detection limits by using DB-17 chromatographic column

表2 使用HP-5色谱柱得到的线性参数及检出限Tab. 2 Linearity parameters and detection limits by using HP-5 chromatographic column
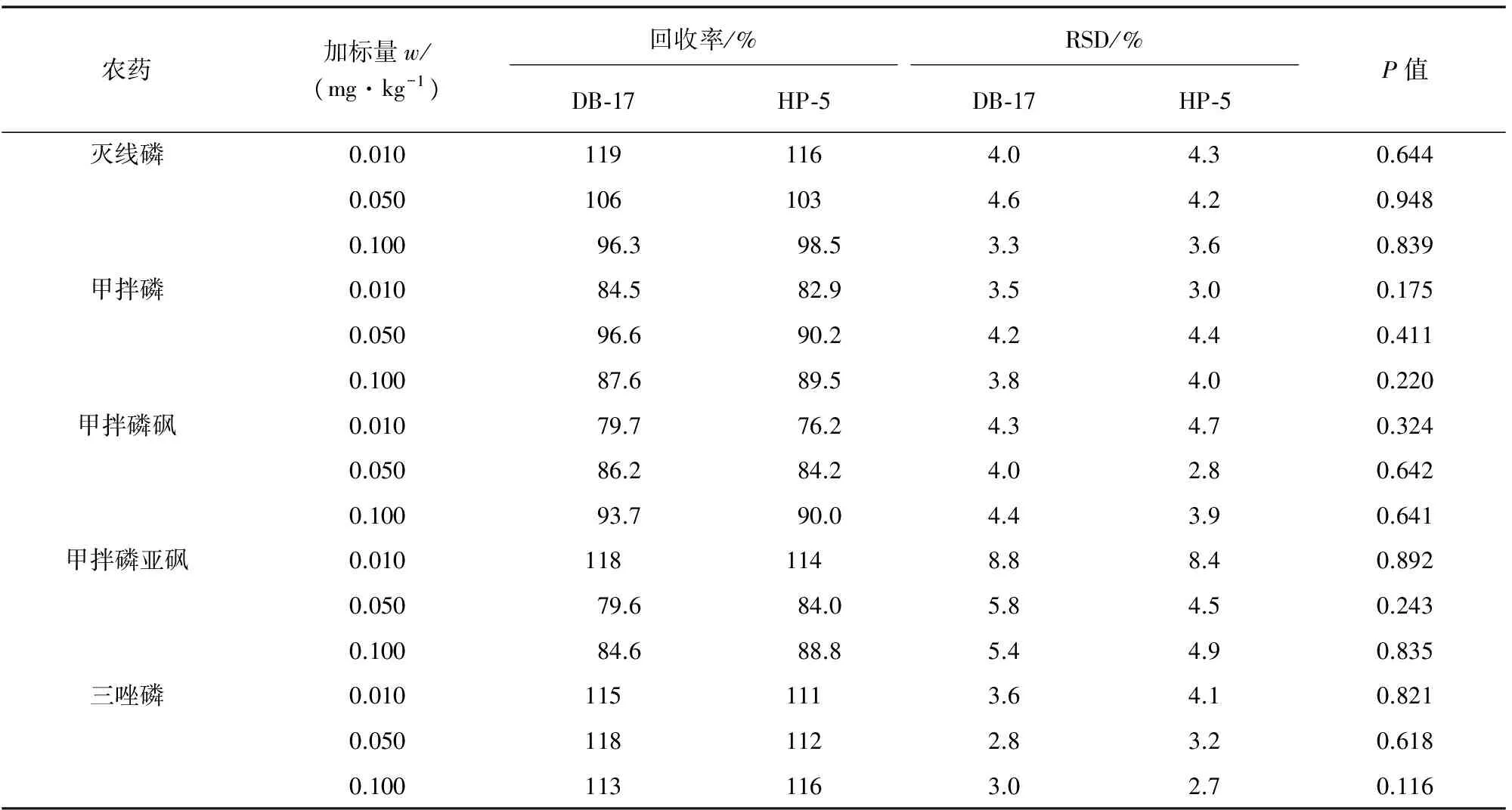
表3 精密度和回收试验结果及显著性检验结果(n=10)Tab. 3 Results of tests for precision, recovery and significance(n=10)
由表3可知:使用两根色谱柱得到的加标回收率在76.2%~119%之间,RSD均在8.8%以内,显著性检验结果P值均大于0.05,说明本方法用两根色谱柱测定结果无显著性差异,可以相互佐证测定结果,方法准确可靠。
2.6 样品分析
按试验方法对21批次花椰菜中5种有机磷农药进行测定,其中一批是农业部组织的2016年全国农产品质量安全检测技术能力验证样品,此样品的测定结果满意。其他批次样品中灭线磷和甲拌磷砜未检出,甲拌磷的最大检出量为0.011 mg·kg-1,甲拌磷亚砜的最大检出量为0.008 mg·kg-1,三唑磷的最大检出量为0.12 mg·kg-1。
本工作采用双柱双进样方式的气相色谱法测定花椰菜中5种有机磷农药残留,提高了色谱系统对有机磷农药残留的选择性,适合基质峰多干扰测定的类似花椰菜的蔬菜中有机磷农药残留分析。方法操作简单、选择性强、重现性好,可为无公害检测机构、农产品质量安全检测中心和食品检测单位测定蔬菜中有机磷农药残留提供分析测试思路。
[1] 胡支向,黄阳成,翁春英,等.气相色谱双柱双检测器同时测定蔬菜水果中有机磷农药的多残留应用研究[J].广西农业学报, 2015,30(4):41-44.
[2] 张利强,程盛华,李琪,等.气相色谱法测定谷物中9种有机磷农药残留量的基质效应[J].理化检验-化学分册, 2016,52(2):136-140.
[3] 王海凤,刘海学,王俊斌,等.气相色谱-质谱法测定高粱仔中11种有机磷农药残留量[J].理化检验-化学分册, 2013,49(6):651-653.
[4] 梅婷,吴荣顺,魏波.改良QuECHERS-气相色谱-质谱法测定蔬菜中有机磷[J].中国果菜, 2014,34(6):53-58.
[5] 张慧丽,王建华,李馨,等.气相色谱串联质谱法测定蔬菜中甲拌磷和克百威及其代谢物的残留量[J].化学分析计量, 2016,25(1):10-14.
[6] 张园,张琦,王贤亲,等.固相萃取-气相色谱串联质谱法测定温莪术中19种有机氯和有机磷农药残留[J].药物分析杂志, 2012,32(1):95-99.
[7] 刘永,唐英斐,宋金凤,等.固相萃取-液相色谱-串联质谱法测定蔬菜中4种有机磷农药及其代谢产物[J].色谱, 2014,32(2):139-144.
[8] 王玉健,黄慧玲,董存柱,等.超高效液相色谱-串联质谱法同时测定水产品中9种有机磷农药残留[J].理化检验-化学分册, 2013,49(4):398-401.
[9] 江燕玲,成秀娟,魏燕秋,等.有机磷农药残留量对检测过程中基质效应研究[J].农药科学与管理, 2012,33(2):22-29.
[10] 刘淑梅,刘晓鹏,徐悦,等.不同基质效应对蔬菜中有机磷农药残留的分析[J].南方农业, 2014,8(30):156-157.
[11] 姜慧梅,谢燕萍.基质效应对不同蔬菜中有机磷农药检测影响[J].农药科学与管理, 2014,35(11):58-61.
[12] 房宁,李倩,巩俐彤,等.QuECHERS净化-气相色谱双柱法测定果蔬中25种有机磷农药[J].中国卫生检验杂志, 2013,23(11):2462-2464.
[13] GB 2763-2014 食品安全国家标准食品中农药最大残留限量[S].

