感染因素通过调控巨噬细胞表型变化影响伤口愈合的机制研究
曾芷晴 劳丽燕 陈嘉宁*
皮肤伤口是人群中十分常见的健康问题,而伤口愈合是一个复杂的修复过程。伤口愈合过程需要多种因素共同组成精细、有序的平衡调控:例如细胞的增殖与凋亡、胶原的生成与溶解、血管的生成与破坏等[1,2]。而伤口感染的发生、营养不良、血糖异常等因素的存在均可能导致伤口愈合不良[3,4],从而严重影响人们的生活质量。
成纤维细胞是伤口愈合修复过程中重要的效应细胞[5]。皮肤成纤维细胞通常情况下处于静止状态,但是在皮肤损伤不久后即被激活成肌成纤维细胞(myofibroblasts),激活的成纤维细胞迁移到伤口边缘,一方面发挥其收缩功能,促进伤口收缩,另一方面通过加速增殖、大量合成胶原蛋白来促进肉芽组织形成[1]。在创伤愈合的组织改建期,成纤维细胞所分泌的基质金属蛋白酶(matrix metalloproteinases,MMPs)所介导的胶原降解和重排又为伤口的适度修复提供了重要保障。
巨噬细胞作为伤口局部浸润的重要炎症细胞组分同样在伤口愈合过程中扮演重要角色[5],它是创伤愈合过程中主要的细胞因子来源,它可以通过分泌细胞因子调控创伤愈合过程[6],此外,研究显示,巨噬细胞与创伤愈合过程中成纤维细胞的增殖和胶原代谢的平衡密切相关[7-9]。然而,关于巨噬细胞在伤口愈合过程中是发挥促进作用还是抑制作用目前仍然存在争议。有研究报道,M1型巨噬细胞所导致的不可控炎症在人和小鼠的烧伤模型中都显著抑制创伤愈合[10,11],而其他学者的研究则报道在伤口愈合模型中通过基因编辑技术去除巨噬细胞会导致伤口愈合不良[12]。而目前关于巨噬细胞的研究表明,巨噬细胞在体内具有显著多样性,不同活化状态的巨噬细胞可能发挥截然不同的生物学功能。由细菌脂多糖(LPS)或干扰素γ(IFN-γ)所诱导的巨噬细胞活化为经典激活(classical activation),呈现为M1促炎表型,而由白介素-4(IL-4)和白介素-13(IL-13)等Th2因子所介导的巨噬细胞活化称为选择性激活(alternative activation),呈现为M2表型[13]。在纤维化疾病的研究中,有研究报道,M1和M2型激活的巨噬细胞的浸润与纤维化疾病发展的关系迥异,M2型巨噬细胞可以通过促进肺成纤维细胞的增殖和胶原合成从而促进肺纤维化,而M1型的巨噬细胞则能够通过促进成纤维细胞分泌基质金属蛋白酶从而抑制纤维化的发生发展[14,15]。于是,我们提出以下假设:在伤口愈合过程中,是否不同活化类型的巨噬细胞对成纤维细胞的活化具有不同的调控作用从而导致不同的伤口愈合结局呢?
伤口创面感染是影响伤口愈合最常见的原因。而细菌释放的细菌脂多糖(lipopolysaccharides,LPS)是诱导巨噬细胞M1型活化的经典因素。然而,感染因素影响伤口愈合的具体机制仍然尚未明确。因此,本研究旨在体外探讨不同活化类型的巨噬细胞对皮肤成纤维细胞活化的调控作用以及感染因素的存在是否能够通过影响巨噬细胞的活化状态来调控皮肤成纤维细胞的功能。
1 材料与方法
1.1 材料及仪器
人皮肤成纤维细胞株HFF购自中国科学院细胞库;DMEM培养基、0.25%胰酶、胎牛血清(Fetal bovine serum,FBS)购自life technology;人淋巴细胞分离液购自天津灏洋生物制品有限公司;重组细胞因子IL-4、LPS购自PeproTech公司;FITC标记HLA-DR抗体、PE标记CD206抗体及其同型抗体购于ebioscience公司;0.4μm transwell小室购自Corning;噻唑蓝(MTT)粉末购自sigma公司;Ⅰ型、Ⅲ型胶原蛋白ELISA试剂盒购自Elabscience;RNA逆转录试剂盒及实时荧光定量PCR(q-PCR)试剂盒购自Takara。
1.2 细胞培养
人皮肤成纤维细胞株HFF应用DMEM+10%胎牛血清培养,置于37℃含5%CO2的培养箱中。人外周血单核细胞(human peripheral blood monocyte cells,PBMC)分离方法参考之前文献报道[16],收集健康人的外周血,将其置于淋巴细胞分离液上,密度梯度离心后吸取白膜层细胞,贴壁的为单核-巨噬细胞。单核-巨噬细胞的培养基应用DMEM+10%胎牛血清。细菌脂多糖(LPS)和IL-4处理巨噬细胞的浓度分别为50 ng/mL及45 ng/mL,处理时间为4 d,每两天换液加药1次。
1.3 巨噬细胞与成纤维细胞共培养
HFF成纤维细胞与巨噬细胞共培养应用0.4 μm transwell小室,将巨噬细胞置于上室,HFF成纤维细胞接种于下室。
1.4 流式细胞术
巨噬细胞表面标记物HLA-DR及CD206的表达情况通过流式细胞术检测。巨噬细胞通过不同处理后,消化收集细胞沉淀,预冷PBS冲洗后离心,100μL PBS+0.2%BSA抗体稀释液重悬细胞后加入5μL FITC标记HLA-DR抗体、PE标记CD206或其同型抗体,4℃孵育30 min后,PBS洗两遍,流式细胞仪检测平均荧光密度。
1.5 ELISA
收集与巨噬细胞共培养的HFF成纤维细胞的培养上清,4℃、3000 rpm离心收集上清液用于ELISA实验。Ⅰ型、Ⅲ型胶原蛋白的分泌通过ELISA实验检测,实验操作参考试剂盒说明书。绝对浓度通过绘制标准曲线计算。实验独立重复3次。
1.6 实时荧光定量PCR(q-PCR)
细胞总RNA提取采用Trizol提取法,RNA逆转录及q-PCR实验操作参考试剂盒说明书。实验中使用的引物序列如下:
MMP9 上游引物:5′-AGACCTGGGCAGATTCCAAAC-3′;
MMP9 下游引物:5′-CGGCAAGTCTTCCGAGTAGT-3′;
MMP13 上 游 引 物 :5′-ACTGAGAGGCTCCGAGAAATG-3′;
MMP13 下游引物:5′-GAACCCCGCATCTTGGCTT-3′;
GAPDH上游引物:5′-ACAACTTTGGTATCGTGGAAGG-3′;
GAPDH 下 游 引 物 :5′-GCCATCACGCCACAGTTTC-3′。
1.7 统计学处理
两组定量数据之间比较采用独立样本t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 感染因素(细菌脂多糖,LPS)可诱导巨噬细胞向M1表型活化
为了进一步探讨感染因素在伤口愈合中的作用,探索感染因素是否会通过调控巨噬细胞的活化状态来影响伤口的愈合,首先,我们建立了巨噬细胞不同活化表型的体外模型。我们分别使用白介素-4(IL-4)和细菌脂多糖(LPS)处理外周血单核细胞,通过流式细胞技术检测可以看到,IL4刺激能够明显诱导巨噬细胞中M2型标志物CD206蛋白的高表达并抑制M1型标志物HLA-DR蛋白的表达,而LPS处理的巨噬细胞中则呈现出CD206低表达、HLA-DR高表达的M1表型(图1A,B)。
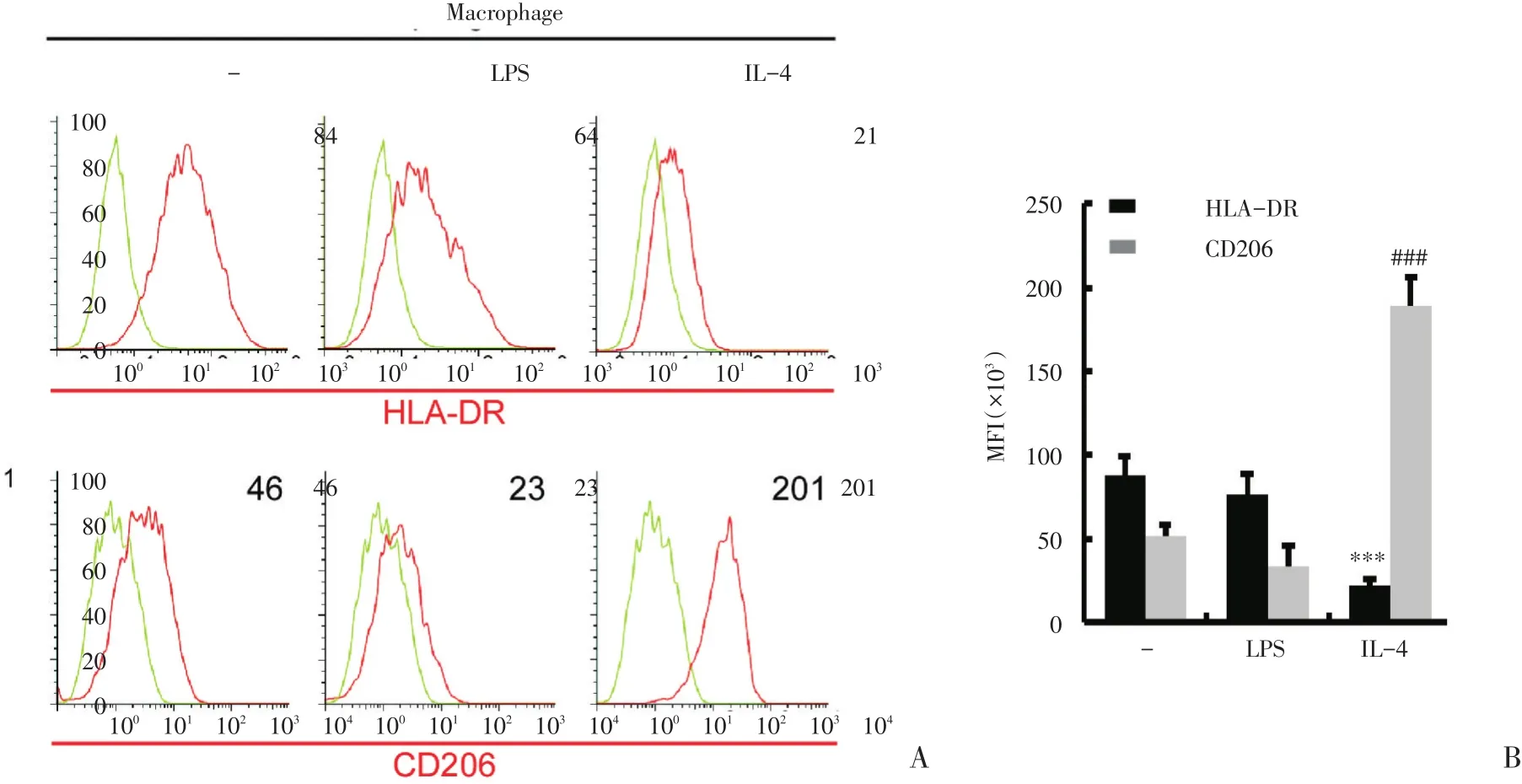
图1 感染因素可诱导M 2型激活的巨噬细胞转化为M1表型
2.2 M2巨噬细胞可激活皮肤成纤维细胞而M1型巨噬细胞抑制皮肤成纤维细胞活化
既往研究发现,成纤维细胞活化后表现为肌成纤维细胞(myofibroblasts)的表型,而α-SMA是肌成纤维细胞的经典分子标志物。我们的研究首先通过细菌脂多糖(LPS)和白介素-4(IL-4)分别处理单核-巨噬细胞诱导其向M1或M2型活化,然后将不同活化类型的巨噬细胞和皮肤成纤维细胞株HFF共培养,通过免疫荧光检测成纤维细胞中α-SMA的表达发现,IL-4激活的M2巨噬细胞能够显著诱导皮肤成纤维细胞表达α-SMA蛋白,而LPS激活的M1型巨噬细胞并不能诱导皮肤成纤维细胞中α-SMA蛋白的表达(图2A)。而研究报道,成纤维细胞的活化除了表面标志物表达的变化外还表现为细胞增殖水平和胶原蛋白分泌水平的提高。我们通过MTT实验检测与不同活化类型的巨噬细胞共培养的成纤维细胞的增殖情况发现,M2型巨噬细胞能够明显诱导与其共培养的成纤维细胞增殖加速,而M1型巨噬细胞并无这一功能(图2B)。进一步,通过ELISA实验检测成纤维细胞分泌胶原的能力,我们发现IL4激活的M2型巨噬细胞能够明显诱导与其共培养的成纤维细胞分泌更多的Ⅰ型和Ⅲ型胶原蛋白,而在M1型巨噬细胞则不能(图2C和D)。与此同时,通过Q-PCR实验检测成纤维细胞表达基质金属蛋白酶MMP9及MMP13的能力发现,M2型巨噬细胞对与其共培养的皮肤成纤维细胞MMP9及MMP13的表达并无显著影响,而M1型巨噬细胞则能够显著促进成纤维细胞MMP9及MMP13的表达(图2E和F)。
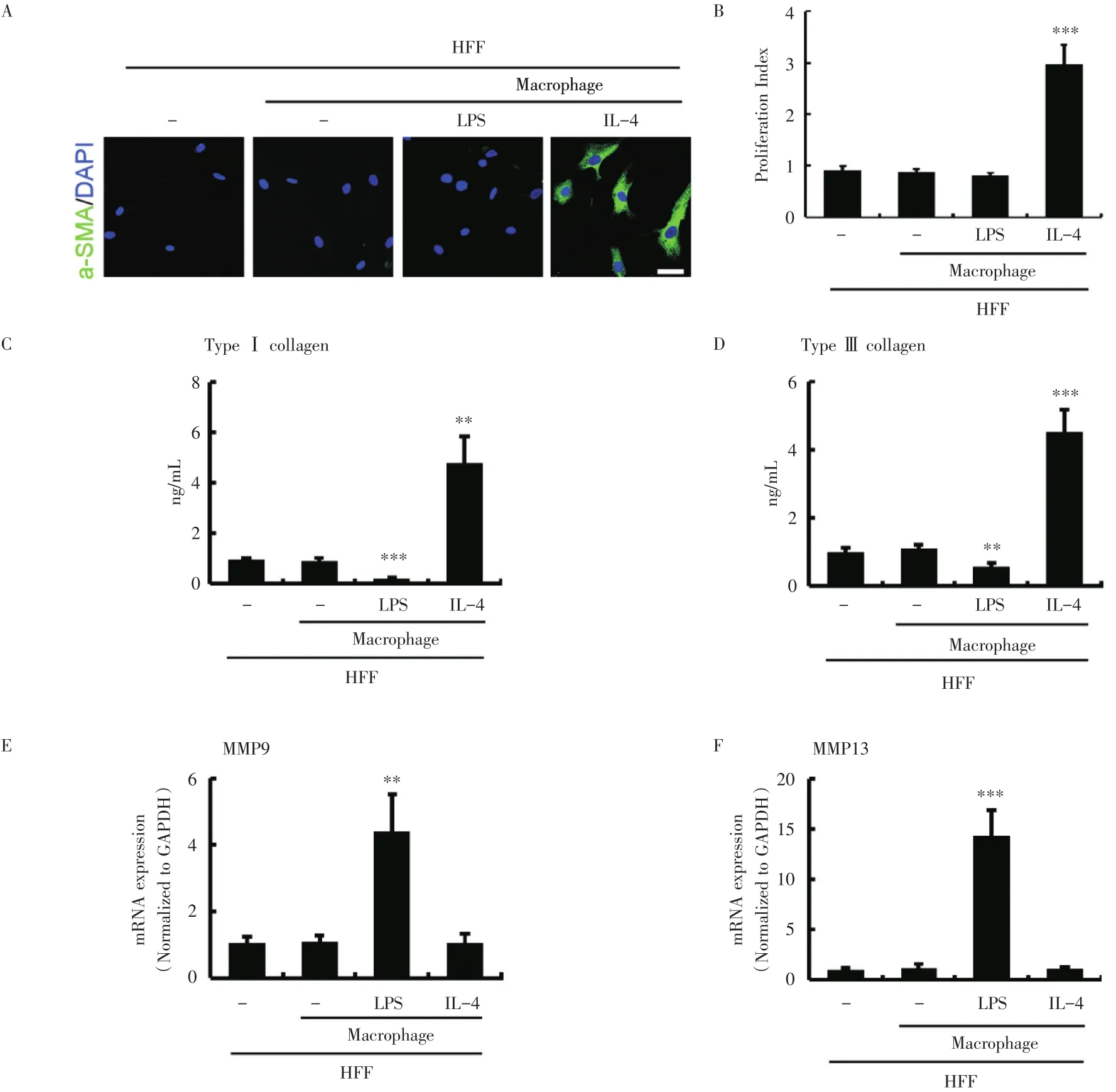
图2 不同活化类型的巨噬细胞对成纤维细胞活化具有不同的调控作用
3 讨论
伤口愈合不良人群中十分常见,相关研究很多,其原因并不十分清楚,治疗效果往往不佳。既往研究显示,成纤维细胞活化过程的准确调控是伤口愈合良好的关键[1,2],深入探索皮肤成纤维细胞的分子机制对研发改善伤口愈合效果的治疗手段具有重要意义。
巨噬细胞是伤口局部浸润的重要炎症细胞组分,此前有研究显示,M1型巨噬细胞所导致的不可控炎症可显著抑制创伤愈合,而其他学者通过基因编辑技术去除巨噬细胞则发现完全去除巨噬细胞却发现并不利于伤口的愈合[10-12]。这些看似矛盾的研究结果提示我们,在伤口局部浸润的巨噬细胞可能存在不同的活化类型从而发挥不同的生物学功能。在我们的研究中发现,M2型巨噬细胞能够显著诱导与其共培养的皮肤成纤维细胞HFF的活化、增殖以及Ⅰ型和Ⅲ型胶原蛋白的分泌,而M1型的巨噬细胞并没有这一功能,反而会促进皮肤成纤维细胞高表达基质金属蛋白酶MMP9和MMP13。以上结果显示,在皮肤成纤维细胞的活化中,M1和M2表型的巨噬细胞发挥着截然不同的生物学功能。
在感染与伤口愈合的众多相关性研究中发现,感染的存在往往与伤口的迁延不愈相关[3,12]。而感染因素是否会通过调控巨噬细胞的活化状态的变化来影响伤口愈合目前仍未明确。我们的研究发现,感染因素LPS的存在能够显著诱导巨噬细胞的M1型激活。而在伤口局部,如若M1型激活的巨噬细胞占主导地位,则可导致伤口局部成纤维细胞无法正常活化。此外,LPS所导致的成纤维细胞基质金属蛋白酶表达的升高还可导致伤口局部细胞外基质的降解,从而进一步介导伤口的迁延不愈。
综上所述,本研究通过成功诱导巨噬细胞的不同活化模型并采用巨噬细胞与皮肤成纤维细胞共培养的模型证明,感染因素的存在能够通过调控巨噬细胞激活表型的转化从而调控皮肤成纤维细胞的活化及功能从而影响伤口愈合。这为临床治疗工作中严格控制伤口感染提供了更为充分的理论依据,同时也提示,在控制好伤口感染的同时,研发针对伤口局部巨噬细胞活化关键调控节点的治疗方法和手段对改善伤口愈合效果具有重要意义。而此部分结果还需在下一步的研究中通过设计动物模型来进行体内试验的验证。
[1] Martin P.Wound healing--aiming for perfect skin regeneration[J].Science,1997,276(5309):75-81.
[2] Broughton G,2nd,Janis JE,Attinger CE.The basic science of wound healing[J].Plast Reconstr Surg,2006,117(7 Suppl):12S-34S.
[3] Robson MC.Wound infection.A failure of wound healing caused by an imbalance of bacteria[J].Surg Clin North Am,1997,77(3):637-50.
[4] Edwards R,Harding KG.Bacteria and wound healing[J].Curr Opin Infect Dis,2004,17(2):91-6.
[5] Diegelmann RF,Evans MC.Wound healing:an overview of acute,fibrotic and delayed healing[J].Front Biosci,2004,9:283-289.
[6] Werner S,Grose R.Regulation of wound healing by growth factors and cytokines[J].Physiol Rev,2003,83(3):835-870.
[7] Hunt TK,Knighton DR,Thakral KK,et al.Studies on inflammation and wound healing:angiogenesis and collagen synthesis stimulated in vivo by resident and activated wound macrophages[J].Surgery,1984,96(1):48-54.
[8] Pellicoro A,Ramachandran P,Iredale JP,et al.Liver fibrosis and repair:immune regulation of wound healing in a solid organ[J].Nat Rev Immunol,2014,14(3):181-94.
[9] Liao WT,Yu HS,Arbiser JL,et al.Enhanced MCP-1 release by keloid CD14+cells augments fibroblast proliferation:role of MCP-1 and Akt pathway in keloids[J].Exp Dermatol,2010,19(8):e142-150.
[10] Sindrilaru A,Peters T,Wieschalka S,et al.An unrestrained proinflammatory M1 macrophage population induced by iron impairs wound healing in humans and mice[J].J Clin Invest,2011,121(3):985-9297.
[11] Mirza R,Koh TJ.Dysregulation of monocyte/macrophage phenotype in wounds of diabetic mice[J].Cytokine,2011,56(2):256-264.
[12] Mirza R,DiPietro LA,Koh TJ.Selective and specific macrophage ablation is detrimental to wound healing in mice[J].Am JPathol,2009,175(6):2454-2462.
[13] Mantovani A,Sica A,Sozzani S,et al.The chemokine system in diverse forms of macrophage activation and polarization[J].Trends Immunol,2004,25(12):677-686.
[14] Song E,Ouyang N,Horbelt M,et al.Influence of alternatively and classically activated macrophages on fibrogenic activities of human fibroblasts[J].Cell Immunol,2000,204(1):19-28.
[15] Su S,Zhao Q,He C,et al.miR-142-5p and miR-130a-3p are regulated by IL-4 and IL-13 and control profibrogenic macrophage program[J].Nat Commun,2015,6:8523.
[16] Chen J,Yao Y,Gong C,et al.CCL18 from tumor-associated macrophages promotes breast cancer metastasis via PITPNM3[J].Cancer Cell,2011,19(4):541-555.

