长链非编码RNA Lnc-DQ在肝癌组织中的表达及其对SMMC7721细胞干性特征的影响
林泽伟 曾兵 叶会霖 程帝 刘吉奎*
原发性肝癌是世界上最常见且恶性程度最高的肿瘤之一,发病率在恶性肿瘤中居第五位,死亡率居第三位。我国是肝癌的高发地区之一,每年约有14万人死于肝癌,占全世界HCC死亡人数的50%以上,严重威胁着人们的健康及生命[1]。长链非编码RNAs(LncRNAs)是一类转录本长度超过200 nt的RNA分子,在肿瘤发生发展中发挥重要作用[2]。包括肝癌在内,目前已在多种肿瘤中发现LncRNAs的异常表达。近期表达谱芯片研究中发现Lnc-DQ在肝癌中高表达[3];我们前期研究亦发现Lnc-DQ高表达与肝癌进展相关。肿瘤干细胞是导致肿瘤术后复发转移的重要原因之一。Lnc-DQ是否调控肝癌干细胞干性特征参与肝癌的复发转移尚未见相关报道。本研究通过检测Lnc-DQ在肝癌中的表达,观察下调Lnc-DQ对肝癌SMMC7721细胞干性特征的影响,为肝癌的诊疗提供新思路。
1 资料与方法
1.1 一般资料
经伦理委员会批准,在患者知情同意的原则下收集中山大学孙逸仙纪念医院2012年1月至2014年10月外科手术切除,并经组织病理检查确诊的30例肝癌患者的癌组织及癌旁组织。
1.2 主要试剂
细胞培养基DMEM、胎牛血清、B27细胞培养添加剂及opti-MEM培养基及Lipofectamine 2000均购自Invitrogen公司;表皮生长因子EGF购自BD公司;Trizol、RNA反转录试剂盒及PCR试剂盒购自Takara公司;引物的合成(上海吉玛公司);sh-NC和sh-Lnc-DQ表达载体购自美国Origene公司;小牛血清白蛋白BSA和胰岛素insulin购自Sigma公司;培养瓶、培养皿及六孔培养板购自广州威佳公司;CD133抗体购自Abcam公司。
1.3 细胞培养及细胞转染
肝癌细胞HepG2,Huh-7,SMMC7721和正常肝细胞L02购自中国科学院典型培养物保藏委员会细胞库,复苏后以1×105/mL的密度接种于培养瓶中,置于37℃、5%CO2的培养箱中进行培养。sh-NC或sh-Lnc-DQ表达载体转染HEK293T细胞,48 h后收集病毒上清液用于感染SMMC7721细胞。24 h后加入2μg/mL的嘌呤霉素进行筛选,两周后获得稳定敲低Lnc-DQ(实验组)和sh-NC(对照组)的细胞系,扩大培养后用于后续实验。
1.4 实时定量反转录聚合酶链反应(RT-qPCR)检测Lnc-DQ的表达
采用Trizol提取总RNA,分光光度仪计算RNA的浓度和纯度。Lnc-DQ上游引物5′-TAG GCG GAC ATT GTG GTG AGT-3′,下游引物 5′-CTT CTG CTG GGC TGT TGA GTG-3′。GAPDH 上游引物 5′-AGCCACATCGCT CAG ACA C-3′;下游引物 5′-GCC CAA TAC GAC CAA ATC C-3′。PCR参数为:95℃ 30 s,95℃ 5 s及60℃ 20 s,共40个循环,采用2-ΔΔCT法进行计算分析,所有标本均重复检测3次,具体参照文献[4]进行。
1.5 克隆形成实验
将对数生长的实验组和对照组细胞,按每孔1×103个细胞接种于6孔板中,放入培养箱中培养,每2 d观察细胞状态并更换培养基。两周后弃培养基,PBS洗两遍后,加入多聚甲醛固定30 min,再用结晶紫染色10~15 min,重复3次实验。
1.6 成球培养实验
取对数生长的实验组和对照组细胞制成单细胞悬液,接种至含有成球培养基的低黏附6孔板中,并每天轻轻晃动1~2次防止细胞贴壁。培养两周后,倒置显微镜下拍照观察细胞成球情况并计数,统计并分析各组微球体形成数量,重复3次实验。
1.7 流式细胞仪检测CD133+细胞比例
分别取实验组和对照组细胞,收集5×106个细胞,用PBS洗涤2次后,500μL染色缓冲液重悬细胞。分别加入5μL的CD133抗体,4℃避光孵育30 min后,再将两组细胞以300×g离心5 min,弃上清液后分别再用PBS洗涤2次,流式细胞仪检测CD133+细胞的比例。
1.8 统计学方法
采用SPSS 16.0软件进行统计学分析,计量资料以均数±标准差表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 Lnc-DQ在肝癌组织及细胞中的表达
RT-qPCR检测显示,Lnc-DQ在肝癌组织中的相对表达量为(3.24±0.34),显著高于癌旁组织(1.81±0.17),差异具有统计学意义(P<0.05)(图1A)。Lnc-DQ在肝癌细胞中均高表达,在SMMC7721中的表达最高,为正常肝细胞L02中的3.186倍(P<0.05)(图1B)。
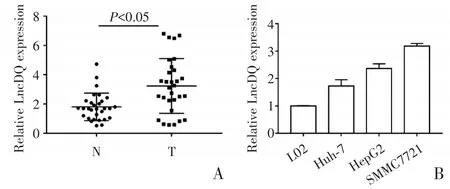
图1 Lnc-DQ在肝癌组织(A)及细胞(B)中的表达
2.2 Lnc-DQ在sh-Lnc-DQ细胞和sh-NC细胞中的表达
RT-qPCR检测显示shRNA转染可显著下调Lnc-DQ的表达,其中实验组sh-Lnc-DQ细胞中Lnc-DQ的相对表达量为0.32±0.12,对照组sh-NC细胞中的相对表达量为1.02±0.023,差异具有统计学意义(P<0.05)(图2)。
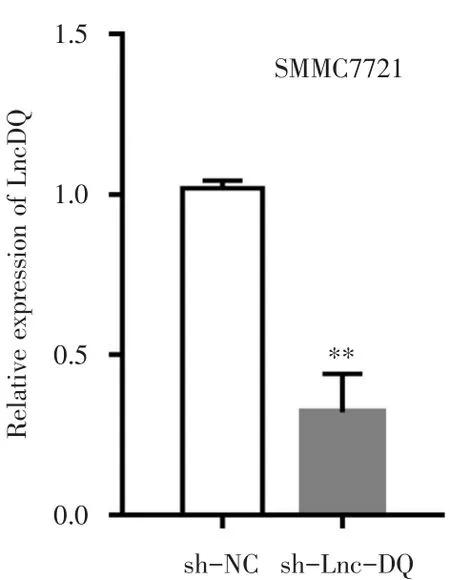
图2 shRNA转染对Lnc-DQ表达的影响
2.3 下调Lnc-DQ对SMMC7721细胞克隆形成及体外成球能力的影响
克隆形成实验结果显示,sh-Lnc-DQ可显著抑制SMMC7721细胞的克隆形成能力,实验组细胞克隆形成数为43.62±5.35,较对照组显著减少(94.31±5.07),差异具有统计学意义(P<0.05)(图3A)。球囊培养实验结果显示,sh-Lnc-DQ可显著抑制SMMC7721细胞的成球能力,差异具有统计学意义(P<0.05)(图3B)。
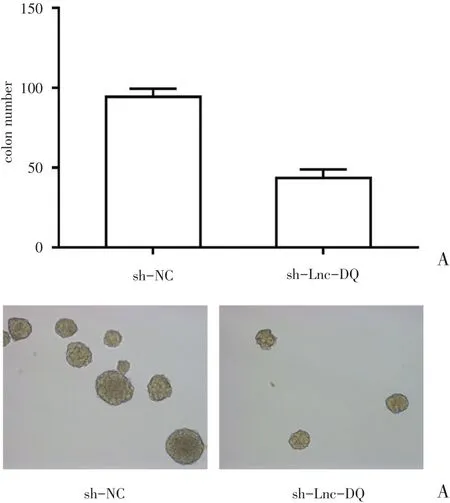
图3 下调Lnc-DQ对克隆形成(A)及体外成球能力(B)的影响
2.4 下调Lnc-DQ对SMMC7721细胞CD133+细胞比例的影响
流式细胞检测显示,实验组细胞中CD133+细胞的比例为2.32%±0.25%,显著低于对照组织细胞的9.24%±0.69%,两组比较差异具有统计学意义(P<0.05)(图4)。
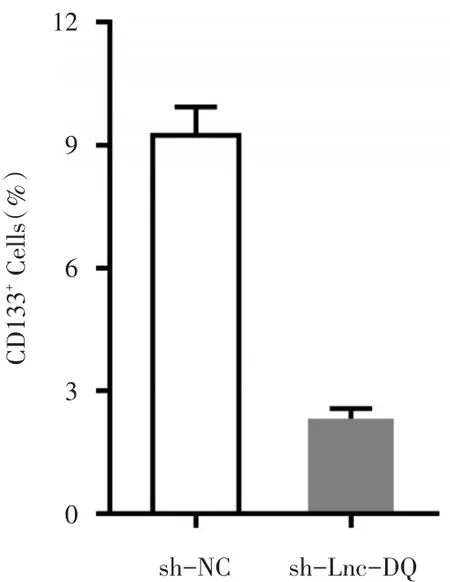
图4 下调Lnc-DQ对CD133+细胞比例的影响
3 讨论
研究发现LncRNAs通过调控靶基因的表达在肿瘤的发生发展中扮演着重要角色。目前已在包括肝癌在内的多种肿瘤中发现LncRNAs的异常表达。在肝癌报道较多的LncRNAs有:MALAT1、H19、HULC及MEG3等。如,MALAT-1和H19在正常肝细胞中含量极低,发生肝癌时其表达明显上升[4];多数原发性肝癌中H19的表达高于甲胎蛋白,其与甲胎蛋白联合检测可提高早期肝癌的确诊率[5]。Matouk IJ等[6]发现HULC 可作为结直肠肿瘤肝转移的标志物。Tsang WP等[7]报道CUDR可抑制半胱氨酸天冬氨酸蛋白酶3诱导化疗耐药。Braconi等[8]发现高表达MEG3可通过诱导肝癌细胞凋亡从而抑制肝癌细胞生长。
Lnc-DQ最早报道于克隆恩病中,研究发现其高表达可上调Treg细胞转录因子Foxp3参与克隆恩病的进展[9]。此外,研究还发现Lnc-DQ高表达可促进胃癌和肠癌的进展[10,11]。近期表达谱芯片研究中亦发现Lnc-DQ在肝癌中高表达[3]。本研究发现Lnc-DQ在肝癌组织中的相对表达显著高于癌旁组织,与上述芯片结果一致。接着我们检测了Lnc-DQ在肝癌细胞中的表达,发现SMMC7721细胞表达最高,为正常肝细胞L02的3.186倍。
近期研究显示,LncRNAs在干细胞调控中亦发挥肿瘤重要作用。钟广正等[12]发现LncRNABCSC高表达能够促进膀胱癌干细胞自我更新,且与术后膀胱癌复发率呈正相关。Guo W等[13]发现LncRNA-ICR可特异性调控ICAM-1阳性肝癌细胞的干细胞特性,并促进门静脉癌栓的形成。Zhu P等[14]发现Lnc-BRM在肝癌中高表达,Lnc-BRM与BRM相互作用激活YAP1信号通路促进肝癌干细胞自我更新。肿瘤干细胞是导致肿瘤术后复发转移的重要原因之一。Lnc-DQ是否调控肝癌干细胞干性特征尚未见相关报道。本研究结果显示,下调Lnc-DQ可显著抑制SMMC7721细胞克隆形成能力,实验组细胞克隆形成数较对照组显著减少。体外成球实验结果显示,实验组细胞成球大小及数目显著低于对照组。此外,下调Lnc-DQ可显著下调CD133+肝癌SMMC7721细胞比例。上述结果提示Lnc-DQ的高表达参与了SMMC7721细胞干性特征的维持。
综上所述,本研究发现Lnc-DQ在肝癌中高表达,初步探讨了下调Lnc-DQ对肝癌细胞SMMC7721干性特征的影响,后续将进一步研究Lnc-DQ调控肝癌细胞干性的可能机制。
[1] El-Serag HB.Hepatocellular carcinoma[J].N Engl J Med,2011,365(12):1118-1127.
[2] Ponting CP,Oliver PL,Reik W.Evolution and functions of long noncoding RNAs[J].Cell,2009,136(4):629-641.
[3] Yang F,Zhang L,Huo XS,et al.Long noncoding RNA high expression in hepatocellular carcinoma facilitates tumor growth through enhancer of zeste homolog 2 in humans[J].Hepatology,2011,54(5):1679-1689.
[4] Lin R,Maeda S,Liu C,et al.A large noncoding RNA is a marker for murine hepatocellular carcinomas and a spectrum of human carcinomas[J].Oncogene,2007,26(6):851-858.
[5] Gabory A,Ripoche MA,Yoshimizu T,et al.The H19 gene:regulation and function of a non-coding RNA[J].Cytogenet Genome Res,2006,113(1-4):188-193.
[6] Matouk IJ,Abbasi I,Hochberg A,et al.Highly upregulated in liver cancer noncoding RNA is overexpressed in hepatic colorectal metastasis[J].Eur J Gastroenterol Hepatol,2009,21(6):688-692.
[7] Tsang WP,Wong TW,Cheung AH,et al.Induction of drug resistance and transformation in human cancer cells by the noncoding RNA CUDR[J].RNA,2007,13(6):890-898.
[8] Braconi C,Kogure T,Valeri N,et al.microRNA-29 can regulate expression of the long non-coding RNA gene MEG3 in hepatocellular cancer[J].Oncogene,2011,30(47):4750-4756.
[9] Qiao YQ,Huang ML,Xu AT,et al.LncRNA DQ786243 affects Treg related CREB and Foxp3 expression in Crohn's disease[J].JBiomed Sci,2013,20:87.
[10] Shan T,Fan J,Zhao Q,et al.Upregulation of long non-coding RNA DQ786243 promotes the progression of gastric cancer[J].Mol Med Rep,2017,16(4):3761-3768.
[11] Sun L,Xue H,Jiang C,et al.LncRNA DQ786243 contributes to proliferation and metastasis of colorectal cancer both in vitro and in vivo[J].Biosci Rep,2016,36(3).
[12]钟广正,彭杨,何旺,林天歆.干性相关长链非编码RNA促进膀胱癌干细胞自我更新及其作为经尿道膀胱肿瘤切除术后复发预测指标的研究[J].中华泌尿外科杂志,2015,36(7):495-499.
[13] Guo W,Liu S,Cheng Y,et al.ICAM-1-related noncoding RNA in cancer stem cells maintains ICAM-1 expression in hepatocellular carcinoma[J].Clin Cancer Res,2016,22(8):2041-2050.
[14] Zhu P,Wang Y,Wu J,et al.LncBRM initiates YAP1 signalling activation to drive self-renewal of liver cancer stem cells[J].Nat Commun,2016,7:13608.

