环状RNA-circ-VCAN在胶质瘤细胞中功能及作用机制研究
黄佐於 谢琳 欧阳乐平 何明亮 刘家豪 刘安民
神经胶质瘤是目前最致命和最常见的原发性神经系统肿瘤[1,2],具有异质性遗传因子畸变的特征[3,4]。即使采用先进的手术,化疗和放疗,胶质瘤患者的中位生存率仍然很低[5,6]。为了改善神经胶质瘤的治疗,需要进一步探索胶质瘤恶性进展的分子机制。环状RNA(circ-RNA)是一类新的RNA,是一种不具有5‘至3’极性的共价闭环结构,不含有多聚腺苷酸化的尾部[7,8]。较多的研究证实,哺乳动物的circ-RNA表达保守,在不同的生理和病理过程中起着重要作用,特别是在一些特殊细胞类型或发育阶段中[7],例如circMTO1是以序列特异性方式靶向miR-9,以抑制肝细胞癌恶性进展过程[8]。此外,具有miR-29a结合位点的环状RNA MYLK调节miR-29a的表达,促进膀胱癌发生发展[9]。因此,弄清circ-RNA在肿瘤中的分子机制有助于推进肿瘤治疗方法的改进。
已有文献报道利用生物信息学分析出环状RNA VCAN(circular RNA VCAN,circ-VCAN)在少突胶质细胞瘤和胶质母细胞瘤中均高度表达[10]。在这项研究中,我们的实验发现hsa_circ_0073237(circ-VCAN)在胶质瘤细胞系中上调。此外,敲低circ-VCAN后可以有效抑制胶质瘤细胞的增殖。进一步的实验表明敲除circ-VCAN后也检测到PP65的表达减少,我们推测,circ-VCAN可能与NF-κB信号通路相关,提示circ-VCAN可能成为胶质瘤新的治疗靶点。
1 材料与方法
1.1 材料
胶质瘤细胞株U373和T98G购自ATCC细胞库,并于中山大学孙逸仙纪念医院医研中心保种。胎牛血清、DMEM培养基、胰蛋白酶购自Gibco公司,聚合酶链反应(PCR)试剂盒购自TaKaRa公司。鼠抗一抗P-P65抗体购自Abcam公司,PCR引物由上海生工生物有限公司构建。
1.2 细胞培养
U373和T98G细胞系的培养液成份为10%胎牛血清和DMEM培养基,培养液含青霉素/链霉素100 U/mL。细胞培养37℃、含5%CO2培养箱中,0.25%的胰酶常规消化,选择生长较好的对数期进行实验。
1.3 核质分离实验及RNaseR消化线性RNA实验
将U373和T98G细胞分别以2×105个/孔铺入6孔板各3个孔,当细胞处于80%融合度时用0.25%的胰酶消化细胞,1000 g离心2 min,根据核质分离试剂盒步骤,分别回收胞质和胞核RNA,Nano 2000测定含量,储存待用。将RNA分为RNase消化组和非消化组两组,准备10×Reaction Buffer配制10μL总反应体系,用于消化线性RNA,每1μg RNA用1 U(1个单位)的RNase消化,37℃10 min。随后用苯酚/氯仿、乙醇沉淀法提取消化产物逆转录为cDNA,通过实时荧光定量PCR法检测circ-VCAN在核质中的表达,实验共重复三次。
1.4 实时荧光定量PCR检测RNA表达水平
抽提样品RNA,经浓度和纯度测定后,逆转录合成cDNA样品,以GAPDH为内参。将SYBR Green预混液、模板、上/下游引物、ddH2O配制成PCR反应溶液,置于Real-time PCR仪上进行PCR扩增反应。反应条件为:95℃2 min预变性,然后按 95℃ 1 min,60℃ 1 min,72℃ 1 min,共 40 个循环,最后72℃7 min延伸。结果通过2-△△CT法分析基因相对表达量。
1.5 细胞转染及CCK-8检测细胞增殖实验
从Invitrogen设计和购买靶向circ-VCAN的siRNA片段。并设计circ-VCAN的阴性对照序列片段。将胶质瘤细胞以每孔2×105个细胞接种在6孔板中。根据方案说明书,使用Lipofectamine 2000将siRNA和siRNA-NC转染到胶质瘤细胞中。转染24小时后收集细胞用于后续的实验。U373和T98G细胞增殖检测实验主要通过CCK-8试剂盒完成。实验分为对照组和处理组,采用96孔板中,每个孔铺大约1×103个细胞,培养5 d。加入CCK-8后,37℃孵育2 h,检测OD450的值。
1.6 Western blot检测蛋白表达水平
在收集的蛋白样品中加入适量浓缩的蛋白上样缓冲液,100℃沸水浴加热3~5 min,以充分变性蛋白。经过跑胶、转膜、封闭、一抗、二抗及显影液孵育后,于Bio-Rad公司化学发光成像仪显影成像。
1.7 统计学方法
数据通过Graphad Prism软件作图和统计,以均数±标准差表示。实验均采用两独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 鉴定circ-VCAN在胶质瘤细胞系中的表达
首先分别以细胞U373的基因组DNA(gDNA)和cDNA作为模板,通过PCR技术扩增circ-VCAN包含成环位点(back spliced junction)的片段,结果表明模板为cDNA组的PCR产物出现约200 bp的目的条带,并且基因组DNA不能特异性扩增circ-VCAN(图1A)。Sanger测序结果验证了成环位点序列(图1B)。利用R NaseR消化细胞U373的RNA,qRT-PCR结果显示RNaseR处理前后,circ-VCAN表达水平无明显变化,但是线性mVCAN表达水平却显著降低(图1A,图1C,P<0.01)。
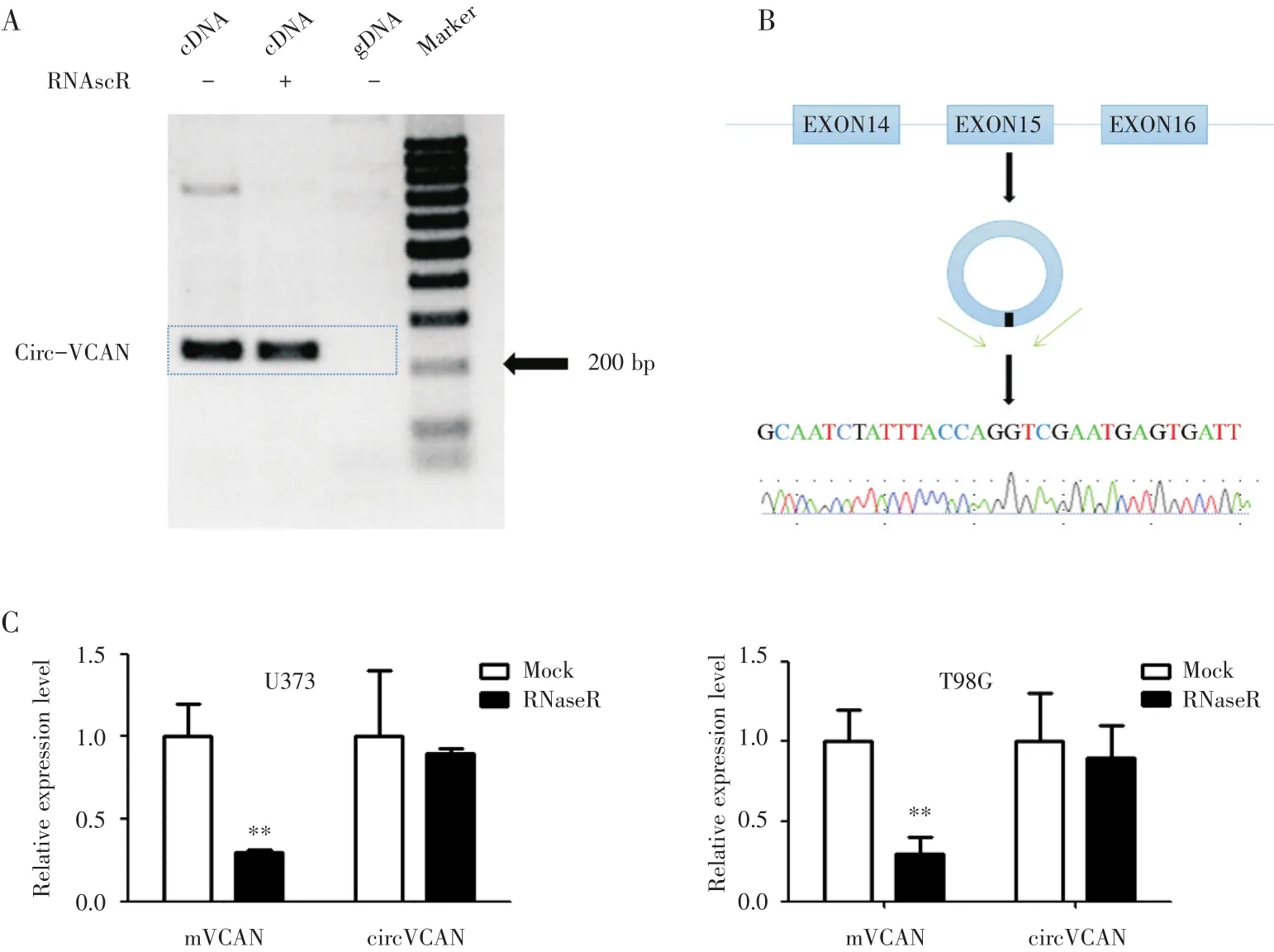
图1 Circ-VCAN在胶质瘤细胞系中的鉴定
2.2 circ-VCAN在胶质瘤细胞中高表达且主要存在细胞质中
circ-VCAN在U373和T98G中高表达,在HA1800中低表达(图2A)进一步通过细胞核质分离实验证明circ-VCAN主要存在细胞质中(图2B)。
2.3 沉默circ-VCAN抑制胶质瘤细胞系的增殖
我们订购了2条siRNA干扰circ-VCAN的表达,其中si-circVCAN-1有明显的干扰抑制效果(图3A)。干扰circ-VCAN实验组CCK8的OD450显著低于对照组(图3B,P<0.01)。
2.4 环状RNA-circ-VCAN作用可能与NF-κB信号通路有关
在U373和T98G细胞中转入si-circ-VCAN后,P-P65的表达水平降低(图4A,P<0.05)。
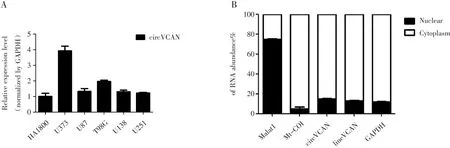
图2 circ-VCAN在胶质瘤细胞中高表达且主要存在于细胞质中
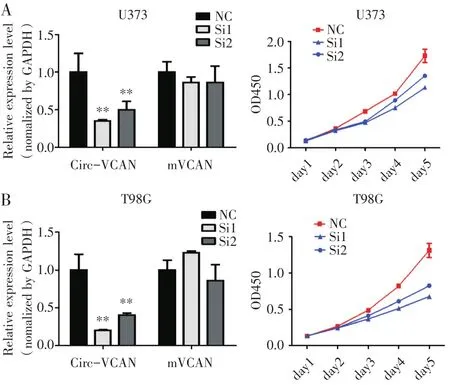
图3 沉默circ-VCAN抑制胶质瘤细胞系的增殖
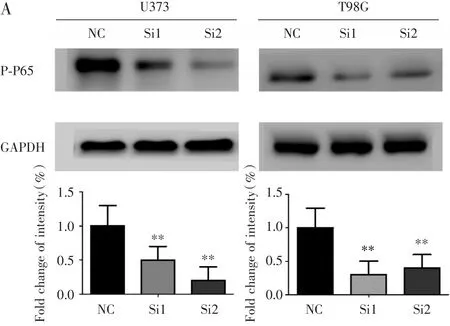
图4 环状RNA-circ-VCAN作用可能与NF-κB信号通路有关
3 讨论
越来越多的研究显示circ-RNA在疾病的发生与发展中起着重要的作用。已有文献报道circ-RNA参与胶质瘤恶性进展[11]。Circ-TTBK2在胶质瘤组织和细胞系中过度表达,其作为miR-217海绵以序列特异性方式介导神经胶质瘤恶性进展[12]。此外,cZNF292是重要的环状致癌RNA,其影响胶质瘤细胞增殖和细胞周期进程[13]。
据文献报道,circ-VCAN亲本基因能够在脑组织中表达,VCAN基因已被实验证实为胶质瘤的致病基因[14]。因此,神经胶质瘤中高度表达的VCAN衍生的circ-RNA也被认为与胶质瘤发生有关,体外研究已发现circ-VCAN在少突胶质细胞瘤和胶质母细胞瘤中均高度表达[10]。在本文中,我们主要报道了针对circ-VCAN在U373和T98G中的功能与初步的机制研究结果。研究结果证实了相对于正常胶质细胞(HA1800),胶质瘤细胞中确实高表达circ-VCAN。作为在细胞质表达量较多的circ-RNA,circ-VCAN能抵抗RNaseR的消化,而且敲低circ-VCAN的表达可以减慢胶质瘤细胞的增殖。此外,我们的研究进一步发现,在胶质瘤细胞系中,circ-VCAN在细胞的功能可能与NF-κB信号通路有关。目前大量的研究表明circ-VCAN可以与多种miRNA结合起到miRNA“海绵体”的作用,我们猜测在胶质瘤细胞系circ-VCAN是否可能通过吸附一些miRNA从而影响PP65的表达,从而影响NF-κB信号通路。已有文献报道,P-P65是一种重要的细胞生长和分化的调控因子,但是关于P-P65与circ-VACN的关系,及其随后机制探讨。
本文在实验上并未做深入探讨,这也是本文的不足之处。此外,本研究并未进一步证实circ-VCAN的调控关系是否能在活体体内实验上重复,这一点也是今后研究的重要内容。综上的结果,本研究表明circ-VCAN能够促进胶质瘤细胞的增殖,circ-VCAN可能通过调控P-P65表达是促进胶质瘤细胞的增殖的机制。在后续的研究中,深入地探讨机制可能有利于治疗胶质瘤提供新的思路。
[1] Grasso CS,Tang Y,Truffaux N,et al.Functionally defined therapeutic targets in diffuse intrinsic pontine glioma[J].Nat Med,2015,21(6):555-559.
[2] Kim H,Zheng S,Amini SS,et al.Whole-genome and multisector exome sequencing of primary and post-treatment glioblastoma reveals patterns of tumor evolution[J].Genome Res,2015,25(3):316-327.
[3] Koul D,Wang S,Wu S,et al.Preclinical therapeutic efficacy of a novel blood-brain barrier-penetrant dual PI3K/mTOR inhibitor with preferential response in PI3K/PTENmutant glioma[J].Oncotarget,2017,8(13):21741-21753.
[4] Turcan S,Rohle D,Goenka A,et al.IDH1 mutation is sufficient to establish the glioma hypermethylator phenotype[J].Nature,2012,483(7390):479-483.
[5] Lu F,Chen Y,Zhao C,et al.Olig2-dependent reciprocal shift in pdgf and egf receptor signaling regulates tumor phenotype and mitotic growth in malignant glioma[J].Cancer Cell,2016,29(5):669-683.
[6] Chinot OL,Wick W,Mason W,et al.Bevacizumab plus radiotherapy-temozolomide for newly diagnosed glioblastoma[J].N Engl JMed,2014,370(8):709-722.
[7] Zhang H,Wang G,Ding C,et al.Increased circular RNA UBAP2 acts as a sponge of miR-143 to promote osteosarcoma progression[J].Oncotarget,2017,8(37):61687-61697.
[8] Han D,Li J,Wang H,et al.Circular RNA MTO1 acts as the sponge of miR-9 to suppress hepatocellular carcinoma progression[J].Hepatology,2017,4(66):1151-1164.
[9] Zhong Z,Huang M,Lv M,et al.Circular RNA MYLK as a competing endogenous RNA promotes bladder cancer progression through modulating VEGFA/VEGFR2 signaling pathway[J].Cancer Lett,2017,403:305-317.
[10] Song X,Zhang N,Han P,et al.Circular RNA profile in gliomas revealed by identification tool UROBORUS[J].Nucleic Acids Res,2016,44(9):e87.
[11] Zhu J,Ye J,Zhang L,et al.Differential expression of circular rnas in glioblastoma multiforme and its correlation with prognosis[J].Transl Oncol,2017,10(2):271-279.
[12] Zheng J,Liu X,Xue Y,et al.TTBK2 circular RNA promotes glioma malignancy by regulating miR-217/HNF1beta/Derlin-1 pathway[J].JHematol Oncol,2017,10(1):52.
[13] Yang P,Qiu Z,Jiang Y,et al.Silencing of cZNF292 circular RNA suppresses human glioma tube formation via the Wnt/beta-catenin signaling pathway[J].Oncotarget,2016,7(39):63449-63455.
[14] Yang W,Yee AJ.Versican V2 isoform enhances angiogenesis by regulating endothelial cell activities and fibronectin expression[J].FEBSLett,2013,587(2):185-192.

