Piwil2调控宫颈癌细胞恶性生物学行为的机制探讨
冯定庆,闫克芹,张 筱,邓 琳,凌 斌
中日友好医院妇产科,北京 100029
Piwil2属于PIWI/AGO家族,位于人类第8号染色体,在胚胎干细胞(embryonic stem cells,ESCs)和生殖干细胞(germline stem cells,GSCs)中广泛表达,对干细胞自我更新和分化具有重要的调控作用[1-2]。出生后的正常个体,Piwil2仅表达于睾丸生精细胞,其他组织均未见表达,而在各种肿瘤组织和肿瘤细胞系可见Piwil2重新表达,被认为是一种新的肿瘤睾丸抗原(cancer-testis antigen,CAT)[3-5]。我们的前期研究结果显示,在正常宫颈组织和宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)1病变中未见Piwil2,CIN2-3病变及宫颈癌组织中重现Piwil2表达[2],并且Piwil2是宫颈癌干细胞一个重要的分子标志[6]。进一步的研究证实,Piwil2通过表观遗传途径促进转录因子c-myc、nanog、sox2和oct4表达而启动细胞重编程[2]。然而,Piwil2表达与宫颈癌恶性生物学行为及肿瘤进展之间的关系,目前尚不清楚。
本研究试图通过在宫颈癌细胞HeLa和SiHa中分别沉默和过表达Piwil2,观察细胞恶性生物学特性的改变,并深入探讨其可能的分子机制,以期进一步完善宫颈癌的发病机制,并为宫颈癌的治疗寻找新的靶点。
1 材料和方法
1.1 主要试剂
高糖DMEM、RPMI-1640、胎牛血清(fetal calf serum,FCS)、TRIzol试剂盒、LipofectamineTM3000、蛋白酶抑制剂混合物、BCA蛋白定量试剂盒和ECL显色试剂盒均购自美国ThermoFisher公司,碘化吡啶(propidium iodide,PI)、RNase A、Hoechst 33342、嘌呤霉素和维拉帕米(verapamil)购自美国Sigma公司,慢病毒载体pLenti-CMV-Piwil2-SV40-EGFP、对照病毒pLenti-EGFP购自上海吉凯基因化学技术有限公司,shPiwil2质粒(TG302470)、随机序列shRNA质粒(TR30013)购自美国OriGene公司,Random Primer、反转录酶和PCR试剂盒Premix Taq均购自宝日医生物技术(北京)有限公司,顺铂(规格20 mL:20 mg)由南京制药厂有限公司提供,CCK-8试剂盒购自东仁化学科技(上海)有限公司,Stat3(#9132)、p-Stat3(#9145)和GAPDH(#2118)一抗购自美国Cell Signaling公司,Piwil2(ab85084)一抗购自美国Abcam公司,P53(BM0102)和cyclin D1(BA0770)一抗购自武汉博士德生物工程有限公司,所有二抗均购自美国Santa Cruz Biotechnology公司。
1.2 细胞培养及转染
宫颈癌细胞株HeLa和SiHa购自美国模式培养物保藏所(American Type Culture Collection,ATCC),高糖DMEM(含10%FCS、100 U/mL青霉素和 100 μg/mL链霉素)、于37 ℃、CO2体积分数为5%的饱和湿度条件下培养。① 过表达Piwil2:收集对数生长期细胞,1×104个细胞接种6孔板,6 h后细胞贴壁,过表达Piwil2组细胞转染pLenti-CMV-Piwil2-SV40-EGFP,对照组细胞转染pLenti-EGFP;② 沉默Piwil2表达:收集对数生长期细胞,5×103个细胞接种96孔板;第2天,采用LipofectamineTM3000转染shPiwil2质粒,对照组转染随机序列shRNA质粒,1 μg/ mL嘌呤霉素压力筛选获得稳定转染细胞;荧光观察、反转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)及蛋白[质]印迹法(Western blot)检测转染效果。前期实验结果证实[2],对照病毒pLenti-EGFP和随机序列shRNA质粒转染对Piwil2表达及细胞生物学特性均无显著影响,故将转染前的HeLa和SiHa细胞作为相应的统一对照。
1.3 反转录及PCR
收集对数生长期细胞,经TRIzol充分裂解后提取总RNA并定量,取2 μg总RNA作为模板,按照反转录酶说明书操作获得cDNA;取1 μL cDNA、上下游引物各1 μL、Premix Taq 12.5 μL、去离子水补足反应体系至25 μL,PCR扩增条件:94 ℃解链1 min,94 ℃ 30 s、56 ℃30 s、72 ℃ 45 s,共34个循环;扩增结束,取PCR产物进行琼脂糖凝胶电泳、观察结果。其中,PCR引物由宝日医生物技术(北京)有限公司合成,引物序列见表1。
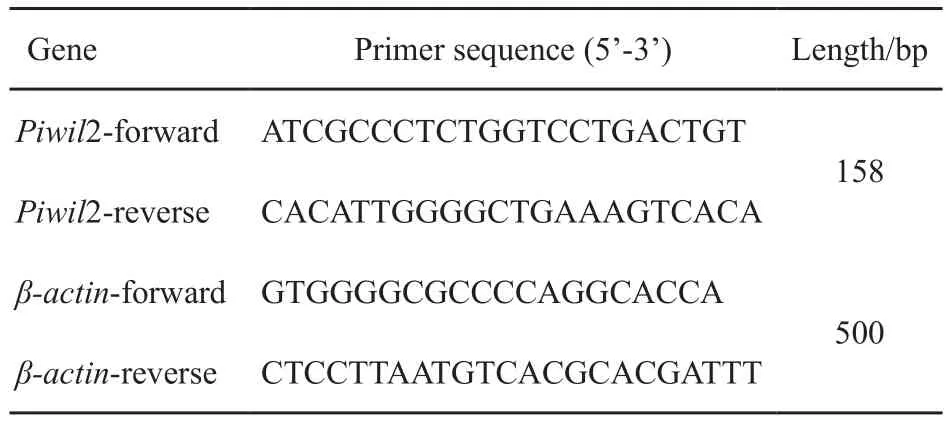
表 1 PCR引物序列Tab. 1 PCR primer sequence
1.4 细胞增殖的检测
收集对数生长期HeLa和SiHa细胞,每100 μL 2×103个细胞接种于96孔板,分别于接种后24、48、72和96 h向各孔内加入10 μL CCK-8溶液,37 ℃继续培养4 h,振荡混匀(不可产生气泡),酶标仪上读取450 nm处吸光度(D)值。实验重复3次。
1.5 细胞周期检测
收集对数生长期细胞,将1×106个细胞加入预冷70%乙醇1 mL,于-20 ℃温度下固定过夜。预冷1×PBS洗涤细胞2次,15 000×g离心5 min,弃上清液。50 μg/ mL PI(含250 μg/mL RNase A,0.02% Triton X-100)500 μL重悬细胞,室温避光染色30 min,并采用流式细胞术(fluorescent-activated cell sorting,FACS)进行检测。
1.6 侧群(side polulation,SP)细胞检测
肿瘤组织中的SP细胞具有肿瘤干细胞(cancer stem cells,CSCs)特性,通过细胞膜上ABC转运蛋白将荧光染料Hoechst 33342外排而发生拒染,维拉帕米则可阻断ABC转运蛋白的功能;SP细胞与肿瘤发生、发展、耐药及转移密切相关[7]。为探讨Piwil2表达对宫颈癌细胞中SP细胞比例的影响,分别收集HeLa、SiHa及相应沉默和过表达Piwil2细胞,每组细胞分为2份,含2%FCS RPMI-1640重悬细胞,调整细胞密度为1×106个/mL。加入终浓度为5 μg/ mL Hoechst 33342,其中一份细胞同时加入100 mmol/L维拉帕米,37 ℃避光水浴90 min(期间,每隔15 min轻微振荡数秒)。冰上10 min终止染色,含2%FCS预冷的RPMI-1640洗涤、重悬细胞,FACS检测前加入终浓度为2 μg/mL PI。355 nm UV激发光,610 nm双色短通反射滤镜,450和675 nm下分别检测蓝光和红光,分析SP细胞比例。
1.7 Western blot检测蛋白表达
1%NP40(含蛋白酶抑制剂和PMSF)裂解细胞提取总蛋白,取40 μg蛋白上样,10%SDS-PAGE分离,15 V 20 min半干转至PVDF膜。5%脱脂奶封闭2 h,一抗4℃温育过夜,TBST洗涤后加入对应二抗,室温温育2 h,TBST洗涤、ECL显色、凝胶成像系统分析结果。
1.8 顺铂敏感性检测
收集对数生长期细胞,1×104个细胞接种96孔板,6 h后分别加入连续梯度浓度的顺铂(0~24 μg/mL),48 h后采用CCK-8试剂盒检测细胞存活率,绘制顺铂杀伤曲线,比较HeLa和SiHa细胞过表达/沉默Piwil2基因后对顺铂的敏感性变化。
1.9 统计学处理
2 结 果
2.1 Piwil2促进宫颈癌细胞增殖
HeLa和SiHa细胞转染慢病毒载体pLenti-CMV-Piwil2-SV40-EGFP,48 h后荧光显微镜下可见EGFP表达,转染效率达90%以上;宫颈癌细胞转染shPiwil2质粒,采用1 μg/mL嘌呤霉素持续压力筛选2周后,可以获得稳定转染细胞;RT-PCR和Western blot结果显示,在HeLa和SiHa细胞Piwil2过表达和沉默效果均良好(图1A、B)。细胞增殖实验结果显示,过表达Piwil2显著促进宫颈癌细胞增殖,与对照组比较差异有统计学意义(P<0.01);而沉默Piwil2基因后,与对照组细胞相比,细胞增殖则被显著抑制(P<0.01,图1C、D)。

图 1 过表达和沉默Piwil2基因对宫颈癌细胞增殖能力的影响Fig. 1 The over-expression and silencing of Piwil2 gene affected cervical cancer cell lines proliferation
2.2 Piwil2影响宫颈癌细胞周期
细胞周期检测结果显示,HeLa细胞G0/ G1期、S期和G2/M期细胞比例平均分别为58.92%、37.58%和3.50%,过表达Piwil2后,G0/ G1期细胞比例(47.09%)显著减少,S期和G2/M期细胞比例(45.64%和7.27%)显著增加,与对照组比较差异均有统计学意义(P<0.01,P<0.05);沉默Piwil2基因后,则G0/G1期细胞比例(66.84%)显著增加,沉默前后差异有统计学意义(P<0.01)。SiHa细胞过表达和沉默Piwil2基因后,G0/G1期、S期和G2/M期细胞比例变化趋势与HeLa细胞一致。结果表明,Piwil2加快了宫颈癌细胞周期,促进细胞增殖,沉默Piwil2基因则使细胞发生细胞周期阻滞(图2)。
2.3 细胞周期相关调控蛋白的表达
进一步分析Piwil2促进宫颈癌细胞增殖的分子机制,Western blot结果显示,宫颈癌细胞过表达Piwil2后,Stat3磷酸化水平增加,细胞周期调控蛋白cyclin D1表达增加,P53的表达水平则显著降低;沉默Piwil2基因表达,则结果相反。过表达和沉默Piwil2基因前后,Stat3表达无显著变化(图3)。
2.4 Piwil2上调宫颈癌细胞中SP细胞比例
FACS结果显示,HeLa和SiHa细胞SP细胞比例分别为3.01±0.30和2.07±0.21,过表达Piwil2后,SP细胞比例均显著增加(6.28±0.52和4.20±0.50),而沉默Piwil2基因表达则显著降低了SP细胞比例(1.03±0.20和1.14±0.31),与对照组细胞比较差异均有统计学意义(P<0.01,图4)。
2.5 Piwil2促进宫颈癌细胞耐药
HeLa细胞及其沉默、过表达Piwil2基因后,顺铂对它们的半数致死量(median lethal dose,LD50)分别为4.78、3.52和8.97 μg/mL,与对照组比较差异均有统计学意义(P<0.05和P<0.01,图5A)。SiHa细胞及沉默、过表达Piwil2基因后,顺铂LD50值分别为10.21、6.06和18.64 μg/mL,与对照组比较差异均有统计学意义(P<0.01,图5B)。
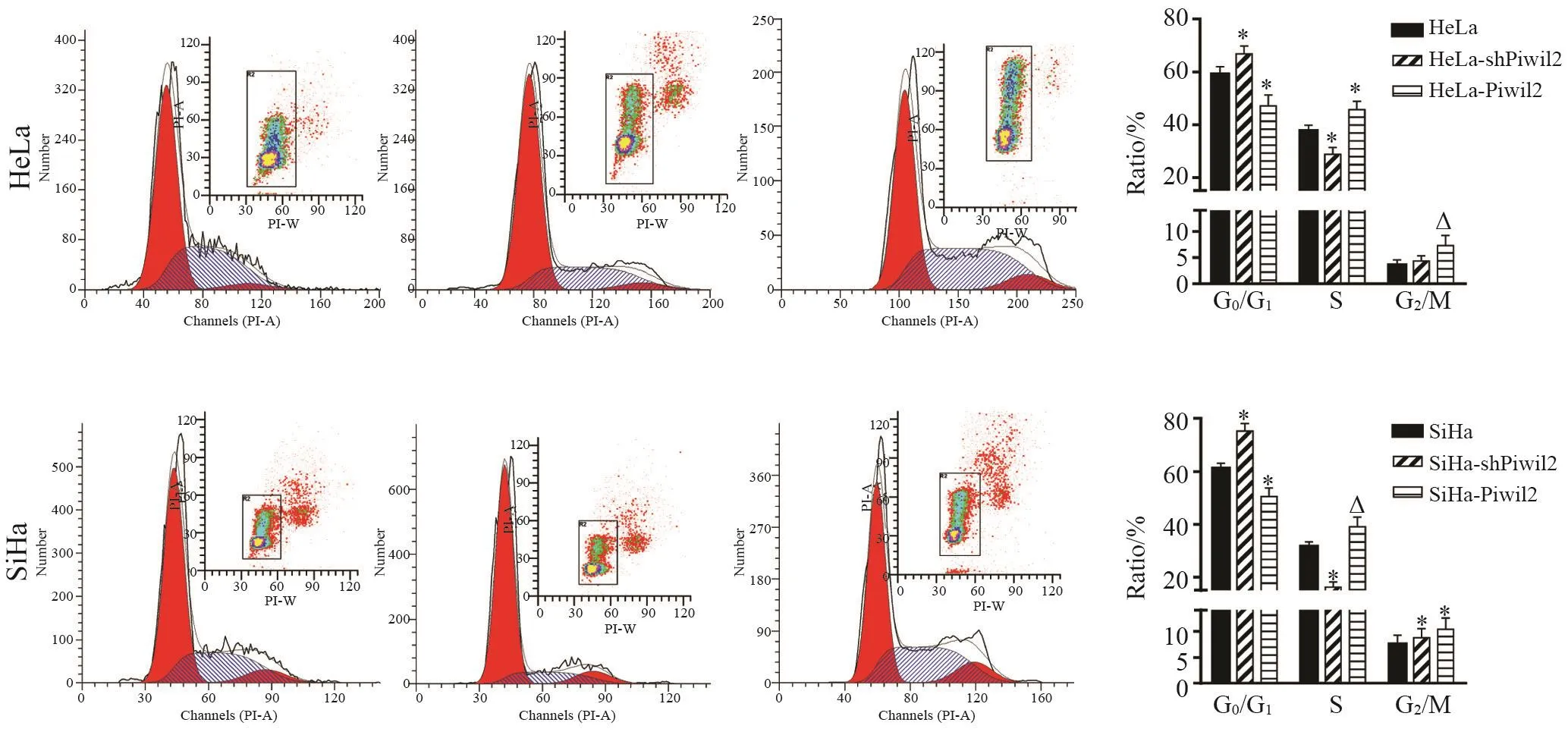
图 2 FACS检测HeLa和SiHa细胞过表达或沉默Piwil2后细胞周期变化Fig. 2 The cell cycle of HeLa and SiHa was analyzed by FACS
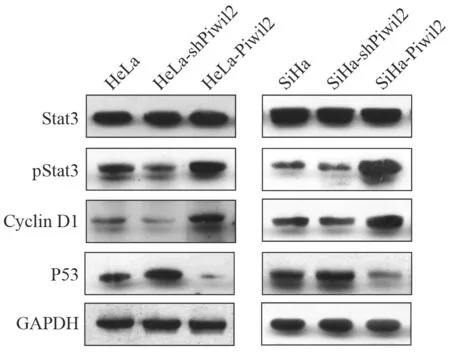
图 3 Westorn blot检测pStat3、cyclin D1和P53的表达Fig. 3 The expression levels of pStat3, cyclin D1 and P53 measured by Western blot
3 讨 论
Piwil2正常表达于ESCs和GSCs,而作为一种CAT,在肿瘤组织和肿瘤细胞系中的表达主要在其中的癌前干细胞(precancerous stem cells,pCSCs)和CSCs群体中,Piwil2已经被认为是pCSCs/CSCs特异标志物之一[2,6,8-9]。我们前期的研究发现,高危型HPV致癌蛋白E6/E7能够重启Piwil2表达,继而通过表观遗传途径使体细胞发生重编程,促进肿瘤起始细胞(tumor-initiating cells,TICs)形成,在宫颈癌发生中起重要作用[2]。本实验的结果显示,HeLa和SiHa细胞过表达Piwil2后,群体中SP细胞比例显著增加,而沉默Piwil2基因则显著降低SP细胞比例,再一次验证了前期的研究结果。肿瘤干细胞是肿瘤发生、进展、转移、耐药和复发的根源,宫颈癌的进展程度与Piwil2表达水平密切相关。
Piwil2具有强大的基因表达调控功能,通过piRNA结合目标mRNA,Piwil2可发挥核酸内切酶的功能降解mRNA[1,10];Piwil2还可以募集HP1、组蛋白甲基转移酶等,通过表观遗传修饰途径调控基因表达[11-13];Piwil2还可以与微核糖核蛋白粒子(micro ribonucleoprotein particle,miRNP)结合,发挥转录后调控作用[13]。宫颈癌细胞过表达Piwil2后,p53蛋白水平显著降低,cyclin D1表达上调,并且Stat3的磷酸化水平也显著增加,沉默Piwil2基因则效果相反。p53、cyclin D1、pStat3参与调控细胞周期,与细胞增殖密切相关[14-16]。这些基因表达的改变,正好是Piwil2调控细胞增殖及细胞周期变化的分子基础。我们的实验结果显示,过表达Piwil2促进宫颈癌细胞增殖,显著增加S期和G2/M期细胞比例,沉默Piwil2基因则引起细胞脱离细胞周期、阻滞于G0/G1期、从而抑制宫颈癌细胞增殖。
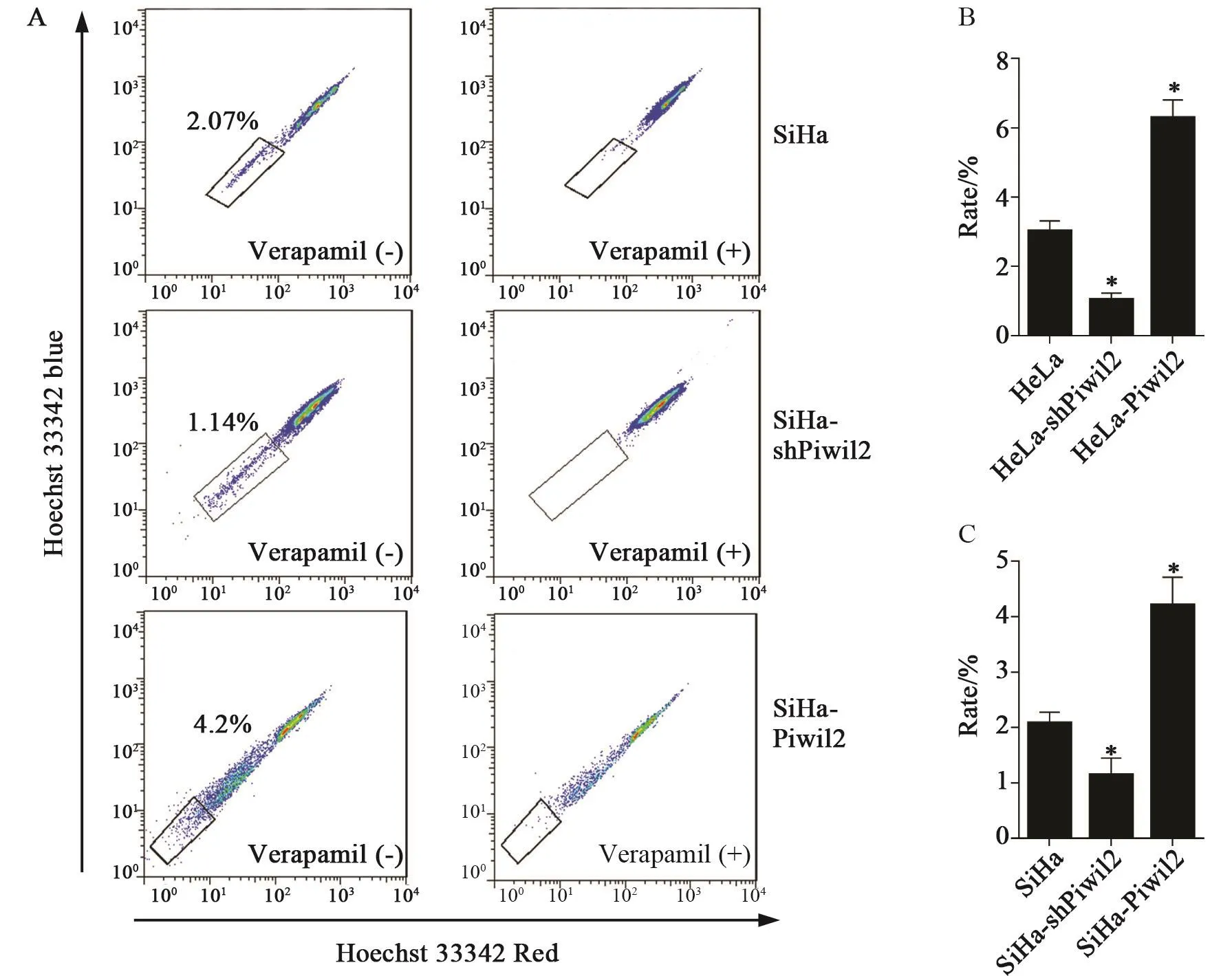
图 4 FACS检测Piwil2表达对HeLa和SiHa细胞中SP细胞比例的影响Fig. 4 Identification of SP cells and analyses the proportion with FACS

图 5 Piwil2对HeLa和SiHa细胞顺铂杀伤敏感性的影响Fig. 5 Piwil2 affected the sensitivity of HeLa and SiHa cells to cisplatin
另外,化疗药物杀伤实验结果显示,Piwil2还可以引起HeLa和SiHa细胞对顺铂敏感性降低,促进化疗药物抵抗。分析原因,可能与Piwil2促进SP细胞转化,提高了SP细胞比例有关,以及与Piwil2显著提高肿瘤细胞增殖活性、抑制细胞凋亡、上调耐药基因表达等因素有一定关系[2,6,17]。相反,沉默Piwil2基因则显著降低肿瘤细胞LD50值,显著提升顺铂的杀伤效率。
因此,Piwil2的表达在宫颈癌的发生、进展及耐药中发挥重要作用,Piwil2有望成为一个潜在的宫颈癌治疗靶点。
[1] SONG J J, SMITH S K, HANNON G J, et al. Crystal structure of argonaute and its implications for RISC slicer activity[J].Science, 2004, 305(5689): 1434-1437.
[2] FENG D, YAN K, ZHOU Y, et al. Piwil2 is reactivated by HPV oncoproteins and initiates cell reprogramming via epigenetic regulation during cervical cancer tumorigenesis[J]. Oncotarget, 2016, 7(40): 64575-64588.
[3] YANG P, HUO Z, LIAO H, et al. Cancer/testis antigens trigger epithelial-mesenchymal transition and genesis of cancer stem-like cells[J]. Curr Pharm Des, 2015, 21(10): 1292-300.
[4] YAZARLOO F, SHIRKOOHI R, MOBASHERI M B, et al.Expression analysis of four testis-specific genes AURKC,OIP5, PIWIL2 and TAF7L in acute myeloid leukemia: a gender-dependent expression pattern[J]. Med Oncol, 2013,30(1): 368.
[5] LEE J H, SCHÜTTE D, WULF G, et al. Stem-cell protein Piwil2 is widely expressed in tumors and inhibits apoptosis through activation of Stat3/Bcl-XL pathway[J]. Hum Mol Genet, 2006, 15(2): 201-211.
[6] FENG D, PENG C, LI C, et al. Identification and characterization of cancer stem-like cells from primary carcinoma of the cervix uteri[J]. Oncol Rep, 2009, 22(5):1129-1134.
[7] ORECCHIONI S, BERTOLINI F. Characterization of cancer stem cells[J]. Methods Mol Biol, 2016, 1464: 49-62.
[8] WANG X, JIANG C, FU B, et al. MILI, a PIWI family protein,inhibits melanoma cell migration through methylation of LINE1[J]. Biochem Biophys Res Commun, 2015, 457(4):514-519.
[9] GAO J X. Cancer stem cells: the lessons from pre-cancerous stem cells[J]. J Cell Mol Med, 2008, 12(1): 67-96.
[10] PLEŠTILOVÁ L, NEIDHART M, RUSSO G, et al. Expression and regulation of PIWIL-proteins and PIWI-interacting RNAs in rheumatoid arthritis[J]. PLoS One, 2016, 11(11):e0166920.
[11] SIMMONS M J, PETERSON M P, THORP M W, et al.piRNA-mediated transposon regulation and the germ-line mutation rate in Drosophila melanogaster males[J]. Mutat Res, 2015, 773: 16-21.
[12] KLATTENHOFF C, XI H, LI C, et al. The Drosophila HP1 homolog Rhino is required for transposon silencing and piRNA production by dual-strand clusters[J]. Cell, 2009, 138(6):1137-1149.
[13] LINGEL A, SATTLER M. Novel modes of protein-RNA recognition in the RNAi pathway[J]. Curr Opin Struct Biol,2005, 15(1): 107-115.
[14] ESCOLL M, GARGINI R, CUADRADO A, et al. Mutant p53 oncogenic functions in cancer stem cells are regulated by WIP through YAP/TAZ[J]. Oncogene, 2017, 36(25): 3515-3527.
[15] QU K, WANG Z, FAN H, et al. MCM7 promotes cancer progression through cyclin D1-dependent signaling and serves as a prognostic marker for patients with hepatocellular carcinoma[J]. Cell Death Dis, 2017, 8(2): e2603.
[16] ESKANDARI E, HEIDARIAN E, AMINI S A, et al.Evaluating the effects of ellagic acid on pSTAT3, pAKT, and pERK1/2 signaling pathways in prostate cancer PC3 cells[J]. J Cancer Res Ther, 2016, 12(4): 1266-1271.
[17] TIAN X, FAN J, HOU W, et al. Sodium orthovanadate induces the apoptosis of SH-SY5Y cells by inhibiting PIWIL2[J].Mol Med Rep, 2016, 13(1): 874-880.

