Bacillus altitudinis SYBC hb4碱性β-葡萄糖苷酶基因的克隆表达及酶学性质的研究
刘 群 , 管政兵 , 蔡宇杰 , 廖祥儒 *
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122)
纤维素是自然界含量最多、分布最广的一种多糖,也是天然的可再生能源物质,在医药、食品、工业、农业中有着重要的作用。纤维素酶是降解纤维素形成葡萄糖的一组复合酶的总称,主要包括由外切β-葡聚糖酶、内切β-葡聚糖酶和β-葡萄糖苷酶等组成。其中,β-葡萄糖苷酶 (β-glucosidase,EC3.2.1.21)又称β-D-葡萄糖苷水解酶,是一种能催化水解β-葡萄糖苷键生成葡萄糖的酶,是纤维素酶系中一类重要的酶[1]。纤维素酶在外切β-葡聚糖酶、内切β-葡聚糖酶作用下水解成纤维二糖,纤维二糖在β-葡萄糖苷酶的作用下水解为葡萄糖[2]。β-葡萄糖苷酶的研究可以追溯到1837年,Liebig等[3]首次在苦杏仁汁中发现了该酶。纤维素酶的最适pH值一般在4.5~6.5,少数在偏碱性pH范围内发挥作用的纤维素酶称为碱性纤维素酶。随着现代工业的不断发展,对碱性纤维素酶的需求量越来越大,它主要应用于洗涤行业[4-6]、造纸行业、纺织行业以及医药食品当中。
上世纪70年代初日本生物学家从芽孢杆菌中首先发现碱性纤维素酶[7],随着分子生物学技术的发展,越来越多的碱性纤维素酶基因被发现,包括碱性β-葡萄糖苷酶。由于植物来源的β-葡萄糖苷酶酶活比微生物来源的低的多,所以目前研究的对象主要集中于微生物中[8]。微生物来源的碱性β-葡萄糖苷酶可以应用于纺织行业,因为β-葡萄糖苷酶在碱性条件下时更有利于形成聚合物[9]。近年来的研究还发现碱性β-葡萄糖苷酶在微生物循环、生产工业燃料、减少工业生产中的环境污染等方面有重大应用。Meng等[10-11]发现海洋微生物中能产生耐碱性强的β-葡萄糖苷酶及β-葡聚糖酶。但目前海洋微生物在工业中的应用还有一定难度。Kaur等人[12]报道了青霉菌能产生高浓度的β-葡萄糖苷酶,并且在碱性条件下表现出明显的活性和较好的热稳定性但并未提及具体酶活大小。Mao等人[13]采用大肠杆菌E.coli BL21(DE3)进行β-葡萄糖苷酶的异源表达,所得重组酶的最适pH值为8.0,但当pH值上升到9.0时剩余酶活在不到40%,且在碱性条件下稳定性较差。
1989年,Gonzalez首次将β-葡萄糖苷酶基因克隆出来并成功表达,但限于当时技术,表达活力并不高,粗酶液的酶活力只有0.364 U/mL[14]。朱宝龙[15]构建的毕赤酵母工程菌所表达的重组β-葡萄糖苷酶酶活可达38 U/mL。然而,目前国内对碱性β-葡萄糖苷酶的研究仅仅停留在探索阶段,对酶活大小以及发酵产酶水平报道较少。因此通过基因克隆技术,构建碱性β-葡萄糖苷酶的基因工程菌是当前实现碱性β-葡萄糖苷酶量产的关键步骤。
针对以上问题,作者从蜂蜜中筛选出一株来源安全并在碱性环境中生长良好的高地芽孢杆菌Bacillus altitudinis SYBC hb4,通过对该芽孢杆菌中的β-葡萄糖苷酶基因bglA克隆表达,获得了耐碱性好、热稳定较好的重组β-葡萄糖苷酶。
1 材料与方法
1.1 材料
1.1.1 样品 所用菌株是从实验室已有的蜂蜜中筛选,经生理生化实验及16S rRNA基因序列分析鉴定为芽孢杆菌属 (Bacillus),命名为 Bacillus altitudinis SYBC hb4[16]。
1.1.2 主要试剂 细菌基因组DNA提取试剂盒、质粒小量抽提试剂盒和DNA胶回收试剂盒:购自上海生工公司;对硝基苯基β-D-葡萄糖苷:购于Sigma(St.Louis,MO)公司;大肠杆菌 JM109 感受态细胞、16S rRNA基因测序引物、应用细菌基因组DNA抽提试剂盒、氨苄青霉素 (Amp)、Taq酶、pColdII载体:购自TaKaRa公司;其他常规试剂均为分析纯,购自国药集团。
1.1.3 培养基 LB液体培养基 (g/L):胰蛋白胨10,NaCl 10, 酵母粉 5;pH 7.0~7.2,115 ℃灭菌 20 min。固体培养基再额外添加2 g/dL的琼脂。
LB-Amp培养基 (g/L):LB固体培养基灭菌至40~50℃后加入Amp,终质量浓度为0.1 mg/L。
1.2 实验方法
1.2.1 芽孢杆菌Bacillus altitudinis SYBC hb4总DNA的提取 应用细菌基因组DNA抽提试剂盒按照其操作提取Bacillus altitudinis SYBC hb4菌体基因组总DNA,通过琼脂糖凝胶电泳鉴定其质量和纯度,紫外分光光度计测定其浓度。
1.2.2 β-葡萄糖苷酶基因的PCR扩增 根据芽孢杆菌Bacillus altitudinis SYBC hb4全基因组测序的序列设计上下游引物g1和g2(如表1所示)。两条引物的5’端分别含有单一的BamI和PstI(表1中下划线所示)限制性酶切位点。以上述芽孢杆菌Bacillus altitudinis SYBC hb4基因组为模板,以上述g1和g2为特异性引物,扩增出芽孢杆菌Bacillus altitudinis SYBC hb4中β-葡萄糖苷酶基因(bglA)全长编码框序列(1 419 bp)。PCR反应条件为:以基因组DNA为模板,在50 μL反应体系中,加入5 μL 10 ×ExTaqBuffer、2 μL 25 mmol/LMgCl2、4 μL 2.5 mmol/LdNTP混合物、以及20 μmol/L上下游引物各1μL、Ex Taq 酶 (Takara 公司)1 μL 及 DNA 模板 1 μL、补水至50 μL。PCR循环参数为:94℃预变性5 min,再进行30个循环 (98℃变性10 s,55℃退火30 s,72℃延伸1 min),最后于72℃延伸10 min。PCR产物用1%的琼脂糖凝胶电泳分离后,用割胶回收试剂盒回收1 419 bp的DNA条带,置4℃冰箱中保存。

表1 PCR扩增引物Table 1 Sequences of the PCR primers
1.2.3 β-葡萄糖苷酶的基因克隆与序列分析 目的片段经过割胶回收后,分别用BamHI和PstI对胶回收产物以及pColdII质粒进行双酶切。双酶切产物经纯化后,将pColdII质粒与目的基因片段16℃连接过夜。将20 μL的连接产物转化至E.coli DH5α感受态细胞中,在含有Amp的平板上筛选,进行菌落PCR验证。经BamHI和PstI双酶切验证阳性质粒,并由上海尼桑生物科技有限公司完成测序。将测序正确的重组质粒转化至E.coli BL21(DE3)感受态细胞中。
以bglA基因为模板,用NCBI数据库中Blast在线工具进行序列同源性分析。
1.2.4 重组大肠杆菌的诱导表达 按体积分数1%的接种量将培养过夜重组大肠杆菌接种于50 mL含有Amp的LB培养基中,置于37℃、转速220 r/min培养至OD600值约为0.4,15℃静置30 min,添加IPTG到终浓度0.5 mmol/L培养约24 h。培养完成后收集细胞,超声破碎,破碎液4℃、8 000 r/min离心20 min,收集上清液即粗酶液,测定酶活验证有无活性,进一步SDS-PAGE验证相对分子质量大小。
1.2.5 酶活测定方法 取0.5 mL粗酶液,加入0.5 mL 30 mmol/L对硝基苯基-β-D-葡萄糖苷。将此反应混合液在60℃水浴锅反应1 h。反应结束后,立即加入2.5 mL 1 mol/L的Na2CO3终止液终止反应,冷却至室温后在400 nm波长处测定吸光值。另外,取相同条件下粗酶液在沸水中煮沸5 min后再加入底物中,混合反应液在60℃水浴锅反应1 h,作为空白对照组。
酶活力单位定义:1 mL酶液每分钟释放出1 μmol对硝基苯酚的酶量定义为一个酶活力单位[17]。
1.2.6 重组β-葡萄糖苷酶的分离纯化 将重组菌体经破碎离心后,收集的上清液过孔径0.22 μm的滤膜,选择使用1 mL HisTrap HP组氨酸标签亲和层析柱 (镍柱)进行分离纯化。纯化开始时先用Blinding buffer(2 mmol/L磷酸钠缓冲液,0.5 mol/L NaCl,500 mmol/L咪唑)梯度洗脱结合上的蛋白质,收集穿透液以及洗脱峰的蛋白质。测定有无酶活,进一步SDS-PAGE蛋白质条带是否单一,分析分离纯化情况。
1.2.7 重组β-葡萄糖苷酶酶学性质的研究 以对硝基苯基-β-D-葡萄糖苷为底物,与不同pH的缓冲液在60℃下水浴反应1 h,测定酶活,确定重组β-葡萄糖苷酶的最适反应pH。然后在最适pH下值在, 在 30、40、50、60、70、80、90 ℃下水浴反应 1 h,测定酶活,确定重组β-葡萄糖苷酶的最适反应温度。以反应液的最高酶活为100%计算相对酶活。
以对硝基苯基-β-D-葡萄糖苷为底物研究重组β-葡萄糖苷酶的热稳定性和pH稳定性。用pH值为7.0的酶液在60℃水浴保温不同时间后测定酶活,并以该条件下未经保温处理的酶液酶活为100%,计算相对酶活。作出酶活在60℃时随时间的变化曲线。将相同量的酶液分别在不同pH值(pH 3.0~8.0磷酸氢二钠-柠檬酸缓冲液,pH 8.0~9.0磷酸氢二钠-磷酸二氢钾缓冲液,pH 9.0~10.0碳酸钠-碳酸氢钠)下30℃水浴保温1 h后于60℃测定剩余酶活。以各自的初始酶活作为100%,计算相对酶活。
1.2.8 金属离子对重组β-葡萄糖苷酶酶活的影响将相同量的酶液加入到终浓度为0.5 mmol/L和5 mmol/L的不同金属离子溶液中,以对硝基苯基-β-D-葡萄糖苷为底物测定酶活,以未经任何处理的酶液的酶活为100%,计算相对酶活。比较不同浓度不同金属离子对重组β-葡萄糖苷酶酶活的影响
2 结果与讨论
2.1 β-葡萄糖苷酶基因的克隆、鉴定及表达载体的构建
2.1.1 基因bglA序列聚类分析 利用NCBI数据库,以bglA基因的核苷酸序列为模板利用Blast在线工具序列对比进行同源性分析,结果显示,其核苷酸序列与NCBI数据库中已知的β-葡萄糖苷酶Bacillus pumilus W3同源性达98%。
2.1.2 β-葡萄糖苷酶基因的PCR扩增 根据bglA的基因序列,设计了上下游引物。通过PCR扩增的方法以芽孢杆菌Bacillus altitudinis SYBC hb4的全基因组DNA为模板进行扩增。PCR产物经核酸电泳验证得到大小1 419 bp的目的片段(图1)。将片段测序后,测序结果表明扩增得到了β-葡萄糖苷酶基因片段。

图1 Bacillus sp.SYBC hb4的bglA基因的PCR扩增Fig.1 Amplification of bglA of Bacillus sp.SYBC hb4 by PCR
2.1.3 重组质粒的构建 用BamHI和PstI将PCR回收的目的片段进行双酶切然后与经过相同限制性内切酶双酶切过的质粒pColdII 16℃连接过夜。将连接产物转化到感受态细胞E.coli DH5α中,挑选阳性克隆的转化子并提取质粒就行双酶切验证(图2)。所得重组质粒pColdII-bglA(图3)经测序结果与目的基因的碱基序列一致,重组质粒构建成功。

图2 重组质粒pColdⅡ-bglA的酶切验证Fig.2 Identification of recombinant plasmid pColdⅡ-bglA

图3 重组质粒pColdⅡ-bglA图谱Fig.3 Map of recombinant plasmid pColdⅡ-bglA
2.2 重组质粒在大肠杆菌中的诱导表达及分离纯化
2.2.1 重组质粒的诱导表达 将测序正确的重组质粒 pColdII-bglA转化至 E.coli BL21(DE3)感受态细胞中,将呈阳性克隆的重组菌保存后按照1.2.4中的方法加IPTG低温诱导表达,培养24 h后收集菌体进行超声破碎,破碎后低温离心收集上清液即粗酶液测定酶活和SDS-PAGE验证蛋白质相对分子质量大小。通过软件计算bglA的蛋白质大小为53.92×103,以不加IPTG诱导为对照,如图4可以看出SDS-PAGE电泳结果表明,在相对分子量53×103附近出现了明显的蛋白质表达条带。
2.2.2 重组蛋白bglA的分离纯化 粗酶液使用1 mL HisTrap HP组氨酸标签亲和层析柱(镍柱)进行分离纯化,纯化结果如图5所示。本实验中所选用的质粒pColdII带有组氨酸标签,经镍柱纯化的蛋白质,具有组氨酸标签的蛋白质可以跟镍结合,不带有组氨酸标签的杂蛋白质被去除,得到的蛋白质相对较纯。经镍柱纯化后重组β-葡萄糖苷酶经SDS-PAGE验证后,通过图5可以看出,与粗酶液相比,纯化后的蛋白质在53×103处有一条明显的单一条带,但是也有几条杂带,说明纯化后蛋白质还需进一步纯化。各步纯化结果如表2所示,最后所得蛋白质的纯化倍数为2.70,回收率达到85.32%。

图4 重组表达bglA蛋白的SDS-PAGE分析Fig.4 SDS-PAGE anslysis of the recombinant bglA
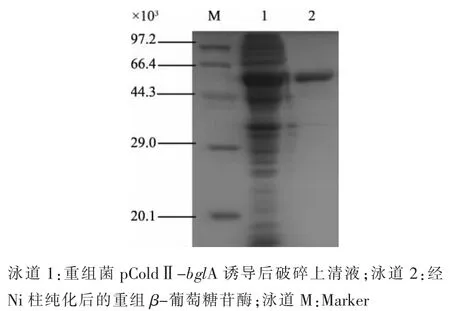
图5 纯化后重组β-葡萄糖苷酶的SDS-PAGE结果Fig.5 SDS-PAGE anslysis of the purified recombinant β-glucosidase

表2 重组β-葡萄糖苷酶的分离纯化水平Table 2 Level of recombinant β-glucosidase be purified
2.3 重组β-葡萄糖苷酶酶学性质的研究
2.3.1 重组β-葡萄糖苷酶的最适反应温度及热稳定性的研究 以对硝基苯基-β-D-葡萄糖苷为底物,研究不同温度对底物反应的影响,从而找到酶的最适反应温度。如图6(a)可以看出重组的β-葡萄糖苷酶的最适反应温度为60℃,在该温度下酶活最高。当温度过低时,底物分子的运动速率较慢,其与酶的结合率低,所以在较低的温度下酶活比较低;当温度过高时,蛋白容易变性,酶比较容易失去活性,因此温度过高,酶活也不高。
将重组β-葡萄糖苷酶在pH 7.0、温度60℃时水浴保温不同时间测定剩余酶活,考察重组β-葡萄糖苷酶的温度稳定性。如图6(b)所示,随着时间的增加,酶活越来越低,重组β-葡萄糖苷酶的半衰期大约在150 min,在保温300 min后仍然有10%的剩余酶活,说明该重组β-葡萄糖苷酶有较好的温度稳定性。目前报道的大肠杆菌重组β-葡萄糖苷酶温度稳定性一般都比较好,如Wolosowska所表达重组β-葡萄糖苷酶在80℃保温5 h后剩余酶活仍高达67%[18]。

图6 温度对重组β-葡萄糖苷酶活性和稳定性的影响Fig.6 Effect of temperatureon the activityand stability of recombinant β-glucosidase
2.3.2 重组β-葡萄糖苷酶的最适反应pH及pH稳定性的研究 酶促反应对pH值的要求很高,不同的pH值对底物与酶的结合率有很大影响,它既影响着底物的解离状态,又影响酶分子尤其是活性中心的解离状态。本实验中研究了不同pH对重组β-葡萄糖苷酶的影响,如图7(a)所示,重组β-葡萄糖苷酶的最适反应pH约在pH 8.0。在偏酸性条件时,pH 3.0~5.0之间,酶活较低,说明该重组β-葡萄糖苷酶在酸性环境下较为敏感,随着酸性增强相对酶活下降较快。在pH 6.0~9.0之间时酶活力保持在40%以上,综上所示,该重组β-葡萄糖苷酶在碱性的环境下酶活力较高。
将相同酶量的酶液在不同pH条件下水浴保温1 h后,以对硝基苯基-β-D-葡萄糖苷为底物,在温度60℃、pH 8.0条件下测定重组β-葡萄糖苷酶的酶活,研究该重组β-葡萄糖苷酶在不同pH条件下的稳定性。以相对酶活作出变化曲线,如图7(b)所示,发现重组β-葡萄糖苷酶在pH 6.0~9.5之间时较为稳定,剩余酶活在70%以上。在pH 7.0、8.0、8.5、9.0、9.5缓冲液放置1 h后剩余酶活均在90%以上,pH 3.0~5.0时,剩余酶活在40%以下。说明该重组β-葡萄糖苷酶在偏酸性条件下时不太稳定,在中性偏碱性条件下时有非常好的稳定。Mao等人[13]采用大肠杆菌重组表达β-葡萄糖苷酶虽然最适pH值为8.0,但当pH值上升到9.0时,剩余酶活不到40%,且在碱性条件下稳定性较差。作者所构建工程菌表达β-葡萄糖苷酶在碱性条件下的稳定性更好。

图7 pH对重组β-葡萄糖苷酶活性和稳定性的影响Fig.7 Effectof pH on the activity and stability ofrecombinant β-glucosidase
2.3.3 离子浓度对重组β-葡萄糖苷酶酶活的影响将相同量的酶液加入到终浓度为0.5 mmol/L和5 mmol/L的不同金属离子溶液中,以对硝基苯基-β-D-葡萄糖苷为底物测定酶活。测定不同离子浓度的影响时,以不加任何金属离子的酶液为对照组。作出不同浓度不同金属离子对酶活的影响,如图8所示。结果表明,低浓度的金属离子对重组β-葡萄糖苷酶酶活力的影响并不是太大,只有Ni2+抑制了40%左右。当用5 mmol/L的金属离子处理时,Cu2+、Fe3+、Zn2+分别抑制了84%、83%和87%的酶活。Mg2+和Mn2+对酶活有促进作用,高浓度的Fe2+、Ca2+对酶活有抑制作用。不同来源的菌株所产生的β-葡萄糖苷酶,金属离子浓度对酶活的影响差异较大。如深海细菌 Martelella mediterranea[13],Cu2+和 Zn2+对酶活有强烈的抑制作用,处理后的剩余酶活不到30%,Mg2+和Mn2+对酶活有轻微的抑制作用,K+和Na+作用下可以提高酶活。

图8 金属离子对重组β-葡萄糖苷酶酶活的影响Fig.8 Effect of metal ions on the activity of recombinant β-glucosidas
3 结 语
碱性β-葡萄糖苷酶是碱性纤维素酶的重要组成部分,具有广泛的应用价值,但由于国内对其的研究报道较少,产酶水平较低,作者通过基因工程技术构建异源表达载体 E.coli BL21(DE3)/pColdII-bglA实现碱性β-葡萄糖苷酶的高效表达,经SDS-PAGE结果分析,低温诱导24 h后,重组β-葡萄糖苷酶主要以可溶性蛋白存在于破碎后的上清液中,粗酶液酶活可达到12.40 U/mL。通过对重组β-葡萄糖苷酶酶学性质的研究,结果表明该β-葡萄糖苷酶的最适反应温度为60℃,最适反应pH值 8.0, 该重组酶在 pH 7.0、8.0、8.5、9.0、9.5 缓冲液放置1 h后剩余酶活均在90%以上,实验发现Mg2+和Mn2+对酶活有促进作用,5 mmol/L的Mg2+能提高约50%的相对酶活。5 mmol/L的Fe2+、Ca2+对酶活有抑制作用。
综上所述,通过对所得重组β-葡萄糖苷酶酶学性质的研究,说明该重组β-葡萄糖苷酶在碱性条件下有较好的稳定性,具有重大研究前景。
由于此碱性β-葡萄糖苷酶的克隆表达尚属早期研究,相较目前β-葡萄糖苷酶的产酶水平,此重组碱性β-葡萄糖苷酶产量有待进一步提高。对于实现碱性β-葡萄糖苷酶在纺织业、治理环境污染等方面的应用还有待于进一步研究。
[1]WOODWARD J,WISEMAN A.Fungal and other β-D-glucosidases:their properties and applications[J].Enzyme and Microbial Technology,1982,2:73-79.
[2]KIM K H,BROWN K M,HARRIS P V,et al.Aproteomics strategy to discover beta-glucosidases from Aspergilluus fumigatus with two dimensional page in gel activity assay and tandem mass spectrometry[J].Journal of Proteome Research,2007,6(12):4749-4757.
[3]WANG Zhihong,WEIHongfu.Advance in research ofβ-D-glucosidases[J].FeedEngineering,2006,27(22):20-22.(in Chinese)
[4]GREENOUGH R J,EVERETT D J,STAVNSBJERG M.Safety evaluation of alkaline cellulase[J].Food&Chemical Toxicology An International Journal Published for the British Industrial Biological Research Association,1991,29(11):781-785.
[5]ITO S,SHIKATA S,OZAKI K,et al.Alkaline cellulase for laundry detergents:production by Bacillus sp.KSM-635 and enzymatic properties (microbiology&fermentation industry) [J].Agricultural&Biological Chemistry,1989,53 (5):1275-1281.
[6]ITO S.Alkaline cellulase from alkaliphilic Bacillus:Enzymatic properties,genetics,and application to detergents[J].Extremophiles,1997,1(2):61-66.
[7]KLINGENBERG P,KOKI Horikoshi,TERUHIKO Akiba.Alkalophilic microorganisma-a new microbial world[J].Food Nahrung,1983,27(1):54-54.
[8]LI Yuanhua.Research of β-glucosidases[J].Jourrnal of Anhui Agricultural University,2002,29(4):421-424.(in Chinese)
[9]ZHAO X,GAO L,WANG J,et al.A novel ginsenoside Rb1-hydrolyzing β-d-glucosidase from Cladosporium fulvum[J].Process Biochemistry,2009,44(3):612-618.
[10]MENG X,SHAO Z,HONG Y,et al.A Novel pH-Stable,Bifunctional Xylanase Isolated from a Deep-SeaMicroorganism,Demequina sp.JK4[J].Journal of Microbiology&Biotechnology,2009,19(10):1077-1084.
[11]LIN L,MENG X,LIU P,et al.Improved catalytic efficiency of Endo-β-1,4-glucanase from Bacillus subtilis BME-15 by directed evolution[J].Applied Microbiology&Biotechnology,2009,82(4):671-679.
[12]AMANDEEP K,CHADHA B S.Penicillium janthinellum:a source of efficient and high levels of β-glucosidase[J].Applied Biochemistry&Biotechnology,2015,175(2):937-949.
[13]MAO X X,HONG Y Z,SHAO Z Z,et al.A novel cold-active and alkali-stable β-glucosidase gene isolated from the marine bacterium Martelella mediterranea[J].Applied Biochemistry and Biotechnology,2010,162(8):2136-2148.
[14]GONZALEZ C L ,ARISTOY M C,POLAINA J ,et al.Cloning and characterization of two genes from Bacillus polymyxa expressing beta-glucosidase activity in Escherichia coli[J].Applied&Environmental Microbiology,1989,55(55):3173-3177.[15]ZHU Longbao,TANG Bin,TAO Yugui,et al.Cloning and secreting expression of the β-glucosidase gene from Aspergillus niger in Pichia pastoris GS115[J].Journal of Food Science and Biotechnology,2012,31(9):973-977.(in Chinese)
[16]ZHANG Y,LI X,XI R,et al.Characterization of an acid-stable catalase KatB isolated from Bacillus altitudinis SYBC hb4[J].Annals of Microbiology,2015.DOI 10.1007/s13213-015-1089-y
[17]LI Hua,GAO Li.Research advance on methods of determining β-glucosidase activity[J].Journal of Food Science and Biotechnology,2007,26(2):107-112.(in Chinese)
[18]WOLOSOWSKA S,SYNOWIECKI J.Thermostable β-glucosidase with a broad substrate specifity suitable for processing of lactose-containing products[J].Food Chemistry,2004,85(2):181-187.

