反流性食管炎与食管下段胃底病变的相关性研究
林昱,黄志豪,邱喜文,李燕君,许俊盛,陈树群
(普宁华侨医院消化内科,广东揭阳515300)
胃食管反流病(gastroesophageal reflux disease,GERD)是临床上常见的消化系疾病之一,其在中国的患病率高达5.77%[1]。本病的主要症状主要包括烧心、反流、胸骨后痛和吞咽困难等症状,不仅对患者的生活质量产生严重影响,还可损伤食管黏膜引起反流性食管炎(RE),并且可能引起Barrett食管(BE)、食管腺癌等并发症。其中BE是指食管下段正常的鳞状上皮被类似于胃和肠道柱状上皮所取代的一种病理变化。近年来研究发现食管腺癌的比例逐渐提高,Barrett食管一直被认为是食管腺癌的癌前病变,其食管腺癌的发生率较一般人群高出30~40倍[2]。目前,随着内镜技术的快速发展,GERD诊治取得了较快的进展。本研究对反流性食管炎与食管下段胃底病变相关性进行了分析,现报道如下:
1 资料与方法
1.1 一般资料选择2016年1月至2017年3月期间普宁华侨医院消化内科收治的200例胃食管反流病患者为研究对象,其中男性137例,女性63例,年龄19~78岁。排除标准:①年龄<18岁;②不符合GERD诊断标准;③排除肝硬化、消化道梗阻、消化道手术、药物性食管炎、胃胃溃疡及癌患者;④长期应用糖皮质激素、非甾体抗炎药、酗酒者。本研究经医院医学伦理委员会批准。
1.2 诊断方法
1.2.1 GERD的临床诊断采用GERD Q量表[4],以患者过去7 d的症状进行评价,其中反流、烧心的发作频率按0 d(0分)、l d(1分)、2~3 d(2分)、4~7 d(3分)计算;恶心、上腹痛的发作频率按0 d(3分)、1 d(2分)、2~3 d(1分)、4~7 d分(0分)计算;反流和烧心影响夜间睡眠的频率及额外服药频率按0 d(0分)、l d(1分)、2~3 d(2分)、4~7 d(3分)计算。患者GERD Q积分>8分者则诊断为GERD。
1.2.2 RE诊断标准与分级①采用洛杉矶世界胃肠病大会制定的RE四级标准(LA),A级:食管黏膜有黏膜破损≥1个,单个破损直径均在5 mm以下;B级:黏膜破损直径在5 mm以上,但是破损之间没有融合发生;C级:存在>2个破损,黏膜之间有融合,但未在食管壁四周环绕;D级:黏膜破损之间互相融合,范围≥食管周径的75%;②测定24 h食管内监测pH值,电极位置在食管下括约肌上5 cm处,pH<4的总时间百分率<4%。
1.2.3 BE诊断标准与分型内镜下观察胃-食管连接处以上的食管下段,在正常的粉红或苍白黏膜中有橘红色胃黏膜出现,活检病理检查存在柱状上皮。内镜分型包括环周型、岛型、舌型和混合型。
1.3 研究方法观察患者性别、年龄、是否吸烟、是否饮酒以及是否高脂饮食、是否合并肥胖等情况。其中吸烟指现在或者既往吸烟时间≥6个月,且≥5支/d;饮酒指现在或既往饮酒≥6个月,平均每天白酒(38°或以上)50 mL≥6个月;高脂饮食指高脂食物(肉和动物内脏类、奶油、油炸等)占饮食构成比例的50%或以上。肥胖则指体质量指数(BMI)≥28 kg/m2。对患者进行随访,观察GERD患者的食管胃底恶性病变发生情况。
1.4 统计学方法应用SPSS17.0统计学软件进行数据分析,计量资料以均数±标准差(±s)表示,组间均数比较采用t检验,率的比较采用χ2检验,均以P<0.05为差异有统计学意义。
2 结果
2.1 RE发病情况及分级本组200例GERD患者共检出RE患者146例,男性102例,女性44例,年龄平均(51.7±14.2)岁,其中最常见者为B级,占29%,伴有胃底癌1例,见表1。

表1 RE发病情况及内镜下分级
2.2 BE发病情况及内镜下分型本组200例GERD患者共检出BE患者54例,男性35例,女性19例,年龄平均(50.9±12.8)岁;其中伴有中重度异型增生1例,食管腺癌1例,发生率分别为1.85%和1.85%,见表2。

表2 BE发病情况及内镜下分型
2.3 RE与BE一般情况比较RE组与BE组患者的年龄、性别及高脂饮食的比例比较,差异均无统计学意义(P>0.05)。但是BE组患者的吸烟、饮酒及肥胖的比例均明显高于RE组,差异均有统计学意义(P<0.05),见表3。
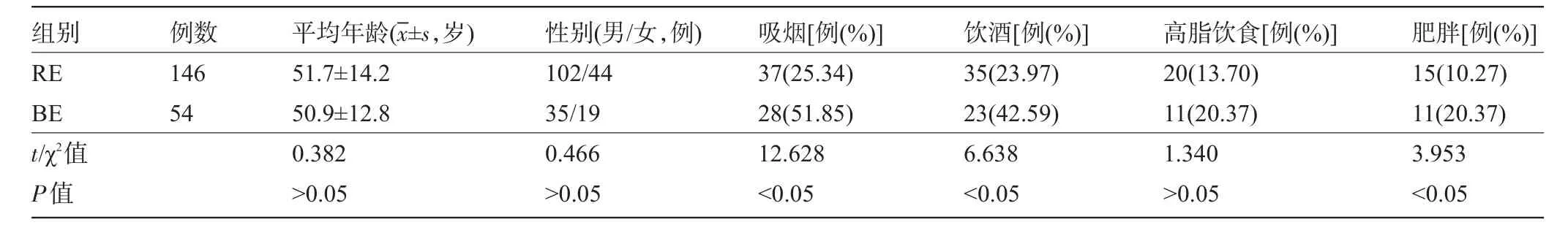
表3 RE与BE一般情况比较
2.4 随访结果对所有GERD患者均进行了为期6~15个月的随访,除去1例胃底癌及1例食管腺癌患者,发现新发食管腺癌1例。
3 讨论
胃食管反流病是消化科门诊最常见的疾病之一,在欧美国家的发病率高达7%~15%,年发病率为0.38%~0.45%,近年来,本病在我国的发病率也呈逐年增加[5]。GERD指胃十二指肠内容物反流入食管引起反酸、烧心等临床症状,部分患者可以合并咽喉、气道等组织的损伤[6],主要包括反流性食管炎、非糜烂性反流病以及Barret食管等。RE在GERD中最为常见,主要因为食管下端括约肌功能失调、食管体部蠕动功能降低、食管组织抵抗力减弱及胃蛋白酶保护作用下降等引起胃十二指肠内容物向食管反流,进而造成食管黏膜出现炎症,并引起相应的临床症状[7]。反流至食管的胃酸和胆汁可对食管黏膜的鳞状上皮造成损伤,如果由化生的柱状上皮在组织损伤修复过程中将鳞状上皮取代,则可导致Barrett食管的形成。Barrett食管是GERD的严重并发症,指食管下段化生的单层柱状上皮代替了复层鳞状上皮的一种病理现象[8],伴或不伴有肠上皮的化生,是目前公认的食管腺癌的癌前病变。食管癌是世界范围内最常见的消化系统恶性肿瘤,在我国居恶性肿瘤发病率、病死率的第6位和第4位。食管腺癌具有预后差、生存率低的特点,作为食管腺癌的癌前病变Barrett食管的诊断和治疗[9-10]。
本研究对200例GERD患者的临床资料及内镜下表现进行了分析,结果显示200例GERD患者共检出RE患者146例,检出BE患者54例,其中BE患者中有中重度异型增生1例,食管腺癌1例,发生率分别为1.85%和1.85%,说明了BE是癌前病变,支持了BE-异型增生-癌变的发生、发展顺序。进一步比较了RE组与BE组比较,年龄、性别及高脂饮食的比例比较,差异无统计学意义(P>0.05)。但是BE组吸烟、饮酒及肥胖的比例均明显高于RE组,差异有统计学意义(P<0.05)。说明吸烟、饮酒及肥胖是BE的危险因素。有研究证实,香烟的烟雾中富含多种致癌物质,进入食管上皮细胞厚可引起基因突变,促进正常组织向BE的转化;此外,吸烟可明显降低食管下端括约肌压力,同时对唾液的分泌有抑制作用[11];而饮酒会使食管同步收缩效率和蠕动功能受到影响,导致胃和食管功能衰退;肥胖者往往由于高热量因素和饱食引起食道下括约肌的松弛,而腹压的升高也是食管孔疝的发生风险大大增加,也容易加重胃食管反流[12]。本研究尚检出RE合并胃底癌1例,但胃底病变与反流性食管炎是否有关系尚待进一步深入研究。对200例GERD患者均进了为期6~15个月的随访,除去1例胃底癌及1例食管腺癌患者,发现新发食管腺癌1例。
综上所述,反流性食管炎的检出率较高,而BE是食管腺癌的癌前病变,其发生与吸烟、饮酒及肥胖有关。建议对具有GERD患者尤其是BE患者,应采取积极措施进行早期干预治疗,以预防食管腺癌的发生。
[1] 汤武亨,陈国光,金海,等.某院门诊患者胃食管反流病临床流行病学调查[J].上海预防医学,2006,18(10):524-525.
[2] 李治仝,汪忠镐,季锋,等.Barrett食管与胃食管反流病及食管腺癌的关系[J].临床误诊误治,2011,24(11):10-13.
[3] 李婧文,房殿春.食管腺癌相关危险因素的研究进展[J].现代消化及介入诊疗,2014,19(2):94-96.
[4] 王少鑫,浦江,崔立红.胃食管反流病量表(GERD Q)在临床诊治中的应用[J].中华保健医学杂志,2014,16(4):299-300.
[5] 牛春燕,闫蓉,吴方雄,等.西安地区老年胃食管反流病发病情况调查[J].胃肠病学和肝病学杂志,2012,21(12):1116-1118,1121.
[6] 林诚,韩向阳.雷贝拉唑联合莫沙必利治疗老年胃食管反流病的疗效与安全性[J].海南医学,2014,25(18):2675-2677.
[7] Savarino E,Zentilin P,Marabotto E,et al.Areview of pharmacotherapy for treating gastroesophageal reflux disease(GERD)[J].Expert Opin Pharmacother,2017,18(13):1333-1343.
[8] 陈慧,詹俊,钟娃,等.Barrett食管及其相关腺癌的临床组织病理学特征与关系[J].中华消化杂志,2014,34(5):292-296.
[9] 李永辉,张文学,张越,等.食管鳞癌和食管腺癌中VEGF-C和新生淋巴管的表达与病理因素的关系[J].海南医学,2015,26(20):2979-2981.
[10] Findlay JM,Middleton MR,TomLinson I.Genetic biomarkers of barrett's esophagus susceptibility and rogression to dysplasia and cancer:a systematic review and meta-analysis[J].Dig Dis Sci,2016,61(1):25-38.
[11] 张兆祥.吸烟饮酒与食管癌的研究进展[J].中国公共卫生,2003,19(3):359-361.
[12] 曾荣耀,刘静.Barrett食管的危险因素及治疗进展[J].中华消化外科杂志,2013,12(10):807-810.

