孟鲁司特联合匹多莫德对急性支气管哮喘患儿肺功能及免疫功能的影响
刘钊,姜红,张俊斌
(1.武汉市青山区红钢城街道卫生服务中心内科,湖北武汉430000;2.华中科技大学同济医学院附属武汉市中心医院新生儿科,湖北武汉430014;3.武汉科技大学附属医院武汉市普仁医院呼吸科,湖北武汉430081)
支气管哮喘是一种常见的呼吸系统疾病。随着经济发展,空气污染日益严重,支气管哮喘患患者数呈逐年上升趋势[1]。据统计,全球支气管哮喘人数已达3亿[2],而我国支气管哮喘流行病学调查显示,0~14岁青少年儿童支气管哮喘的患病率较10年前上升了超过50%[3]。因此,对于儿童支气管哮喘的治疗的研究显得迫在眉睫。支气管哮喘主要以气道非特异性炎性反应为主要特征,针对它的治疗主要包括两个方面的重要内容[4]:有效改善患儿肺功能和确保患儿较高的生存治疗。支气管哮喘是一种由体内多种介质和多种炎性细胞参与的病理过程。孟鲁司特是一种选择性较高的白三烯受体拮抗剂,可以阻止白三烯在炎性反应中与其受体的结合而产生的生化反应[5]。孟鲁司特的咀嚼片可以用于15岁以下儿童的哮喘治疗之中。匹多莫德是一种免疫调节剂,可帮助改善哮喘患儿的免疫功能。将这两种药物进行联合治疗的报道较多,但这两种药物联合运用对患儿细胞免疫的影响还少见研究,我院联合运用孟鲁司特联合匹多莫德对急性支气管哮喘患儿进行治疗,并对其对患儿的免疫系统的影响进行了研究。
1 资料与方法
1.1 一般资料选取2014年2月至2015年2月在武汉市青山区红钢城街道卫生服务中心内科进行治疗的急性支气管哮喘患儿作为研究对象。纳入标准:(1)符合中华医学会儿科分会修订2008版《儿童哮喘诊断与防治指南》的诊断标准[6];(2)年龄>10岁且<14岁;(3)治疗顺应性好,可以配合医生完成各项检查并遵医嘱坚持用药治疗。排除标准:(1)4周内使用过免疫抑制剂;(2)治疗前3个月之内没有出现过全身性感染,尤其是严重肺部感染和上呼吸道感染等;(3)治疗前3个月未使用过任何白三烯受体拮抗剂。按照纳入标准和排除标准选择120例,将其按照随机数表法分为对照组和观察组,每组60例。本研究获得了本院医学伦理委员会的批准,所有患儿家长均对研究内容知情同意并签署知情同意书。
1.2 方法对照组患儿接受口服孟鲁司特[(孟鲁司特钠咀嚼片(商品名顺尔宁),Dohme Australia Pty Ltd,化学药品,5 mg,生产批号1401923)]治疗,每日一片。观察组患儿在对照组患儿口服孟鲁司特治疗的基础上还接受口服匹多莫德[(匹多莫德颗粒剂(商品名谱乐益),浙江仙琚制药股份有限公司,化学药品,2 g:0.4 g,生产批号:921312943)]治疗,每日两次,初始剂量为0.4 g/次。所有治疗以3个月为一个疗程,本研究共连续治疗一个疗程。
1.3 观察指标
1.3.1 肺功能改善情况于治疗前和治疗一个疗程后采用美国SENSOR MEDICSV 6200肺功能检测仪对检测患儿的肺功能指标,包括FEV1和用力肺活量(forced vital capacity,FVC)。
1.3.2 血清中T细胞亚群CD3+、CD4+、CD8+含量治疗前后于清晨空腹采集两组患者血液5 mL抗凝,分离出淋巴细胞,采用美国BD公司制造的流式细胞仪测量以上指标,并计算CD4+/CD8+值。
1.4 疗效判定判定所有患儿一个疗程后的治疗效果,判定标准如下:显效:症状较完全缓解,哮喘偶有发作,可以不用药缓解,一个疗程后患儿非发作期一秒用力呼气容积(forced expiratory volume in one second,FEV1)增量达25%~35%;有效:症状有所减轻,哮喘发作频率明显减少,一个疗程后患儿非发作期FEV1增量达10%~24%;无效:症状无缓解或加重,一个疗程后患儿非发作期FEV1增量低于10%或减少。治疗有效率=(显效+有效)/总人数×100%。
1.5 统计学方法应用SPSS20.0统计软件进行数据分析,计量数据以均数±标准差(x-±s)表示,两组样本均数比较采用独立样本t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 两组患儿基本资料比较两组患儿年龄、性别、体质量和病程比较差异均无统计学意义(P>0.05),具有可比性,见表1。
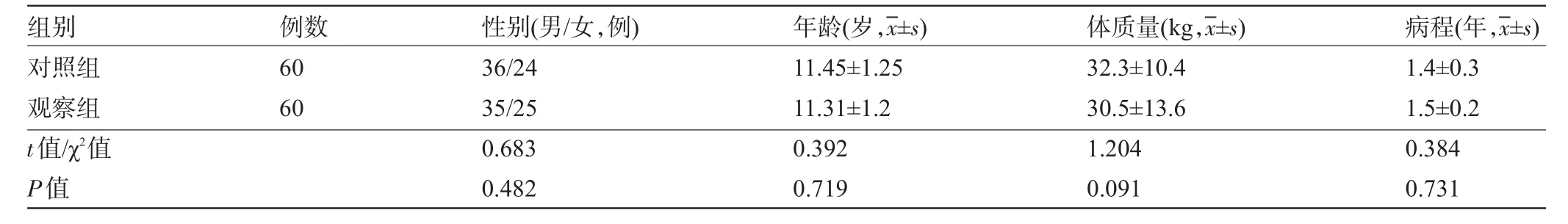
表1 两组患儿基本资料比较
2.2 两组患儿临床疗效比较两组患儿治疗一个疗程后结果显示,观察组患儿的治疗有效率明显高于对照组,差异有统计学意义(P<0.05),见表2。
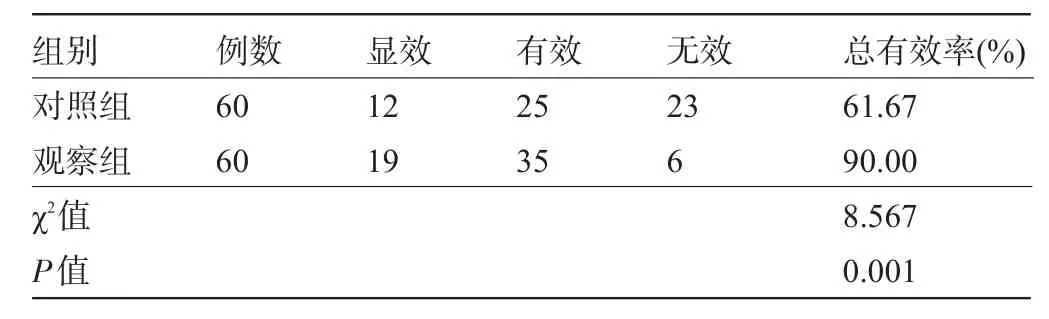
表2 两组患儿临床疗效比较(例)
2.3 两组患儿肺功能改善情况比较两组患儿治疗前FEV1、FEV1/FVC比较差异均无统计学意义(P>0.05),治疗一个疗程后,两组患儿的FEV1和FEV1/FVC较治疗前都明显提高(P<0.05),且观察组此两项指标增加更加显著,差异有统计学意义(P<0.05),见表3。
表3 两组患儿治疗前后FEV1、FEV1/FVC比较(±s)
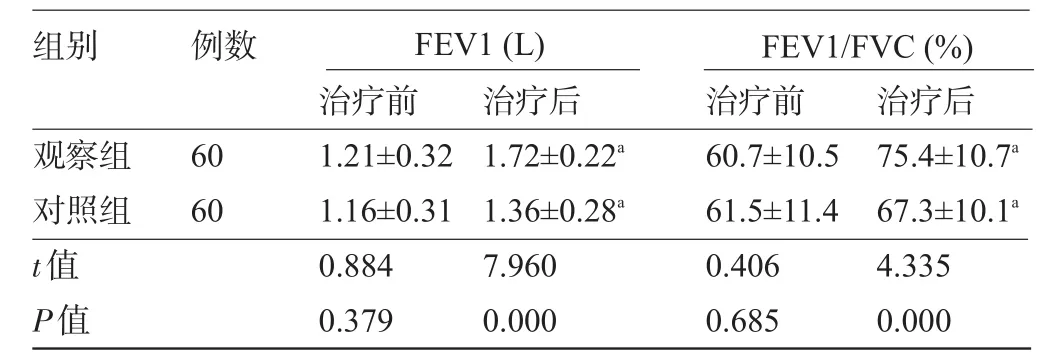
表3 两组患儿治疗前后FEV1、FEV1/FVC比较(±s)
注:与治疗前比较;aP<0.05。
组别例数FEV1(L)FEV1/FVC(%)观察组对照组t值P值60 60治疗前1.21±0.32 1.16±0.31 0.884 0.379治疗后1.72±0.22a 1.36±0.28a 7.960 0.000治疗前60.7±10.5 61.5±11.4 0.406 0.685治疗后75.4±10.7a 67.3±10.1a 4.335 0.000
2.4 两组患儿T细胞亚群含量比较两组患儿在治疗前体内各种T细胞亚群含量比较差异均无统计学意义,但治疗后观察组患儿的CD4+、CD4+/CD8+均明显高于对照组,而CD8+含量明显低于对照组,差异均有统计学意义(P<0.05),见表4。
表4 两组患儿T细胞亚群含量比较(±s)
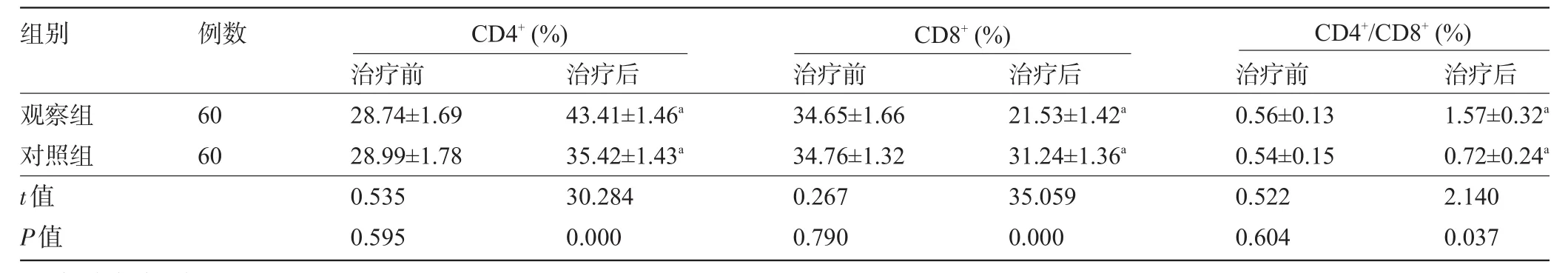
表4 两组患儿T细胞亚群含量比较(±s)
注:与治疗前比较,aP<0.05。
组别例数CD4+(%)CD8+(%)CD4+/CD8+(%)观察组对照组t值P值60 60治疗前28.74±1.69 28.99±1.78 0.535 0.595治疗后43.41±1.46a 35.42±1.43a 30.284 0.000治疗前34.65±1.66 34.76±1.32 0.267 0.790治疗后21.53±1.42a 31.24±1.36a 35.059 0.000治疗前0.56±0.13 0.54±0.15 0.522 0.604治疗后1.57±0.32a 0.72±0.24a 2.140 0.037
3 讨论
支气管哮喘是由体内多种细胞介导的以气道慢性炎症性病变为主要症状的疾病。哮喘发作时,患儿会出现气促、喘息、咳嗽和胸闷等症状[7]。目前[8],临床上对急性支气管哮喘发病的分子生物学机制还尚无定论,但是对其的治疗还是基本形成了较为成熟和有效的方案。本研究采用的两种治疗药物:孟鲁司特和匹多莫德,前者属于白三烯受体拮抗剂,后者属于免疫调节剂。都是目前治疗急性支气管哮喘的新型药物[9]。在本研究中,将这两种药物联合使用取得了比较满意的疗效。一个疗程后,观察组患儿的治疗效果明显高于对照组患儿。这是因为,观察组患儿在接受孟鲁司特治疗的同时还接受了免疫调节剂匹多莫德的治疗。孟鲁司特作为白三烯受体拮抗剂可以有效缓解炎性反应症状,有效缓解白三烯对支气管平滑肌的刺激作用[10]。但是,急性支气管哮喘患儿往往免疫功能,尤其是细胞免疫功能较弱,这导致患儿反复出现呼吸道感染,诱发哮喘的出现。匹多莫德作为免疫调节剂可以有效帮助增强患儿免疫力,减少呼吸道感染的出现[11]。因此观察组患儿治疗效果更佳。
白三烯是一种作用较强的炎性介质,可分泌产生白三烯的细胞较多,包括中性粒细胞、单核细胞、嗜酸性粒细胞和嗜碱性粒细胞等[12],其对支气管平滑肌有非常强烈的刺激收缩作用,它在支气管局部可募集其他炎性细胞,造成支气管壁的通透性增加,黏液分泌增多,最终导致哮喘症状加深加重[13]。已有研究表明,血清白三烯水平与哮喘严重程度直接相关,也与患儿肺功能直接相关。孟鲁司特作为一种强效白三烯受体拮抗剂,可以有效抑制白三烯与其受体的结合,导致其无法发挥生理作用。因而,两组患儿在接受一段时间的治疗后,肺部功能均显著提高。但是,联合用药的观察组患儿治疗两个疗程后肺功能改善情况更加明显,这可能是因为联合用药组患儿体内免疫功能增强,有效地避免了反复性呼吸道感染和肺部感染的出现,对肺功能也是一种保护。由此说明,孟鲁司特和匹多莫德的联合使用不仅可以缓解急性支气管哮喘的临床症状,还可以提高患儿肺功能。
同时对患儿的免疫细胞检测结果也显示,联合用药的观察组患儿治疗两个疗程后血清CD4+、CD4+/CD8+水平更高。匹多莫德作为可以口服使用的免疫调节剂具有多种功能[14-15]:其一,它可以提高中性粒细胞和巨噬细胞的趋化性,同时提高这两种细胞的吞噬能力;其二,它可以有效调节T细胞亚群的生成和分化[16-20]。联合用药组的患儿治疗后血清CD4+、CD4+/CD8+水平更高,同时CD8+水平下降明显,说明匹多莫德对患儿的免疫功能有显著的调节作用。
综上所述,采用孟鲁司特联合匹多莫德对急性哮喘病患儿进行治疗,可以有效增强患儿肺功能,调节患儿免疫功能,缓解哮喘症状,效果显著,值得临床推广。
[1] Heintze K,Petersen K-U.The case of drug causation of childhood asthma:antibiotics and paracetamol[J].Eur J Clin Pharmacol,2013,69(6):1197-1209.
[2] Feldman AS,He Y,Moore ML,et al.Toward primary prevention of asthma.Reviewing the evidence for early-life respiratory viral infections as modifiable risk factors to prevent childhood asthma[J].Am J Respir Crit Care Med,2015,191(1):34-44.
[3] 王美凤.布地奈德联合特布他林治疗儿童哮喘发作的效果评价[J].中国实用护理杂志,2012,28(18):57-58.
[4] Al-Muhsen S,Horanieh N,Dulgom S,et al.Poor asthma education and medication compliance are associated with increased emergency department visits by asthmatic children[J].Ann Thorac Med,2015,10(2):123-131.
[5] 余洽超,余明杰,麦劲刚,等.孟鲁司特钠与吸入布地奈德联合治疗儿童哮喘的临床观察[J].中国现代应用药学,2007,24(3):249-250.[6]中华医学会儿科学会呼吸学组,《中华儿科杂志》编辑委员会.儿童支气管哮喘诊断与防治指南[J].中华儿科杂志,2008,46(10):745-753.
[7] Hansbro PM,Kaiko GE,Foster PS.Cytokine/anti-cytokine therapy-novel treatments for asthma?[J].Br J Pharmacol,2011,163(1):81-95.
[8] Tunde-Ayinmode MF.Children with bronchial asthma assessed for psychosocial problems in a teaching hospital in Nigeria[J].Afr Health Sci,2015,15(2):690-700.
[9] 吴延雷,凌杰.匹多莫德对儿童哮喘患儿血清白介素-4和γ-干扰素水平的影响及疗效观察[J].中国医药导报,2013,10(24):101-102,105.
[10] Zhu J,Message SD,Qiu Y,et al.Airway inflammation and illness severity in response to experimental rhinovirus infection in asthma[J].Chest.2014,145(6):1219-1229.
[11] 万明,黄丽.匹多莫德联合玉屏风颗粒治疗儿童哮喘合并反复呼吸道感染疗效观察[J].现代中西医结合杂志,2013,22(17):1849-1851.
[12] Kim SR,Lee YC.Endoplasmic reticulum stress and the related signaling networks in severe asthma[J].Allergy Asthma Immunol Res,2015,7(2):106-117.
[13]Reddel HK,Bateman ED,Becker A,et al.A summary of the new GINA strategy:a roadmap to asthma control[J].Eur Respir J,2015,46(3):622-639.
[14] 蔡文姬,孙晓艳,丁会,等.孟鲁斯特联合布地奈德福莫特罗粉吸入剂治疗老年妇女哮喘的临床研究[J].中国妇幼保健,2014,29(3):466-468.
[15] 刘丽梅.匹多莫德口服液治疗儿童哮喘的效果及安全性效果观察[J].中国保健营养,2016,26(1):164.
[16] 雷春霞,王石.匹多莫德联合孟鲁司特钠治疗儿童支气管哮喘的临床观察[J].中国药房,2016(29):4142-4144.
[17] 张娴,赵雪琴.孟鲁司特钠联合布地奈德治疗儿童哮喘的临床研究[J].中国临床药理学杂志,2016,32(13):1169-1171.
[18] 刘亚娟,陈莹,刘春艳.孟鲁司特联合匹多莫德治疗毛细支气管炎的临床效果[J].实用医学杂志,2016,32(14):2399-2401.
[19] 郑贵浪,吴家兴.孟鲁司特治疗儿童支气管哮喘的临床疗效及肺功能和细胞因子变化研究[J].中国全科医学,2015(12):1387-1389.
[20] 何春卉,林俊宏,陈容珊,等.孟鲁司特钠联合丙酸氟替卡松治疗螨虫过敏的儿童咳嗽变异型哮喘的疗效及安全性[J].中华实用儿科临床杂志,2015,30(14):1106-1109.

