γ-氨基丁酸受体ρ2亚基重组蛋白构建及表达
王 琪,李超堃,李 敏,安欣芳,付自醒
(1.新乡医学院基础医学院生理学与神经生物学教研室,河南 新乡 453003;2.新乡医学院第二附属医院,河南 新乡 453002;3.河南省生物精神病学重点实验室,河南 新乡 453002)
γ-氨基丁酸(γ-aminobutyric acid,GABA)是中枢神经系统重要抑制性神经递质,通过对氯离子通道型GABAC受体的作用,改变氯离子的通透性,引起细胞膜超极化[1],进而抑制神经元兴奋。GABA受体分为GABAA、GABAB和GABAC3种亚型,其中GABAA和GABAC属于配体依赖性氯离子通道受体超家族。组成GABAC受体的亚基主要有3个,分别为ρ1、ρ2和ρ3。相对于GABAA受体,GABAC受体对GABA更敏感,通道开放时间更持久,介导持久且缓慢的内向氯离子电流[2]。GABAC受体对荷包牡丹碱和巴氯芬均不敏感,可受槲皮素及槲皮素苷调节[3]。近年国内外大量研究表明,脑缺血可引发中枢神经系统兴奋性毒性,尤其是谷氨酸的大量释放及累积是引起神经元损伤的重要原因[4-7]。GABA受体对缺血性脑损伤起着非常重要的保护作用[8]。研究证实,增强GABA受体活性可抑制脑缺血损伤释放的大量谷氨酸毒性作用,进而发挥抗脑缺血损伤作用[9-10]。因此,GABAC受体可作为缺血刺激和药物作用的重要靶标。本课题组研究发现,黄体酮等药物能够特异性结合GABAC受体ρ2亚基,进而干预GABA能信号传导[11-12],推测GABAC受体ρ2亚基的激活可能在药物神经保护功能中发挥至关重要的作用。为进一步验证胞内GABAC受体ρ2高表达水平是否具有神经保护作用,本实验在体外合成重组蛋白GABACR ρ2,借助人类免疫缺陷病毒-1(human immunodeficiency virus-1,HIV-1)的反义激活蛋白(transactivator transcription,Tat)介导重组蛋白的转运,构建一过性表达系统,为研究GABAC受体ρ2亚基功能奠定基础。
1 材料与方法
1.1材料DH5α感受态细胞、BL21(DE3)PlysS感受态细胞、聚合酶链式反应(polymerase chain reaction,PCR)试剂盒、Bradford蛋白定量试剂盒、His-tag、绿色荧光蛋白(green fluorescent protein,GFP)一抗、碱性磷酸酶标记山羊抗鼠IgG(H+L)二抗均购于上海碧云天生物技术有限公司,2×PCR Reagent试剂购于天根生化科技(北京)有限公司,Phusion 超保真DNA 聚合酶购于赛默飞世尔科技(中国)有限公司,限制性内切酶QuickCutDpnI购于宝生物工程(大连)有限公司,质粒提取试剂盒购于美国OMEGA 生物公司,Ni-NTA Fast Start Kit购于美国QIAGEN生物公司,胎牛血清购于美国Hyclone生物公司,高糖达尔伯克改良伊格尔培养基(Dulbecco′s modified Eagle′s medium,DMEM)、青-链霉素购于杭州吉诺生物医药技术有限公司,PCR引物由上海Invitrogen生物公司合成,预染低分子量蛋白Marker购于上海索莱宝生物科技有限公司,人神经母细胞瘤细胞SH-SY5Y购于中国科学院上海生科院细胞资源中心。
1.2方法
1.2.1重组质粒pET-ρ2-GFP-Tat的构建以pET30 DNA为模版,pET30上游引物为5′-CATATGTATATCTCCTTCT-3′,下游引物为5′-CACCACTGAGATCCGGCTGCTAAC-3′。利用快速克隆法[11]进行质粒构建,以获得pET30基因片段。PCR扩增反应体系为:H2O 33 μL,5×Phusion扩增缓冲液 10 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)2 μL,Phusion DNA聚合酶0.5 μL,上下游引物(5 μmol·L-1)各1 μL,pET30 DNA模板 3 μL,总体积 50 μL。PCR扩增反应条件为:98 ℃预变性2 min;98 ℃变性 15 s;58 ℃复性15 s;72 ℃延伸 3 min 50 s,18个循环;再72 ℃延伸 5 min;4 ℃保存。抽取部分PCR产物利用体积分数10 g·L-1的琼脂糖凝胶进行电泳检测。
以pEGFP-ρ2质粒为模版,ρ2上游引物为5′-GAAACGTCGTCAGCGTCGCCGTATGCCTTATTTTAC-AAGACTC-3′,下游引物为5′-CCGGATCTCAGTGGTGGTGGTGGTGGTGAACGGACTTCCGGCGTTTCA-3′。上、下游引物分别引入Tat、His-tag标签序列进行扩增以获得ρ2-GFP-Tat片段。PCR扩增反应体系为:H2O 35 μL,5×Phusion扩增缓冲液10 μL,dNTP 2 μL,Phusion DNA聚合酶0.5 μL,上下游引物各(5 μmol·L-1) 1 μL,DNA模版 1 μL,总体积 50 μL。PCR扩增反应条件为:98 ℃预变性2 min;98 ℃变性30 s;55 ℃复性30 s;72 ℃延伸3 min 30 s,共18个循环;72 ℃再延伸5 min;4 ℃保存。应用体积分数10 g·L-1琼脂糖凝胶电泳进行鉴定。
将PCR产物各加1 μLDpnI 37 ℃消化过夜,pET30α骨架与ρ2-GFP-Tat片段按11比例混合[11]。转化DH5α感受态细胞,筛选Kan+抗体单克隆,过夜、培养。取菌液行PCR鉴定重组质粒。测序上游引物为5′-GTAGAGGATCGAGATCGA-3′,下游引物为5′-ATCCGGATATAGTTCCTC-3′。PCR扩增反应体系为:H2O 7 μL,2×PCR Reagent 10 μL,上、下游引物 (10 μmol·L-1)各1 μL,细菌液 1.5 μL,总体积 20 μL。PCR扩增反应条件为:94 ℃预变性5 min;94 ℃变性30 s;55 ℃复性30 s;72 ℃延伸90 s,25个循环;72 ℃再延伸 5 min;4 ℃保存。扩增完成后,进行体积分数10 g·L-1琼脂糖凝胶电泳鉴定。将阳性克隆菌液送于北京Invitrogon测序公司进行测序。重组质粒命名为pET-ρ2-GFP-Tat质粒,测定质粒DNA浓度,于-20 ℃保存。
1.2.2重组蛋白ρ2-GFP-Tat诱导表达及条件优化将pET-ρ2-GFP-Tat转化到BL21(DE3)PlysS中,待菌液在600 nm波长下的吸光度值达到0.6时,加入终浓度为1 mmol·L-1的异丙基-β-D-硫代半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG)诱导蛋白表达,分别于37 ℃和26 ℃诱导过夜。收集菌液于离心管中,12 000 r·min-1离心1 min,弃上清液,加 200 μL 磷酸盐缓冲溶液(phosphate buffered saline,PBS)重悬沉淀,冰浴20 min后,超声破碎(6 s超声6 s间隔),至菌液澄清。将澄清液体在4 ℃下12 000 r·min-1离心20 min,收集上清液即为可溶性蛋白。8 mol·L-1尿素溶解沉淀,冰浴 30 min,于 4 ℃ 下12 000 r·min-1离心20 min,取上清液即为包涵体蛋白。应用免疫印迹鉴定重组蛋白表达,一抗为小鼠源GFP抗体(11 000 稀释),二抗为碱性磷酸酶(Ap)标记的山羊抗小鼠抗体(11 000 稀释)。
1.2.3纯化重组蛋白ρ2-GFP-Tat用上述方法诱导200 mL菌液,表达并提取包涵体蛋白。用His标签亲和层析柱进行蛋白质纯化,5 mL 变性结合缓冲液平衡柱子后,上样,分别用10 mL 变性结合缓冲液,20 mL 变性洗涤缓冲液 (8 mol·L-1尿素,pH 6.3),2 mL 变性洗脱缓冲液(8 mol·L-1尿素,pH 4.5)进行蛋白洗脱,并收集流体。为得到较高纯度的重组蛋白,将收集的2 mL流体挂柱,再次进行离子交换层析,然后,取 5 cm 透析袋进行脱盐,收集重组蛋白。分别取10 μL收集流体上样,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离和考马斯亮蓝染色,鉴定重组蛋白表达纯化情况。
1.2.4重组蛋白ρ2-GFP-Tat转染细胞将SH-SY5Y细胞接种于3 cm培养皿中培养,待细胞密度达到约80%进行蛋白转染(转染组)。用含20 μg ρ2-GFP-Tat重组蛋白的1 mL高糖DMEM孵育细胞24 h。设置正常培养SH-SY5Y细胞为对照组。荧光显微镜下观察Tat介导重组蛋白ρ2的转染能力。
1.2.5重组蛋白ρ2-GFP-Tat的活力检测胰蛋白酶消化SH-SY5Y细胞,稀释细胞浓度为5×107L-1,每孔100 μL接种于96孔板。按培养条件,将细胞分为正常组和低氧低糖组。正常组又分为正常对照组和正常转染组。其中正常转染组进行 20 μg 重组蛋白ρ2-GFP-Tat预孵育;正常对照组更换等体积高糖培养基,正常条件下培养。低氧低糖组又分为处理转染组和处理组,处理转染组进行 20 μg 重组蛋白ρ2-GFP-Tat预孵育;处理组更换等体积新鲜低糖培养基。24 h后,2组均给予细胞低氧低糖损伤处理12 h。各组均更换含有10 μL 细胞计数试剂盒溶液的新鲜培养基,37 ℃孵育1 h,采用酶标仪在450 nm波长下检测各组细胞吸光度值。每组设3个复孔,实验重复3次。
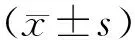
2 结果
2.1重组质粒pET-ρ2-GFP-Tat构建经核酸电泳后,PCR产物分别在3~5 kb和2~3 kb出现条带,见图1。其中,泳道1在2~3 kb处出现与预期的ρ2基因片段(2.8 kb)大小相符的条带,泳道2在3~5 kb处出现与预期pET30骨架片段(5.4 kb)大小相符的条带(图1A)。重组质粒后转化感受态细胞,培养板长有6个单克隆菌落,挑取菌落进行菌液PCR,结果显示,菌液样品均在2.8 kb位置出现条带,与预期基因片段大小相符,电泳结果见图1B。6个克隆均为阳性克隆。菌液经测序证实重组质粒构建完成。

A:ρ2-GFP-Tat PCR产物鉴定图;1:ρ2-GFP-Tat;2:pET30 质粒片段;B:单克隆菌液PCR鉴定重组质粒pET30-ρ2-GFP-Tat图;3~8:6个单克隆菌落的菌液PCR产物;9:DNA marker。
图1PCR产物琼脂糖凝胶电泳图
Fig.1AgarosegelelectrophoresisofPCRproduct
2.2重组蛋白ρ2-GFP-Tat的表达及条件优化运用GFP单克隆抗体进行菌体蛋白免疫印迹分析,结果显示于泳道2和泳道3中可见相对分子质量70 000~99 000之间存在蛋白条带,与预期大小为79 000的重组蛋白ρ2-GFP-Tat大小相符。而泳道4和泳道5为不同温度条件下提取的可溶性蛋白,经检测未发现蛋白条带。结果证实,重组蛋白ρ2-GFP-Tat主要以包涵体形式表达,且在26 ℃诱导温度下其表达量较高(图2)。

1:对照组;2:37 ℃诱导所得的包涵体;3:26 ℃诱导所得的包涵体;4:37 ℃ 诱导所得的可溶性蛋白;5:26 ℃诱导所得的可溶性蛋白。
图2重组蛋白ρ2-GFP-Tat表达
Fig.2Expressionoftherecombinantproteinρ2-GFP-Tat
2.3重组蛋白ρ2-GFP-Tat纯化蛋白电泳后考马斯亮蓝染色结果见图3。重组蛋白相对分子质量为79 000,蛋白条带清晰可见,表明了重组蛋白的成功表达和纯化。

1:蛋白质分子量标准;2:细胞裂解物;3:包涵体蛋白;4:结合缓冲液洗脱流体;5:洗涤缓冲液洗脱流体;6:洗脱缓冲液洗脱流体;7:脱离缓冲液洗脱流体。
图3重组蛋白ρ2-GFP-Tat的SDS-PAGE图
Fig.3SDS-PAGEfigureofrecombinantproteinρ2-GFP-Tat
2.4重组蛋白ρ2-GFP-Tat转染SH-SY5Y细胞经PBS洗涤后,转染重组蛋白的细胞在显微镜下可见到绿色荧光信号,且细胞核表现阴性荧光信号;对照组SH-SY5Y细胞无绿色荧光信号;见图4。结果证实重组蛋白ρ2在Tat信号肽介导下可穿透细胞膜,进入细胞。

A:转染组细胞明视野图;B:转染组细胞暗视野图;C:正常组细胞明视野图;D:正常组细胞暗视野图。
图4重组蛋白ρ2-GFP-Tat转染SH-SY5Y细胞(×400)Fig.4Recombinantproteinρ2-GFP-TattransfectSH-SY5Ycells(×400)
2.5重组蛋白ρ2-GFP-Tat的活性评价正常对照组、正常转染组、处理组和处理转染组的细胞活力分别为(100.0±6.9)%、(89.3±3.6)%、(51.4±3.6)%和(66.1±8.5)%。正常对照组与正常转染组细胞活力比较差异无统计学意义(P>0.05);处理组细胞活力显著低于正常对照组(P<0.01);处理转染组细胞活力显著高于处理组(P<0.01)。
3 讨论
基因工程应用中常使用质粒或病毒进行转染细胞,该手段风险高,并且转染效率低,周期长。近年来,利用蛋白转导域辅助的蛋白质进行转导成为研究热点。其中,HIV-1 Tat是由11个氨基酸组成的蛋白转导域,该蛋白域自1998年被发现后,已广泛应用于外源蛋白、DNA或复合物透过细胞膜及血脑屏障的转导[12-13]。Tat融合蛋白可引导不同蛋白质转导进入多种细胞,目前应用的细胞有外周血淋巴细胞、骨髓干细胞、交感神经瘤细胞等[14-17]。且Tat连接的相对位置对目的蛋白的二级结构及功能无影响[18]。Tat介导神经珠蛋白可透过血脑屏障发挥其缺氧缺血脑损伤的保护作用[19]。白血病抑制因子受体ɑ亚基在Tat介导下透过生物膜,实现抑制急性粒细胞白血病细胞活性[20]。Tat转导磷酸核糖基转移酶进入酶缺乏细胞,可有效治疗Lesch-Nyhan综合征[21]。以上研究充分证实了HIV-1 Tat 具有广谱的蛋白转导作用,为异源蛋白质跨膜开辟了新途径。
GABA受体家族中,GABAC受体和GABAA受体均属于配体依赖性氯离子通道受体,可通过调节GABA能神经传递系统兴奋性/抑制性平衡从而维持中枢神经系统稳态[9]。体外细胞培养结果表明,氧糖剥夺后神经元细胞GABAA受体显著下降[22]。研究发现,药物可通过调节GABA受体的表达,发挥抗缺血再灌注脑损伤的保护作用[23]。在缺血脑损伤动物实验中,一些可促进GABA摄入或者激活GABAA受体的药物显示出一定的神经保护作用[24-25]。神经元细胞表面促离子型GABA受体及其功能的变化可作为关键因素决定神经元在缺血损伤中的最终命运。而目前关于ρ2亚基功能的研究更多的是采用基因敲除[26]或质粒转染或药物激活/阻断[27-28]等手段,但存在耗时长、效率低等局限性。本研究利用Tat转导肽成功实现了ρ2在SH-SY5Y细胞的转染,为后续干预研究提供新思路和技术手段。
本研究利用原核表达载体构建ρ2-GFP-Tat重组蛋白,为验证重组蛋白跨膜能力,对SH-SY5Y细胞进行重组蛋白转染。由于ρ2末端融合了GFP,经重组蛋白ρ2-GFP-Tat转染后,发现细胞显示出绿色荧光信号。这证实了重组蛋白ρ2-GFP-Tat成功透过胞膜进入人SH-SY5Y细胞。细胞活力检测结果显示,正常对照组、正常转染组、处理组和处理转染组细胞活力分别为(100.0±7.0)%、(89.3±3.6)%、(51.4±3.6)%、(66.1±8.5)%。正常条件培养下重组蛋白ρ2-GFP-Tat对细胞活力无影响,低氧低糖损伤后,处理转染组细胞活力明显高于处理组。这说明重组蛋白ρ2-GFP-Tat在缺氧损伤过程中能够一定程度上增强细胞活力。
本研究体外合成ρ2蛋白,并借助Tat转导肽对缺氧细胞进行转染,进而发挥其受体功能,增强细胞活力。本实验成功构建了重组蛋白ρ2-GFP-Tat-His,表明可以利用原核体系表达融合蛋白ρ2-GFP-Tat-His,在神经元缺氧损伤模型中构建ρ2一过性表达体系,提高其胞内表达水平,进而为研究GABAC受体参与神经损伤及药物干预机制提供新的实验手段,为干预神经疾病奠定理论基础。
[1] LAU B K,KARIM S,GOODCHILD A K,etal.Menthol enhances phasic and tonic GABAAreceptor-mediated currents in midbrain periaqueductal gray neurons[J].BrJPharmacol,2014,171(11):2803-2813.
[2] NAFFAA M M,CHEBIB M,HIBBS D E,etal.Comparsion of templates for homology model of ρ1 GABACreceptor:more insights to the orthoseteric binding site′s structure and functionality[J].JMolGraphModel,2015,62:43-55.
[3] KIM H J,LEE B H,CHOI S H,etal.Differential effects of quercetin glycosides on GABACreceptor channel activity[J].ArchPharmRes,2015,38(1):108-114.
[4] HUANG M,CHENG G,TAN H,etal.Capsaicin protects cortical neurons against ischemia/reperfusion injury via down-regulating NMDA receptors[J].ExpNeurol,2017,295:66-76.
[5] MA X L,ZHANG F,WANG Y X,etal.Genistein inhibition of OGD-induced brain neuron death correlates with its modulation of apoptosis,voltage-gated potassium and sodium currents and glutamate signal pathway[J].ChemBiolInteract,2016,254:73-82.
[6] 胡捷先.脑缺血后谷氨酸通路及其调控的研究进展[J].复旦学报(医学版),2016,43(6):724-731.
[7] 武密山,赵素芝,高维娟,等.升麻苷H-1对脑缺血大鼠纹状体氨基酸类神经递质含量的影响[J].中国病理生理杂志,2016,32(5):831-835.
[8] OUYANG C,GUO L,LU Q,etal.Enhanced activity of GABA receptors inhibits glutamate release induced by focal cerebral ischemia in rat striatum[J].NeurosciLett,2007,420(2):174-178.
[9] MELE M,RIBEIRO L,INCIO A R,etal.GABAAreceptor dephosphorylation followed by internalization is coupled to neuronal ininvitroischemia[J].NeurobiolDis,2014,65:220-232.
[10] COSTA J T,MELE M,BAPTISTA M S,etal.Gephyrin cleavage ininvitrobrain ischemia decreases GABAAreceptor clustering and contributes to neuronal death[J].MolNeurobiol,2016,53(6):3513-3527.
[11] LI C,WEN A,SHEN B,etal.Fast cloning:a highly simplified,purification-free sequence-and ligation-independent PCR cloning method[J].BMCBiotechnol,2011,11:92.
[12] WANG Y,FU L,LIU B,etal.Construction of human LRIG1-TATfusions and TAT-mediated LRIG1 protein delivery[J].BiomedPharmacother,2015,69:396-401.
[13] ZOU S,FUSS B,FITTING S,etal.Oligodendrocytes are targets of HIV-1 tat:NMDA and AMPA receptor-mediated effect on survival and development[J].JNeurosci,2015,35 (32):11384-11398.
[14] GUO Q,ZHAO G,HAO F,etal.Effects of the Tat peptide orientation and relative location on the protein transduction efficiency[J].ChemBiolDrugDes,2012,79(5):683-690.
[15] LIN B Y,KAO M C.Therapeutic applications of the Tat-meidated protein transduction system for complex I deficiency and other mitochondrial diseases[J].AnnNYAcadSci,2015,1350:17-28.
[16] ZHANG S,WANG W,PENG Y,etal.Amelioration of radiation-induced skin injury by HIV-Tat-mediated protein transduction of RP-1 from rana pleurade[J].IntJMedSci,2013,11(1):44-51.
[17] ZHENG L,HUI Q,TANG L,etal.Tat-mediated acidic fibroblast growth factor delivery to the dermis improves wound healing of deep skin tissue in rat[J].PLoSOne,2015,10(8):e0135291.
[18] YOO S Y,LE T K,JEONG J J,etal.Poligapolide,a PI3K/Akt inhibitor in immunodefi-ciency virus type 1 TAT-transduced CHME5 cells,isolated from the rhizome of polygala tenuifolia[J].ChemPharmBull(Tokyo),2014,62(5):467-471.
[19] YE Q,SUN Y,WU Y,etal.Pichia pastoris production of Tat-NGB and its neuroprotection on rat pheochromocytoma cell[J].MolBiotechnol,2016,58(1):22-28.
[20] 徐莎,王越,孙擎,等.TAT介导的白血病抑制因子受体α亚基胞内远端融合蛋白的制备及其对HL-60细胞生长的抑制作用[J].解剖学杂志,2014,37(2):150-153.
[21] CATTELAN P,DOLCETTA D,HLADNIK U,etal.HIV-1 TAT-mediated protein transduction of human HPRT into deficient cells[J].BiochemBiophysResCommun,2013,441(1):114-119.
[22] RICCI L,VALOTI M,SGARAGLI G,etal.Protection by taurine of rat brain cortical slices against oxygen glucose deprivation-and reoxygenation-induced damage[J].EurJPharmacol,2009,621(1/2/3):26-32.
[23] XIAO G,WEI J,YAN W,etal.Improved outcome from the administration of progesterone for patients with acute severe traumatic brain injury:a randomized controlled trial[J].CritCare,2008,12(2):R61.
[24] KELLEY M H,TAGUCHI N,ARDESHIRI A,etal.Ischemic insult to cerebellar Purkinje cells causes diminished GABAAreceptor functionand allopregnanolone neuroprotection is associated with GABAAreceptor stabilization[J].JNeurochem,2008,107(2):668-678.
[25] LIANG R,PANG Z P,DENG P,etal.Transient enhancement of inhibitory synaptic transmission in hippocampal CA1 pyramidal neurons after cerebral ischemia[J].Neurosci,2009,160(2):142-148.
[26] WANG J,MOJUMDER D K,YAN J,etal.Invivoelectroretinographic studies of the role of GABACreceptors in retinal signal processing[J].ExpEyeRes,2015,139:48-63.
[27] SMITH B J,CTÉ P D,TREMBLAY F.Dopamine modulation of rod pathway signaling by suppression of GABACfeedback to rod-driven depolarizing bipolar cells[J].EurJNeurosci,2015,42(6):2258-2270.
[28] VAVERS E,ZVEJNIECE L,SVALBE B,etal.The neuroprotective effect of R-phenibut after focal cerebral ischemia[J].PharmacolRes,2016,113(Pt B):796-801.

