喷雾高温分解法制备TiO2/WO3多孔微球的光催化活性
杨继凯,成名,成丽波,寇艳强,亢佳琪
(长春理工大学 理学院,长春 130022)
1970年TiO2可以光激发分解水被Fujishima和Honda所报道[1,2],至此以后,无毒、低成本和高化学稳定性的TiO2作为一种可分解水中污染物和光解水制氢的杰出光催化材料被广泛的研究和应用[3,4]。然而,TiO2存在着体内电子-空穴对复合效率高的致命问题,这一直是影响TiO2材料光催化性能的关键因素。异质结构可以不改变TiO2晶体结构,以及TiO2的自身特性可通过界面异质结来提高光生载流子分离[5-7],这使复合电子受体材料受到了人们的追捧。WO3(Eg≈2.8eV)的导带边能够和TiO2结合形成II类异质结,此异质结能够将TiO2中的光生电子转移至 WO3,另外光生空穴可以转移至 TiO2[8-10]。从而TiO2/WO3异质结材料已经开始在光催化分解有机污染物方面崭露头角[11-14]。
喷雾高温分解方法是一种可以大批量生产且成本低可连续制备的优良方法[15,16]。此外,该方法的一个杰出特点是无需任何模板,通过制备条件的控制即可制备出均匀分布的微米量级或亚微米量级的微球和多孔微球[17]。此种微球的尺寸属于亚微米量级,其尺寸大小与可见光波长以及近紫外线波长非常相近。因此当太阳光照射在微球表面时会在固-气界面处发生多重散射,这样的结果导致了该微球对太阳光有很高的利用率,这种可以提高太阳光利用的多孔结构对于光催化过程非常有利[18,19]。本文利用简单、低成本的喷雾高温分解方法分别制备了TiO2多孔微球和TiO2/WO3复合多孔微球并以乙醛为降解目标分析和讨论了其光催化性质。
1 实验材料和方法
1.1 材料
TiO2粉末(Degussa P25,化学纯),日本Nihon Aeriso公司;乙醛(2 vol%in N2)、CO2(2 vol%in N2),上海化学公司;五水合钨酸铵,上海化学公司。实验用水均为三次蒸馏水。
1.2 分析测试仪器
Rigaku D/max-2500衍射仪,日本理学公司;FEI quanta 250的场发射扫描电镜(SEM),FEI公司;Hayashi UV410氙灯,日本林时计公司;SP-2100A气相色谱仪,北京北分瑞利集团。
1.3 TiO2/WO3多孔微球的制备
将TiO2粉末放到钨酸铵水溶液中超声分散形成混合的悬浊液。TiO2的浓度定为3gL-1,钨酸铵与TiO2的摩尔比为4mol%。先将制备好的上述悬浊液经过超声雾化后以氧气为载气穿过800℃管式炉的石英管,前驱溶液经过高温分解形成粉末,然后用一个连接在石英管末端的静电收集装置将粉末收集。最后将样品在温度为500℃的空气中再煅烧1小时。这样通过高温喷雾分解方法制得TiO2/WO3多孔微球样品(TiO2/WO3)。为作比较,也用同样的方法制备出TiO2多孔微球和WO3多孔微球样品。
1.4 光催化反应
TiO2微球和TiO2/WO3微球的光催化活性通过降解气相乙醛的方法来评估。用电子天平称量出0.05mg的两种样品,并将它们分别均匀放在几何面积为0.25cm2的样品槽内,然后将样品槽放入500ml的耐热石英玻璃容器底部。为了排除容器内部的二氧化碳,利用O2(20%)/N2气体通入玻璃容器的内部。另外,为了保证相对湿度控制在45%左右,将经过冰水的O2(20%)/N2气体通过容器内部。利用气密针将5ml的乙醛放入在反应器中使其浓度容积比为200ppmv。经过暗吸附30分钟后,利用发射波长为350~700nm的氙灯以84mW/cm-2的强度照射样品。然后通过一个装有2m Porapak-Q柱和气相色谱得到乙醛的降解程度和二氧化碳的生成程度。
2 实验结果与讨论
2.1 XRD测试表征
图1显示了TiO2多孔微球、TiO2/WO3多孔微和WO3样品的X射线衍射图形。TiO2多孔微球和TiO2/WO3多孔微球样品中均出现了锐钛矿相TiO2(A)(JCPDS No.21-1272)的衍射峰(2θ=38°,48°,54°,55°,63°,69°,70°,75°)和金红石相 TiO2(R)(JCPDS No.21-1276)的衍射峰(2θ=27°,36°,42°),这是和Degussa P25的性质一致的。在TiO2/WO3多孔微球中,除了TiO2衍射峰,观测到了2θ=23°和2θ=33°的两个弱的正交晶相WO3的特征X射线衍射峰,这说明钨酸铵热分解形成了WO3。从X射线衍射图形中可以看出已经成功的合成了TiO2/WO3多孔微球样品。
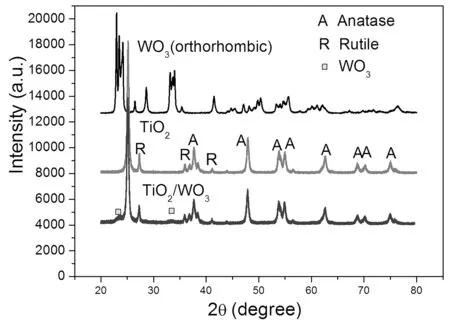
图1 TiO2多孔微球、TiO2/WO3多孔微球和WO3样品的X射线衍射图形
2.2 SEM测试表征
图2a、b显示了TiO2多孔微球和TiO2/WO3多孔微球的场发射扫描电镜图像和粒径分布情况。从图中可以看到所有样品显示为球状且粒径主要集中在500nm左右。从放大的TiO2多孔微球和TiO2/WO3多孔微球的场发射扫描电镜图像中能够更清晰的看到雾滴的蒸干使TiO2粒子堆积形成了多孔微球结构(图2c、d)。
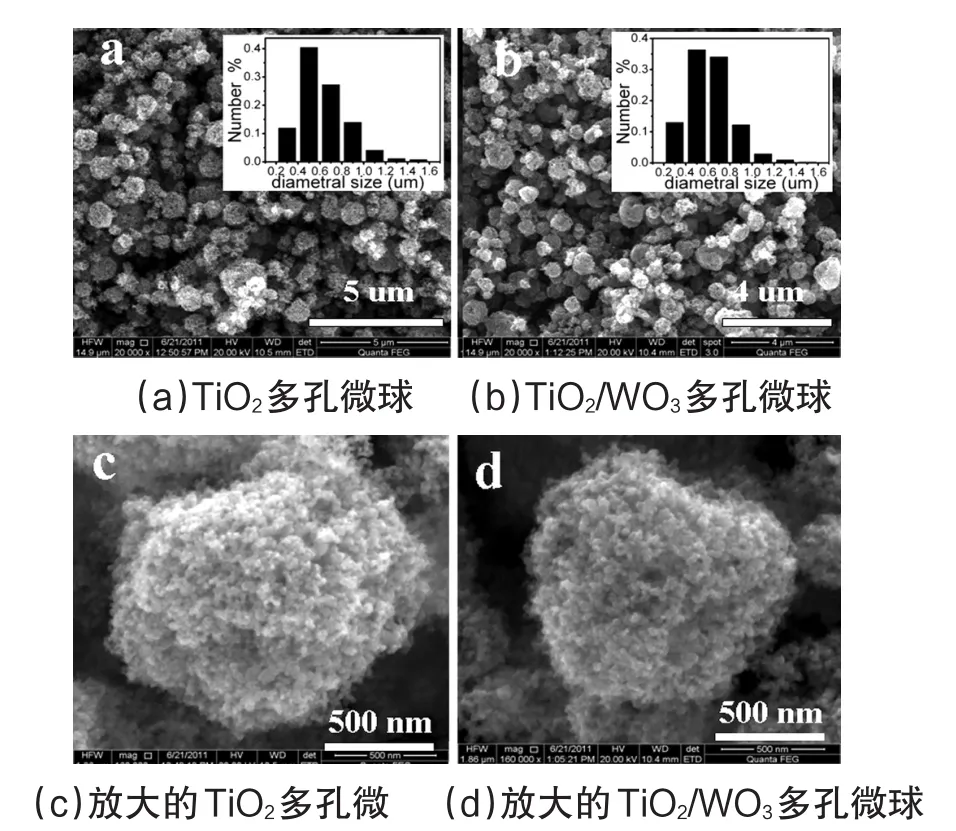
图2 TiO2多孔微球、TiO2/WO3多孔微球正常及放大的场发射扫描电镜图像和粒径分布情况
2.3 光致发光光谱测试表征
为了探索TiO2和WO3之间的电子转移特性,测试了样品的光致发光光谱。图3显示了TiO2多孔微球和TiO2/WO3多孔微球的光致发光发射光谱。在325nm激光激发下,所有样品均显示一个最大峰值约为520nm的宽的光致发光谱带,它归属于锐钛矿电荷分离竞争的特征自束缚激子的辐射复合[20]。TiO2/WO3多孔微球的发光强度低于TiO2多孔微球的发光强度。这说明引入的WO3能够接受TiO2光致产生的电子,从而抑制TiO2电子和空穴复合。
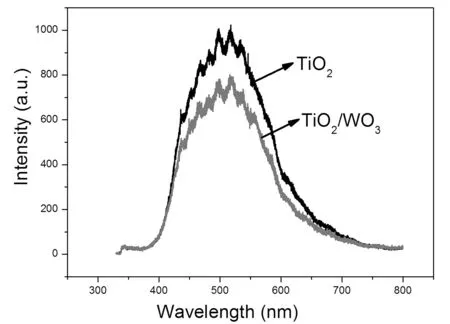
图3 TiO2多孔微球和TiO2/WO3多孔微球的光致发光光谱
2.4 乙醛降解测试
使用乙醛作为降解目标来评估TiO2多孔微球、TiO2/WO3多孔微球的光催化活性。如图4a所示,在模拟太阳光的照射下,微球样品都可以将乙醛降解为CO2,并且TiO2/WO3多孔微球与TiO2多孔微球相比显示了更高的光催化降解乙醛活性。关于CO2的产生如图4b所示,其结果表明TiO2/WO3多孔微球与TiO2多孔微球相比较具有更高的CO2产生速率。这说明TiO2/WO3多孔微球有利于乙醛的降解和CO2的生成。上述结果应该归因于TiO2/WO3异质结光生电子和空穴分离效应,这样的结果与光致发光的结果是一致的。
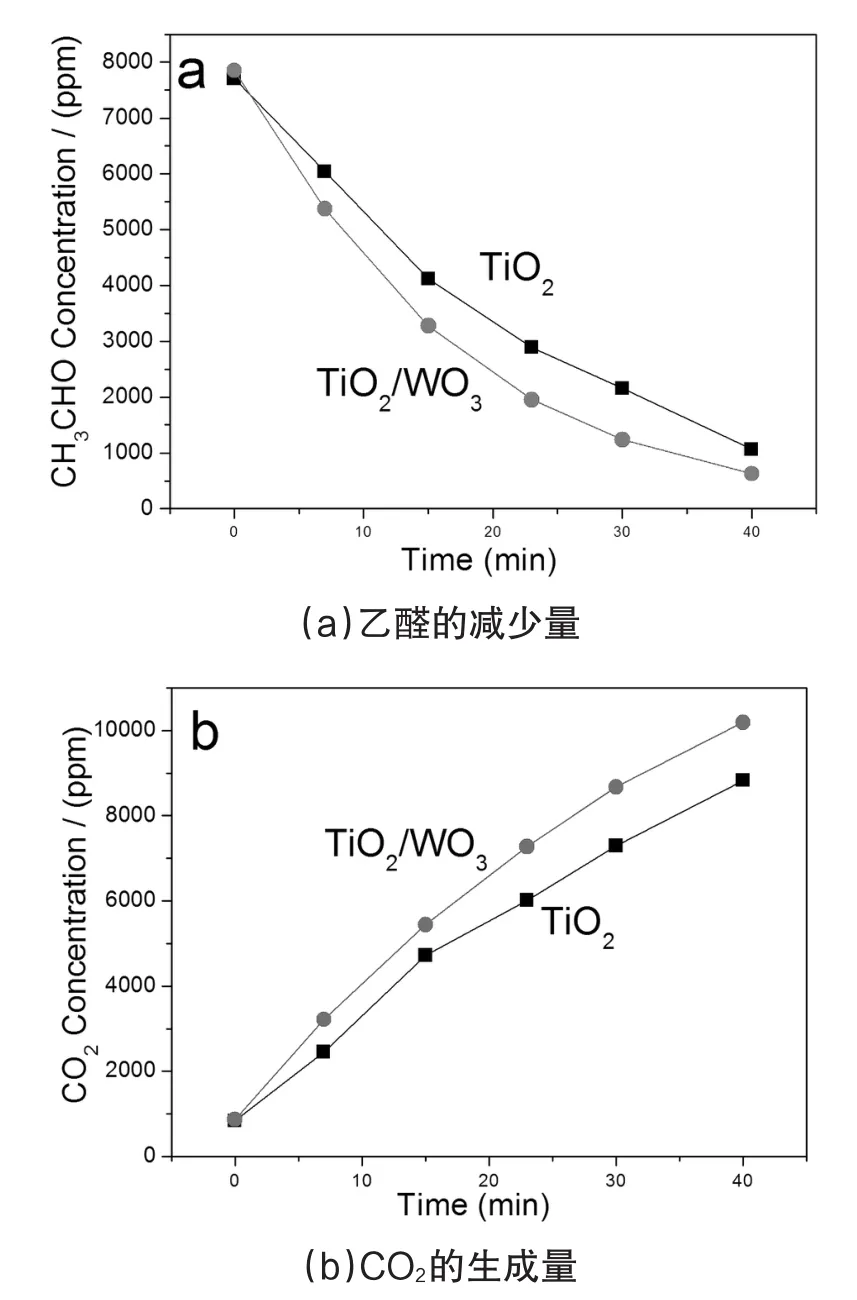
图4 TiO2多孔微球和TiO2/WO3多孔微球降解乙醛过程中乙醛的减少量和CO2的生成量
3 结论
利用喷雾高温分解的方法制备了TiO2多孔微球和TiO2/WO3多孔微球。光致发光结果显示了WO3的引入能够接受TiO2光致产生的电子,从而抑制了TiO2电子和空穴的复合。在太阳光的照射下,TiO2/WO3多孔微球与TiO2多孔微球比较无论乙醛的降解还是CO2的生成速率方面都显示了更高的光催化活性,这主要是由于TiO2/WO3异质结增加了电子-空穴分离效率所导致的。
[1]Gaya UI,Abdullah AH.Heterogeneous photocatalytic degradation oforganiccontaminantsovertitanium dioxide:A review offundamentals,progress and problems[J].J.Photochem.Photobiol.C:Photochem.Rev.,2008(9):1-12.
[2]Fujishima A,Honda K.Electrochemical photolysis of water at a semiconductor electrode[J].Nature,1972(238):37-38.
[3]Wang R,Hashimoto K,Fujishima A,et al.Light-induced amphiphilicsurfaces[J].Nature,1997(388):431-432.
[4]O’Neill SA,Clark RJH,Parkin IP,et al.Anatase thin films on glass from the chemical vapour deposition of titanium (IV) chloride and ethyl acetate[J].Chem.Mater.,2003(15):46-50,
[5]Wager J F.Transparent electronics:Schottky barrier and heterojunction considerations[J].Thin Film Solids,2008,516(8):1755-1764.
[6]Smith W,Zhao Y.Enhanced photocatalytic activity by aligned WO3/TiO2two-layer nanorod arrays[J].J.Phys.Chem.C,2008,112(49):19635-19641.
[7]SaJ,Fernandez-GarciaM.Photoformedelectron transferfrom TiO2to metalclusters[J].Catal.Commun,2008,9(10):1991-1995.
[8]Puddu V,Mokaya R,Puma G L.Novel one step hydrothermal synthesis of TiO2/WO3nanocomposites with enhanced photocatalytic activity[J].Chem Commun,2007,46(45):4749-4751.
[9]Gomez H,Orellana F,Lizama H,et al.Study of phenolpotodegradation with TiO2/-WO3coupled semiconductors activited by visible light[J].J Chil Chem Soc,2006,51(4):1006-1009.
[10]Shifu C,Lei C,Shen G,et al.The preparation of coupled WO3/TiO2photocatalystby ballmilling[J].Powder Technol,2005,160(3):198-202.
[11]Pan J H,Lee W I.Preparation of highly ordered cubic mesoporous WO3/TiO2films and their photocatalytic properties[J].Chem Mater,2006,18(3):847-853.
[12]Couselo N,Einschlag F S G,Candal R J,et al.Tungsten-DopedTiO2vs pure TiO2photocatalysts:effects on photobleaching kinetics and mechanism[J].J Phys Chem C,2008,112(4):1094-1100.
[13]Sajjad A K L,Shamaila S,Tian B,et al.One step activation of WOx/TiO2nanocomposites with enhanced photocatalytic activity[J].ApplCatalB Environ,2009,91(1-2):397-405.
[14]Su D,Wang J,Tang Y,et al.Constructing WO3/TiO2composite structure towards sufficient use of solar energy[J].Chem Commun,2011,47(14):4231-4233.
[15]Okuyama K,Lenggoro IW.Preparation of nanoparticles via spray route[J].Chem.Eng.Sci,2003(58):537-547.
[16]Kang HS,Kang YC,Park HD,et al.Morphology of particles prepared by spray pyrolysis from organic precursor solution[J].Mater. Lett.,2003 (57):1288-1294.
[17]Li D,Haneda H,Hishita S,et al.Visible-light-driven N−F−codoped TiO2photocatalysts.1.synthesis by spray pyrolysis and surface characterization[J].Chem.Mater,2005(17):2588-2595.
[18]Cao H,Zhao YG,Ho ST,et al.Random laser action in semiconductor powder[J].Phys.Rev.Lett.,1999(82):2278-2281.
[19]杨继凯.TiO2基多孔微球的制备表征及光催化性质研究[D].长春:东北师范大学,2012.
[20]Preclíková J,Galář P,Trojánek F,et al.Nanocrystalline titanium dioxide films:Influence of ambient conditions on surface and volume-related photoluminescence[J].J.Appl.Phys.,2010(108):1-8.

