二维斑点追踪成像技术评价乳腺癌患者曲妥珠单抗药物靶向治疗后左室早期心肌功能的损害
郑 军,李 晶,李树深,安小琴
曲妥珠单抗是IgG1型的重组人源化抗HER2的单克隆抗体。在20%~30%的乳腺癌妇女中,HER2表达呈阳性[1]。临床试验表明,曲妥珠单抗联合标准化疗能够减少约50%的复发率和33%的死亡风险[2-3]。曲妥珠单抗通常耐受性好,副作用少,但一些患者可能会产生不同程度的心脏毒性[4]。最近一项研究发现HER2阳性的乳腺癌患者使用曲妥珠单抗药物后心脏毒性的发生率是中等水平[5],因此检测该药物对心肌功能的早期影响至关重要。本研究旨在应用二维斑点追踪成像(2D-STI)技术监测乳腺癌患者使用曲妥珠单抗药物化疗后早期左室心肌功能的损害情况。
1 资料与方法
1.1 一般资料:选取2015年7月-2017年2月于我院外科术后病理诊断为乳腺癌,并接受曲妥珠单抗药物靶向治疗(采用EC_TH方案靶向治疗[6])的女性患者25例,年龄45~69岁,平均年龄(60.1±6.9)岁。纳入标准:未接受放疗治疗,心电图、肝肾功能未见明显异常,无远处转移。排除标准:各种类型的心肌疾患,如肥厚型心肌病、扩张型心肌病等;心肌梗死,化疗前心功能异常。本研究均获得患者知情同意。
1.2 仪器与方法
1.2.1 仪器:采用Philip 7C超声诊断仪,心脏探头X5-1,频率3.5 MHz,配有QLAB 10.0工作站。于靶向治疗前24 h,靶向治疗第4周期、第8周期、第12周期、第16周期结束24 h内,行超声心动图检查。嘱咐患者左侧卧位,行经胸常规超声心动图检查,同步记录心电图。应用Simpson法测量左室射血分数(LVEF)。
1.2.2 采集斑点追踪图像数据:嘱患者平静呼吸,将心动周期调节至4个,采集标准四腔心、三腔心、两腔心动态图像,短轴动态图像包括基底段、中间段、心尖段,点击aCMQ,选择AP4、AP3、AP2,软件自动根据心电图上R波顶点及T波终末选定心室舒张期及收缩期,计算出左室整体纵向应变(LVGLS)、左室整体圆周应变(LVGCS)。所有数据测量3次,取平均值。
1.2.3 治疗方案:所有患者在使用曲妥珠单抗药物之前,均使用表柔比星化疗4~6周期,化疗结束后开始使用曲妥珠单抗药物治疗,每3周1次,维持治疗时间为1年。曲妥珠单抗静脉给药,初始计量为8 mg/kg,90 min内静脉输入。以后每3周靶向治疗1次,计量为6 mg/kg。

2 结果
2.1 超声心动图常规参数靶向治疗前后比较:常规参数靶向治疗前后差异均无统计学意义(P>0.05),见表1。
2.2 2D-STI技术所测得参数靶向治疗前后比较:LVGLS在靶向治疗后不同周期均有所降低,第8周期后差异有统计学意义(P<0.05);而LVGCS在靶向治疗后第8、12、16周期的复查中差异均无统计学意义(P>0.05),见表2。
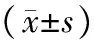
表1 曲妥珠单抗药物靶向治疗前后常规超声心动图测量参数比较
注:LVEDV:左室舒张末容积;LVESV:左室收缩末容积;IVSTd:室间隔厚度;PDTd:左室后壁厚度;LVFS:左室短轴缩短率;LVEF:左室射血分数。
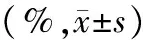
表2 曲妥珠单抗药物靶向治疗前后2D-STI参数比较
注:LVGLS:左室整体纵向应变;LVGCS:左室整体圆周应变。
2.3 相关性分析:乳腺癌患者在靶向治疗4、8、12、16周期,曲妥珠单抗药物累计计量均值分别为1 219.4±121.3、2 922.0±233.2、4 324.6±345.2、5 727.1±457.1,LVGLS分别为(-18.1±0.5)%、(-17.7±0.4)%、(-16.8±0.4)%、(-16.3±0.3)%。Spearman相关性分析结果显示,LVGLS与药物累计计量显著相关性(r=-0.859,P<0.05)。
对LVGLS参数做ROC分析,曲线下面积为0.924(P<0.05),根据Youden指数最大时,以-17.445%为诊断界点,敏感性为78.7%,特异性为94.0%。
3 讨论
曲妥珠单抗药物诱导的心脏毒性是不容忽视的。与蒽环类药物诱导的心脏毒性不同,曲妥珠单抗药物诱导的心脏毒性确切机制尚不明确。有研究表明,曲妥珠单抗药物诱导的心脏毒性与心肌细胞中HER2受体信号传导的阻断有关[7]。曲妥珠单抗药物抑制了HER2在心肌细胞氧化应激中的反应,从而引起心脏损伤的反应[8]。还有研究显示,HER2在心脏的交感神经系统中起着重要的作用,曲妥珠单抗药物导致erbB2介导的信号传导丧失,因此心脏对应激反应能力丧失,从而导致心脏毒性[9]。停止使用曲妥珠单抗药物后,其所造成的心脏毒性是可逆的[10]。单独使用曲妥珠单抗药物的乳腺癌患者治疗终止后,可以恢复LVEF低于40%的患者的心脏功能和(或)预防心脏事件[11]。
关于曲妥珠单抗药物心脏毒性事件的研究中,常规无创评估心脏毒性的指标主要是LVEF,然而其敏感度不高,只有心肌受损严重或者左心室整体功能受损严重时才出现形态、功能方面的改变。本研究使用2D-STI技术监测曲妥珠单抗药物引起的心脏毒性,结果显示LVGLS均较靶向治疗前减低,与药物累计计量呈负相关性,这与既往关于2D-STI研究蒽环类靶向治疗药物诱发的心脏毒性事件的结果类似[12]。可能是因为心脏在心动周期运动的过程中,LVGAS为同一心动周期中心内膜面积比较的变化率,可以直接反映心内膜发生变化的程度,对左心室心肌功能的变化相对更加敏感、直接[13]。绘制的ROC曲线结果显示,曲线下面积为0.924(P<0.05),以-17.445%为诊断界点,敏感性为78.7%,特异性为94.0%。
在靶向治疗的前8个周期中,LVGCS没有出现明显的减低,因此认为其不适合曲妥珠单抗药物对左心室心肌功能早期损害的监测,原因可能是左心室心肌受损早期主要发生于心内膜内,而环形纤维在心内膜中所占的比例较少,主要集中在心室壁的中层。本研究的局限性是样本量有限,尚需要考证。
总之,对于HER2阳性乳腺癌患者在使用曲妥珠单抗药物靶向治疗过程中,可能会诱导心脏毒性事件的发生。因此,接受曲妥珠单抗药物治疗后应该严密监测心肌功能的变化。本文应用2D-STI可更早地监测左心室心肌功能的损害情况,为临床早期进行干预提供一定的诊断依据。
[1] Ferlay J,Shin HR,Bray F,et al.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J].International Journal of Cancer Journal International du Cancer,2010,127(12):2893-2917.
[2] Piccart Gebhart MJ,Procter M,Leyland Jones B,et al.Trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer[J].New England Journal of Medicine,2005,353(16):1659-1672.
[3] Procter M,Suter TM,Azambujae DE,et al.Longer-term assessment of trastuzumab-related cardiac adverse events in the Herce Ptin Adjuvant(Hera)trial[J].Journal of Clinical Oncology,2010,28(28):3422-3428.
[4] Ross JS,Slodkowska EA,Symmans WF,et al.The HER-2 receptor and breast cancer:ten years of targeted anti-HER-2 therapy and personalized medicine[J].The Oncologist,2009,14(4):320-368.
[5] Ayres LR,De Almeida Campos MS,Gozzo TD,et al.Trastuzumab induced cardiotoxicity in HER2 positive breast cancer patients attended in a tertiary hospital[J].International Journal of Clinical Pharmacy,2015,37(2):365-372.
[6] Lee BL,Liedke PE,Barrios CH,et al.Breast cancer in Brazil:present status and future goals[J].Lancet Oncology,2012,13(3):95-102.
[7] Azambujae DE,Bedard PL,Suter T,et al.Cardiac toxicity with anti-HER-2 thera Pies:what have we learned so far[J].Targeted Oncology,2009,4(2):77-88.
[8] Di Cosimo S.Heart to heart with trastuzumab:a review on cardiac toxicity[J].Targeted Oncology,2011,6(4):189-195.
[9] Chien KR.HercePtin and the heart-a molecular modifier of cardiac failure[J].new England Journal of Medicine,2006,354(8):789-790.
[10] Ewer MS,Vooletich MT,Durand JB,et al.Reversibility of trastuzumab-related cardiotoxicity:new insights based on clinical course and response to medical treatment[J].Journal of Clinical Oncology,2005,23(31):7820-7826.
[11] Guarneri V,Lenihan DJ,Valero V,et al.Long-term cardiac tolerability of trastuzumab in metastatic breast cancer:the MD Anderson Cancer Center exPerience[J].Journal of Clinical Oncology,2006,24(25):4107-4115.
[12] 郑言言,王玲,陈剑琼,等.斑点追踪技术评价靶向治疗对癌症患者左心功能的影响[J].中国超声医学杂志,2012,28(11):999-1002.
[13] Seo Y,Ishizu T,Kawamura R,et al.Three-Dimensional propagation imaging of left ventricular activation by Speckle-Tracking echocardiography to predict responses to cardiac resynchronization therapy[J].Journal of the American Society of Echocardiography,2015,28(5):606-614.

