高效液相色谱法测定升血小板胶囊中靛玉红的含量
魏于杰,刘进丰,宋春丽
(蚌埠医学院第一附属医院药剂科,安徽 蚌埠 233004)
升血小板胶囊收载于《国家中成药标准汇编内科气血津液分册》[编号:WS-10028(ZD-0028)-2002][1],由青黛、仙鹤草、牡丹皮、连翘和甘草共5味药材组成,经研粉、醇提、水蒸气蒸馏和水煎等处理后,加入糊精制粒,装胶囊,即得。药理实验结果表明,升血小板胶囊具有清热解毒、凉血止血和散瘀消斑的作用,临床上主要用于原发性、特发性血小板减少性紫癜的治疗[2-5]。本研究建立了高效液相色谱法测定升血小板胶囊中靛玉红含量的方法,以保证该制剂的临床疗效。
1 材料
1.1 仪器
LC-2010 A型高效液相色谱仪(日本岛津公司);AB135-S型十万分之一天平(瑞士梅特勒-托利多仪器有限公司)。
1.2 药品与试剂
靛玉红标准品(中国食品药品检定研究院,批号:110717—200204);升血小板胶囊(陕西郝其军制药股份有限公司,批准文号:国药准字Z20025029,批号:20130625,20130702,20130709);色谱甲醇、色谱甲酸购自Fisher公司;三氯甲烷为分析纯,水为双蒸水。
2 方法与结果
2.1 色谱条件
色谱柱为依利特ODS-C18柱(150 mm×4.6 mm,5 μm);流动相为甲醇-1%甲酸溶液(V∶V=30 ∶70);柱温为30 ℃;流速为0.8 ml/min;检测波长为289 nm。
2.2 对照品溶液的制备
精密称取靛玉红对照品20.12 mg,置于250 ml圆底烧瓶中,加入三氯甲烷90 ml,水浴加热回流10 min使之溶解,后移至100 ml容量瓶中,放冷,加三氯甲烷定容至刻度,摇匀。精密量取5 ml,置于100 ml容量瓶中,加入甲醇定容至刻度,摇匀,即得(每1.0 ml含靛玉红10.06 μg)。
2.3 供试品溶液的制备
取样品20粒,拆除胶囊壳,倾出内容物,研细,混匀。取5 g,精密称定,置于具塞锥形瓶中,精密加入三氯甲烷100 ml,密塞,称定质量,加热回流2 h,放冷,称质量,用三氯甲烷补足,摇匀,滤过。精密量取续滤液5 ml,置于100 ml容量瓶中,加甲醇定容至刻度,摇匀,用0.22 μm微孔滤膜滤过,即得。
2.4 阴性样品溶液的制备
根据样品处方比例称取除青黛之外的药材,制成缺青黛的阴性制剂,再按照“2.3”项下方法处理,即得。
2.5 系统适用性试验
分别精密吸取20 μl“2.2、2.3和2.4”项下制备的对照品溶液、供试品溶液和阴性样品溶液,分别按“2.1”项下色谱条件进行测定,色谱图见图1。结果表明,靛玉红与相邻色谱峰的分离度均>1.5,理论板数靛玉红峰计算应均≥3 000。
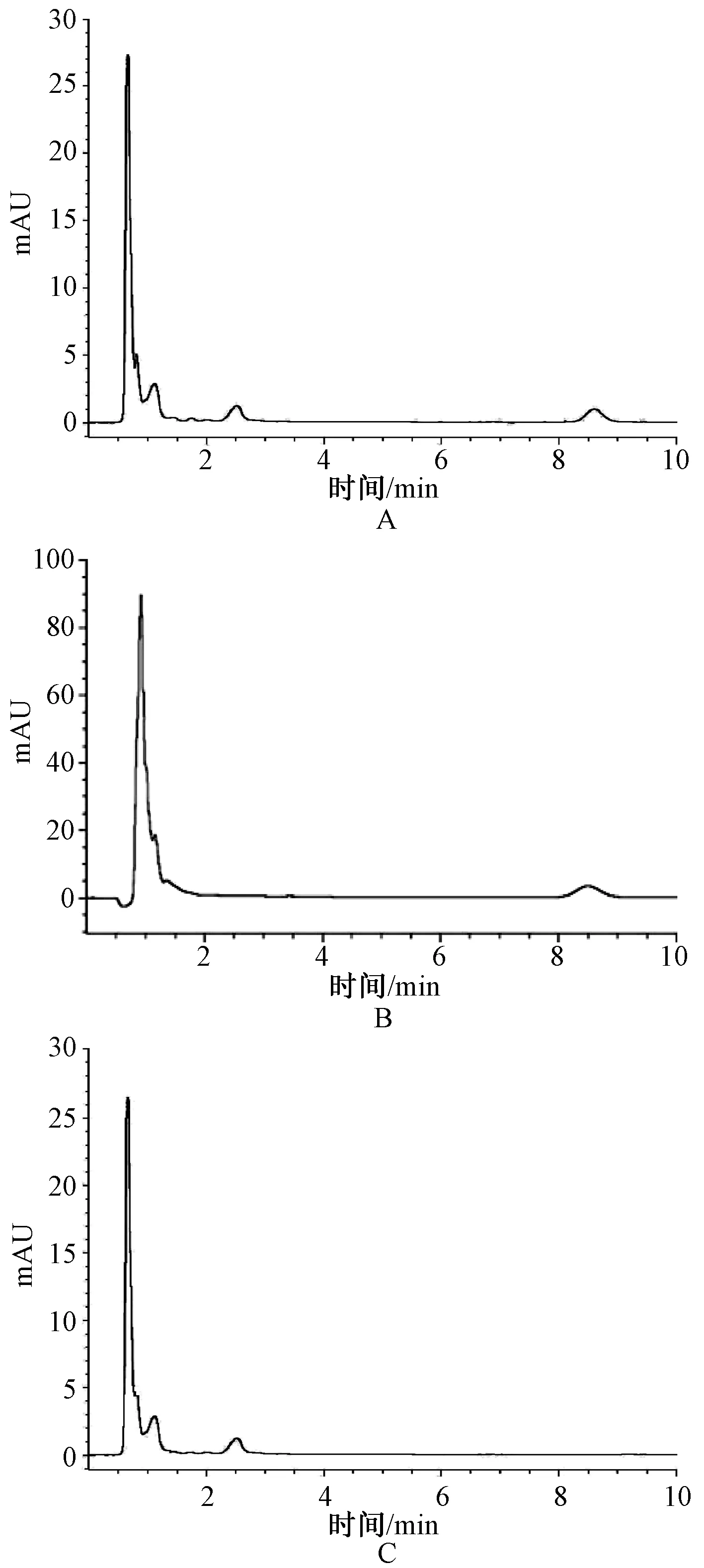
A.供试品溶液;B.对照品溶液;C.阴性样品溶液A.solution for test; B. solution for contrast; C. solution of negative sample图1 高效液相色谱图Fig 1 HPLC Chromatogram
2.6 线性关系考察
取“2.2”项下对照品溶液,分别精密量取0.2、0.5、1.0、2.0和5.0 ml,置于10 ml容量瓶中,加甲醇定容,制成一系列浓度的对照品溶液。分别精密吸取20 μl,按“2.1”项下色谱条件进样测定。以质量浓度为横坐标(X),峰面积做纵坐标(Y),得靛玉红的线性回归方程为Y=59.383X+0.221 2(r=0.999 9)。结果表明,靛玉红质量浓度在0.20~5.08 μg/ml范围内与峰面积呈良好的线性关系。
2.7 精密度试验
连续5次精密吸取低、中及高质量浓度(1.44、1.80及2.16 μg/ml)的对照品溶液各20 μl,按“2.1”项下色谱条件进样测定。结果低、中及高质量浓度下的RSD分别为0.75%、0.94%及1.42%,表明仪器精密度良好。
2.8 稳定性试验
取样品(批号:20130625)适量,按照“2.3”项下方法制备供试品溶液,分别于室温(25 ℃)下放置0、2、4、8、12和24 h时,精密吸取20 μl,按“2.1”项下色谱条件进样测定。结果表明,供试品溶液在24 h内稳定性良好,RSD为1.37%。
2.9 重现性试验
取样品(批号:20130625)适量,按照“2.3”项下方法制备供试品溶液,精密吸取20 μl,再按“2.1”项下色谱条件进样测定,平行操作5次。结果表明,靛玉红的平均含量为0.321 5 mg/粒,RSD为0.82%,表明本方法重现性良好。
2.10 加样回收率试验
取含量已知的本品内容物(0.321 5 mg/粒)9份,每份约2.5 g,精密称定,分别精密加入对照品溶液(1.016 μg/ml)1.6、2.0和2.4 ml,再分别精密加入三氯甲烷98.4、98.0和97.6 ml,按“2.3”项下方法制备供试品溶液,精密吸取20 μl进样测定。回收率=(实测值-样品含量)/加入量×100%,结果见表1。
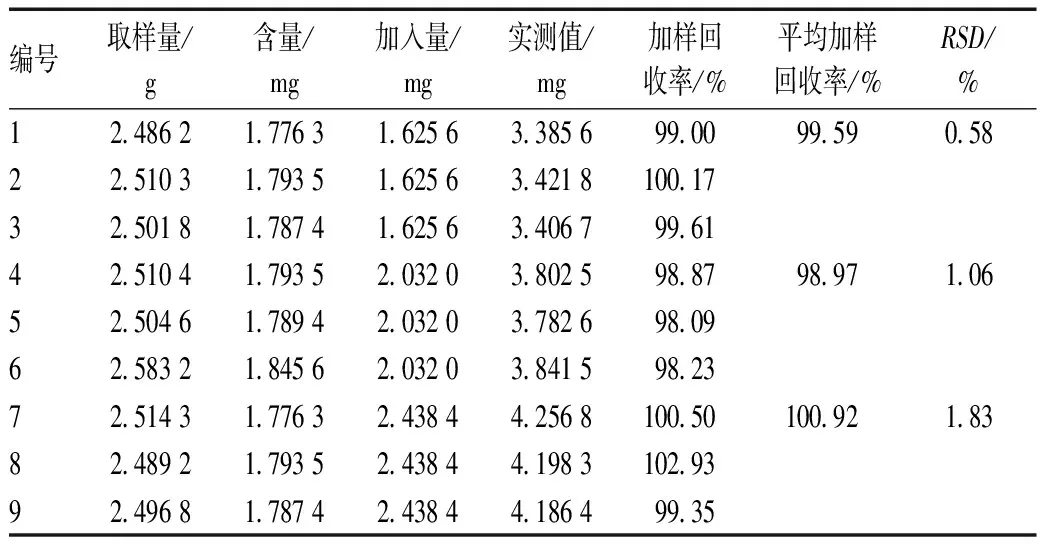
表1 加样回收率试验结果Tab 1 Results of recovery rate test of sample addition
2.11 含量测定结果
取样品适量,按“2.3”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,计算靛玉红的含量,结果见表2。

表2 靛玉红的含量测定结果
3 讨论
目前,靛玉红的含量测定方法包括氧化滴定法、直接比色法、薄层色谱扫描法、双波长分光光度法、高效液相色谱法和液相色谱质谱联用法等[6-10]。原制剂标准[1]仅采用薄层色
谱扫描法对靛玉红(青黛的有效成分)进行含量测定。为了提高制剂的质量控制标准,更加准确地控制药品质量,参考相关文献[11],本研究采用高效液相色谱法对其进行测定,本方法操作简便,结果准确,可用于靛玉红的含量测定。
靛玉红可溶于乙酸乙酯、丙酮、三氯甲烷和乙醚,不溶于水,微溶于乙醇[12]。由于薄层扫描法测定靛玉红含量时选用的提取溶剂是三氯甲烷,本研究仍选用三氯甲烷做为提取溶剂。
参照相关文献[13-15],本研究对流动相(乙腈、甲醇、水和有机酸等)的组成和比例进行筛选优化。结果发现,流动相为甲醇-1%甲酸溶液(V∶V=30 ∶70)时,色谱图中靛玉红的峰型对称,与相邻色谱峰的分离度较好,且分析时间适宜。
[1]国家药品监督管理局.国家中成药标准汇编内科气血津液分册[S].北京:国家药品监督管理局,2002:580.
[2]叶华觅,郝建萍,赵芳,等.升血小板胶囊联合激素治疗特发性血小板减少性紫癜有效性的系统评价[J].中国循证医学杂志,2013,13(7):852-857.
[3]韩小月,程熠,王芳.升血小板胶囊治疗儿童特发性血小板减少性紫癜的作用观察[J].华中医学杂志,2008,32(4):273-274.
[4]蔡晓辉,许艳春.升血小板胶囊配合护理干预治疗特发性血小板减少性紫癜[J].长春中医药大学学报,2016,32(2):344-346.
[5]阎玮兰,王涛,刘朵平,等.升血小板胶囊对肿瘤患者化疗后血小板恢复作用的疗效研究[J].中国药物与临床,2016,16(11):1605-1606.
[6]张微微,谭晓川,车宏伟,等.高效液相色谱法测定疏清浸膏中靛玉红的含量[J].中国医院用药评价与分析,2017,17(1):88-89,92.
[7]钱嘉,张兴德,夏勤,等.清凉膏中靛玉红的含量测定[J].中国肿瘤外科杂志,2010,2(4):241-242,246.
[8]刘越,罗定强,康荣,等.HPLC法测定口腔溃疡含片(散)中靛蓝和靛玉红的含量[J].安徽医药,2016,20(3):462-466.
[9]程江雪,唐志书,王晓娟,等.兰花抗病毒颗粒中靛玉红的含量测定[J].现代中医药,2013,33(3):114-116.
[10] 程佩佩,夏叶,方玉,等.不同产地及不同药用部位马蓝中靛蓝和靛玉红的含量测定[J].医药导报,2015,34(10):1363-1366.
[11] 孙晓迪,谢予朋,李秀敏,等.HPLC法测定尿路消炎合剂中靛玉红的含量[J].中医药导报,2016,22(13):104-106.
[12] 张青松,尹文清,陈柳生,等.青黛中靛玉红提取溶剂的改进[J].广西师范大学学报:自然科学版,2006,24(3):58-60.
[13] 张红梅,鲁杨,白妮.双波长HPLC法同时测定鼻渊宁颗粒中栀子苷和靛玉红的含量[J].中国药房,2014,25(43):4088-4090.
[14] 刘峰.黛蛤散中有效成分靛玉红的含量测定[J].中国药物警戒,2014,11(3):158-159.
[15] 李海怡,黎艳光,梁青云,等.菘蓝根茎叶中靛蓝和靛玉红的提取及含量的比较[J].广东化工,2016,43(2):27-28.

