靶向NS4B抑制剂安非合韦的有关物质测定
陶 鑫 袁 红 焦丹丹
(常州寅盛药业有限公司,江苏 常州 213003;*苏州大学附属儿童医院,江苏 苏州 215000)
慢性丙型肝炎是由丙肝病毒(HCV)引起的一种传染性疾病。目前国际国内研究较多的为NS5A、NS5B、NS3/4这三个靶点,针对NS4B的小分子抑制剂的开发起步较晚,目前没有相关的药物在临床研究阶段。2008年,斯坦福大学的研究人员发现了第一个HCV NS4B抑制剂克立咪唑(Clemizole),该化合物可通过干扰NS4B的富精氨酸区域(arginine rich motif, ARM)与病毒负链RNA的相互作用而抑制病毒的复制[1]。但由于化合物明显的细胞毒性及细胞水平的低活性(基因型2a复制子EC50=8μM),使其终止于Ⅰ期临床。在2010年,斯坦福大学的研究人员报道了另一个NS4B抑制剂Anguizole,该化合物可通过与蛋白质第二个双亲螺旋(4BAH2)作用,抑制脂质囊泡的聚集,从而抑制病毒的复制[2,3]。随后,以此结构出发,葛兰素史克进行大量的结构优化发现了高活性的NS4B抑制剂[4,5],而在2013年,PTC[6,7]、Pharmasset[8]及Gilead公司[9]也相继报道了具有相同机制的NS4B抑制剂。但这些药物由于口服吸收差等问题均已停止临床开发。
我公司开发的安非合韦为苯并呋喃类的全新的具有自主知识产权NS4B抑制剂,该药物已在中国获批临床并正在开展临床试验。因此,安非合韦目前是针对丙肝NS4B靶点的唯一一个临床阶段的药物,若获批生产,将成为First-in-class的药物。本文建立了安非合韦有关物质的检测方法。
1 仪器与试药
安捷伦1260 液相色谱仪带紫外检测器(G1314F)和DAD双检测器,G1316A柱温箱,EZChrom色谱工作站。安非合韦自制对照品(含量99.38%),安非合韦(批号为201403-03-141207, 201403-03-141208,201403-03-141209,由常州寅盛药业有限公司生产);纯化水;乙腈为色谱级;磷酸为国产分析纯。
2 方法与结果
2.1 色谱条件与系统适用性试验
采用Thermo BDS HYPERSIL C18(4.60×250 mm, 5.0 μm色谱柱,用等度洗脱的方式,流动相0.1%磷酸水溶液∶乙腈=5∶5,照中国药典高效液相色谱法的要求进行检测。检测波长为210 nm,柱温40 ℃,流速1.0 mL·min-1,进样体积10 μL。系统适应性测试为在平衡色谱系统后,基线应有最小的噪音和漂移,按照空白1针,对照溶液(ST)5针,杂质对照溶液(IMPST)1针,样品溶液(SP)1针,对照溶液(ST)1针的顺序进行分析,对照溶液主峰的理论塔板数应不得低于3000,对照溶液中主峰拖尾因子应不大于2.0,六针对照溶液中主峰的峰面积RSD应不大于2.0%。
2.2 溶液配制及检测
取安非合韦供试品30 mg,精密称定,放入100 mL容量瓶中,加稀释液(乙腈∶水=5∶5)溶解并稀释至刻度,混匀即得浓度为0.3 mg·mL-1样品溶液。照色谱条件,自动进样10 μL,记录色谱图,按面积归一化法计算。稀释剂空白色谱图谱见图1,安非合韦样品图谱见图2。

图1 稀释剂空白色谱图Fig 1 Chromatogram of Blank

图2 安非合韦样品色谱图Fig 2 Chromatogram of Amphihevir API
2.3 专属性
称取适量样品,分别加入酸(1 mol/L盐酸)、碱(1 mol/L氢氧化钠)和氧化(30%双氧水)1 mL,置80 ℃水浴中加热1 h,取出冷却至室温,用稀释液溶解并定容至刻度。分别称取高温(60℃)、高湿(92.5RH%)、强光(4 500 Lx±500 Lx)下5 d,10 d的适量样品,用稀释液溶解并定容至刻度。分别将6种不同条件破坏后制备的样品按选定的色谱条件,进样10 μL,考察安非合韦的杂质专属性。结果显示安非合韦与降解物质均能较好的分离,且主峰峰纯度均为0.95以上,没有包裹杂质。酸、碱、氧化破坏见色谱图3~5,高温、高湿和强光破坏10天的色谱图见图6~8。
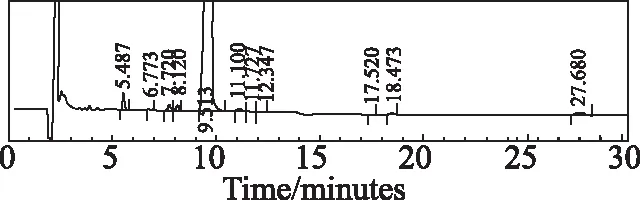
图3 安非合韦酸破坏(1 mol/L盐酸)色谱图Fig 3 Chromatogram of Amphihevir degraded by acid (1N hydrochloric acid solution)

图4 安非合韦碱破坏碱(1 mol/L氢氧化钠)色谱图Fig 4 Chromatogram of Amphihevir degraded by alkali (1N sodium hydroxide solution)
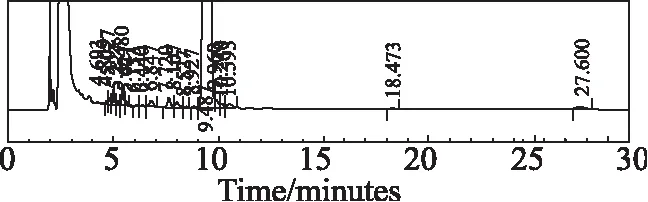
图5 安非合韦氧化破坏碱(30%双氧水)色谱图Fig 5 Chromatogram of Amphihevir degraded by oxidation (30% H2O2 solution)
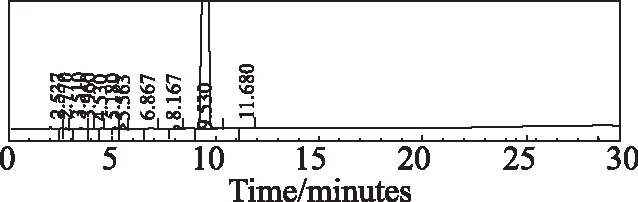
图6 安非合韦高温(60 ℃,10 d)破坏色谱图Fig 6 Chromatogram of Amphihevir degraded by high temperature (60 ℃,10 days)
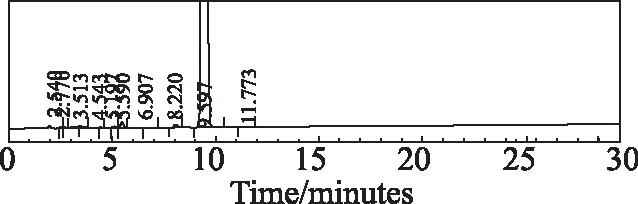
图7 安非合韦高湿(92.5RH%,10 d)破坏色谱图Fig 7 Chromatogram of Amphihevir degraded by high humidity (92.5RH%,10days)
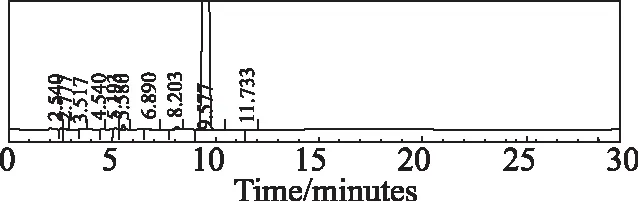
图8 安非合韦强光(4 500 Lx±500 Lx,10 d)破坏色谱图Fig 8 Chromatogram of Amphihevir degraded by highlight (4 500 Lx±500 Lx,10 days)
2.4 定量限和检测限
配制多个较低浓度水平的安非合韦溶液,分别进行检测,当信噪比为3左右即确定为检测限,当信噪比为10左右即确定为定量限。测得的结果显示,安非合韦检测限位0.008 99 μg·mL-1,定量限为0.029 98 μg·mL-1。
2.5 重复性及中间精密度
通过一份样品,重复进样6针检测确认测定方法的重复性,并由另一个操作者重复进样3针,共9针确认安非合韦有关物质测定方法的中间精密度。本品有关物质方法的重复性RSD为0.01%,中间精密度RSD为0,重复性和中间精密度良好。
2.6 溶液稳定性
配制一份供试品溶液,将该溶液在常温下分别放置不同的时间,分别按照选定的色谱条件进样,记录谱图,以此来考察溶液的稳定性。安非合韦主峰峰面积的RSD为0.61%,样品在24 h内稳定。
2.7 方法耐用性
通过改变不同HPLC条件如流速、柱温、流动相配比来评估测定条件有微小的变动时,判断结果受影响的程度,以此来判断方法的耐用性。结果显示,流速为0.9~1.1 mL·min-1,流动相0.1%磷酸水溶液∶乙腈配比变化为4∶6或6∶4,理论塔板数均大于18 000,拖尾因子均小于1.078,分离度均大于3.0,均符合检测要求,方法耐用性良好。
2.8 样品的测定
按照HPLC有关物质的测定方法,分别对常州寅盛药业有限公司生产的三批中试规模样品进行了测试,批号为批号为201403-03-141207, 201403-03-141208,201403-03-141209,3批样品纯度分别为99.53%,99.44%和99.43%,最大单个杂质分别为0.15%,0.15%和0.21%。最大单杂和总杂均符合临床申报质量标准的要求。
3 讨 论
3.1 安非合韦有关物质的方法开发
波长的选择:对安非合韦合成工艺的起始原料、中间体及成品均进行了DAD全波长扫描,考察了各已知杂质组分的吸收波长,安非合韦的最大吸收在220 nm左右,主要起始原料和中间体的最大吸收在205 nm左右,但是考虑到205 nm波长处基线不稳,综合考虑决定选择210 nm作为有关物质的检测波长。
色谱柱的选择:通过改变色谱柱型号,根据理论塔板数和拖尾因子来判定柱子的选择。筛选了依利特、Waters、Thermo和Kromasil的C18柱,由测试数据可知,选用Thermo C18、KromasilC18色谱柱时,各峰理论塔板数均高于其他色谱柱,分离度也较好,因此可选用Thermo C18、KromasilC18色谱柱作为检测所用色谱柱。
3.2 后续方法开发
安非合韦属于1.1类创新药物,目前处于临床阶段,尚未对杂质进行全面研究。在后续开发中,我们将按照ICH指南、CDE相关药学研究指南和中国药典的要求,争取最大程度减少工艺中超过0.1%限度的杂质,若超过,则对杂质进行鉴定研究以及必要的毒理学研究。本文的研究可为后续方法开发提供一定的理论基础,并为创新药物的质量标准研究提供一些参考。
[1] Einav, S., Gerber, D., Bryson, P.D., et al. Discovery of a hepatitis C target and its pharmacological inhibitors by microfluidic affinity analysis. Nat Biotechnol , 2008 26(9):1 019~1 027.
[2] Cho, N.J., Dvory-Sobol, H., Lee, C., et al. Identification of a class of HCV inhibitors directed against the nonstructural protein NS4B. Sci Transl Med, 2010 2(15):15~16.
[3] Bryson, P.D., Cho, N.J., Einav, S., et al. A small molecule inhibits HCV replication and alters NS4B's subcellular distribution. Antiviral Res, 2010 87(1):1~8.
[4] Shotwell, J.B., Baskaran, S., Chong, P., et al. Imidazo[1,2-a]pyridines That Directly Interact with Hepatitis C NS4B: Initial Preclinical Characterization. ACS Med Chem Lett, 2012 3(3):565~569.
[5] Miller, J.F., Chong, P.Y., Shotwell, J.B., et al. Hepatitis C Replication Inhibitors That Target the Viral NS4B Protein. J Med Chem, 2014 57(5):2 107~2 120.
[6] Gu, Z., Graci, J.D., Lahser, F.C., et al. Identification of PTC725, an orally bioavailable small molecule that selectively targets the hepatitis C Virus NS4B protein. Antimicrob Agents Chemother, 2013 57(7):3 250~3 261.
[7] Zhang, N., Zhang, X., Zhu, J., et al.Structure-Activity Relationship (SAR) Optimization of 6-(Indol-2-yl)pyridine-3-sulfonamides: Identification of Potent, Selective, and Orally Bioavailable Small Molecules Targeting Hepatitis C (HCV) NS4B. J Med Chem, 2014 57(5):2 121~2 135.
[8] Kakarla, R., Liu, J., Naduthambi, D., et al. Discovery of a Novel Class of Potent HCV NS4B Inhibitors: SAR Studies on Piperazinone Derivatives. J Med Chem, 2014 57(5):2 136~2 160.
[9] Phillips, B., Cai, R., Delaney, W., et al.Highly Potent HCV NS4B Inhibitors with Activity against Multiple Genotypes. J Med Chem,2014 57(5):2 161~2 166.

