高低镉积累棉花品种生理生化特性研究
欧阳燕莎,刘爱玉,李瑞莲,刘浩然
(湖南农业大学 棉花研究所,湖南 长沙 410128)
目前,随着工农业的发展,环境受到污染的程度越来越严重,已成为国内外普遍关注的环境问题之一[1]。土壤重金属污染一直都是严峻的问题,植物在重金属污染的土壤中会富集重金属,进而通过食物链进入人体,危害人体健康,因此,土壤污染越来越受到国内外各学者的重视[2]。
植物清除重金属毒害的重要成分可能是植株内的谷胱甘肽(GSH)、非蛋白巯基(NPT)、金属硫蛋白(MT)和植物螯合肽(PCs)等含巯基类化合物,在一定水平上能使植株对逆境的耐受能力提高[3]。有研究报道,GSH 和 Cys 在非超积累植物对重金属的耐性中起着重要的作用[4]。另有研究显示,螯合金属离子是植株体内细胞消除其毒害的重要途径之一,其机理主要是通过金属硫蛋白(Metallothionein,MT)和植物螯合肽(Phytochelatins,PCs) 与重金属离子结合,形成硫肽复合物达到使游离态金属离子浓度降低的目的,因而使植物对金属的耐受能力得到提高[5]。然而镉胁迫下对棉苗植株各器官含巯基类物质的影响却鲜有报道。本试验在前期研究的基础上,选择镉低积累品种(单16)和镉高积累品种(11-20)为研究对象,研究不同镉浓度下棉苗各器官中GSH、NPT、PCs和MT含量,初步探索棉苗含巯基肽类物质的含量变化,为修复植物的选育提供试验依据。
1 材料和方法
试验于2016年在湖南农业大学校内科研基地进行,育苗池位于大棚内。
1.1 试验材料
前期试验筛选出的镉低积累品种(单16)和镉高积累品种(11-20)均由湖南农业大学棉花研究所提供。
1.2 试验方法
采用漂浮育苗方式进行,选取饱满均一的棉花种子,播种于填满基质的育苗盘中,放入装有营养液的塑料盆中,待幼苗长出2片真叶后,挑选长势一致的幼苗放入装有CdCl2的塑料盆中,使营养液中的镉浓度达到所设置的浓度。设3个镉浓度处理,分别为0(CK),150,300 μmol/L。先配制成1 mol/L的CdCl2溶液,在育苗池加入等量自来水,再按设计浓度加入相应量的CdCl2溶液,使育苗营养液Cd浓度达到所设置浓度,隔6 d换一次水溶液,期间定期使水溶液保持在同一水平。
1.3 取样测定
取样:四叶一心时进行一次性取样,取各处理的棉花幼苗用去离子水冲洗干净,再用20 mmol/L Na2-EDTA 浸泡15 min,去除植物根系吸附的镉,自来水冲洗3次,最后用去离子水润洗,吸干表面水分,分成根、茎、叶3个部分,保存于-20 ℃冰箱内备用。
非蛋白巯基(NPT):采用DTNB法测定[6];谷胱甘肽(GSH):采用DTNB法测定[7];采用差减法计算[8]:植物螯合肽(PCs)含量(PCs)=NPT总量-GSH含量;金属硫蛋白(MT):采用DTNB法测定[9-10]。
1.4 数据处理与统计分析
应用Excel 2013和SPSS等软件作统计分析。
2 结果与分析
2.1 非蛋白巯基含量变化
在根中,与对照相比,无论是镉低积累品种单16还是高积累品种11-20,随着镉处理浓度提高,棉苗根中NPT含量(以鲜质量计)提高。在150 μmol/L镉处理时,单16和11-20这2个品种与各自对照相比,根中NPT含量分别增加了37.55%和7.07%;在300 μmol/L镉处理时,与各自对照相比,单16和11-20这2个品种棉苗根部NPT含量分别增加了45.75%和29.20%。单16根中NPT含量显著高于11-20(图1)。根作为植物生长的重要组织器官,且首先接触重金属离子,高镉浓度处理下,根中合成更多的巯基物质与镉络合,达到缓解对植物根系的毒害目的,以使其正常生长[11]。11-20根NPT增加幅度差异大于单16,可能是镉低积累品种耐镉的原因之一。
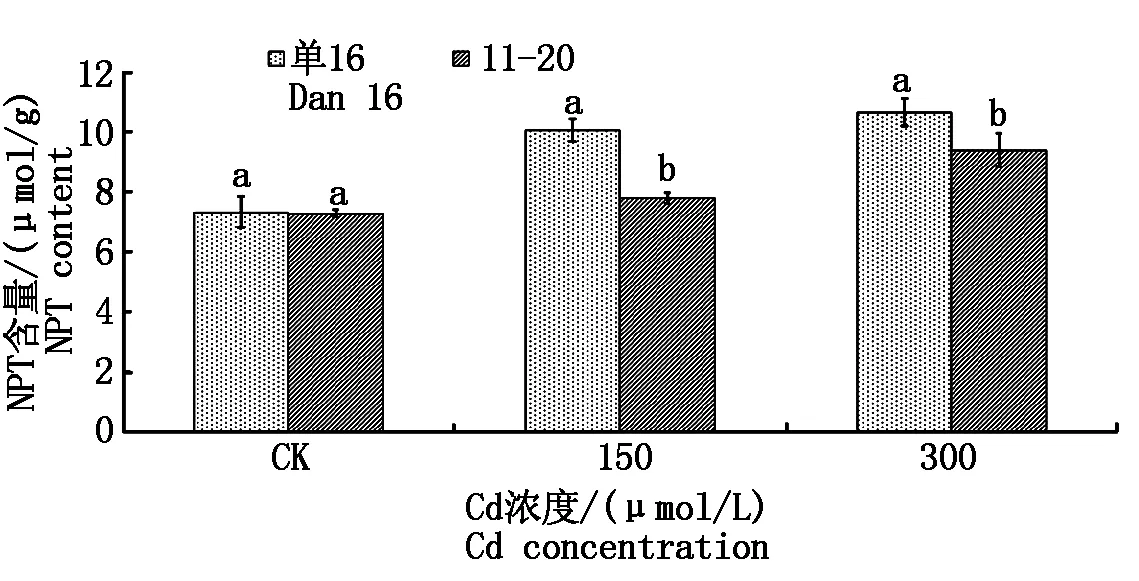
同一镉浓度小写字母不同者表示品种间在0.05水平上显著。图2-12同。Different low letters at each Cd treatment indicate the significant difference between varieties at P<0.05.The same as Fig.2-12.
单16和11-20棉苗茎内NPT含量(以鲜质量计)均以150 μmol/L镉处理最高(图2)。均在150 μmol/L镉处理下,与各自对照相比,单16和11-20茎中NPT含量分别增加了12.73%和18.34%;在300 μmol/L镉处理下,与各自对照相比,单16和11-20茎NPT含量分别增加了9.75%和12.65%。两品种茎中NPT含量在高浓度(300 μmol/L)处理较低浓度(150 μmol/L)镉处理均略有下降。这可能是在镉胁迫下棉苗启动自身防御机制,重金属诱导植株合成NPT,并与Cd2+螯合形成硫肽复合物,形成细胞区室化[11]。但整体表现为11-20茎NPT含量高于单16,说明高积累品种合成更多的含琉基的物质与镉络合,解毒能力较低积累品种强,因此能吸收更多的镉。

图2 Cd处理棉苗茎中NPT含量Fig.2 NPT content in cotton seedling stem under Cd treatment
棉苗叶中NPT含量(以鲜质量计)在0 μmol/L镉处理下两品种无显著差异;低隔积累品种单16在150 μmol/L镉处理下显著低于11-20,而在300 μmol/L镉处理下则显著高于11-20,但在2种浓度下均高于各自对照(图3)。在150 μmol/L镉处理下,与各自对照相比,单16和11-20叶NPT含量分别增加了36.33%和34.9%;在300 μmol/L镉处理下,与各自对照相比,单16和11-20叶NPT含量分别增加了40.67%和28.18%。

图3 Cd处理棉苗叶中NPT含量Fig.3 NPT content in cotton seedling leaf under Cd treatment
由图1-3可以看出,镉处理浓度由150 μmol/L提高到300 μmol/L时,两品种根中NPT含量增加,茎中NPT含量略有下降,而在叶片中的NPT含量,表现为单16略增加,11-20略降低。NPT含量在各器官的分配表现为根>茎>叶,其对镉的解毒亦相应成正比。
2.2 谷胱甘肽含量变化
如图4所示,棉苗根中GSH含量(以鲜质量计)均随着镉浓度的增加先升高后下降。棉苗根中谷胱甘肽含量在150 μmol/L镉处理下达到最大,单16和11-20根GSH含量与各自对照相比分别约上升6.61%和11.71%;在300 μmol/L镉处理下GSH含量降低,与对照相比,单16和11-20根GSH含量分别下降了约0.66%和4.81%。
如图5所示,棉苗茎中GSH含量(以鲜质量计)均呈现先下降再上升的趋势,11-20茎GSH含量高于单16。在150 μmol/L镉处理下,与各自对照相比,单16和11-20茎GSH含量分别约降低9.87%,14.10%;在300 μmol/L镉处理下,与对照相比,单16和11-20茎GSH含量分别上升了约1.30%和15.36%。

图4 Cd处理棉苗根中GSH含量Fig.4 GSH content in cotton seedling root under Cd treatment

图5 Cd处理棉苗茎中GSH含量Fig.5 GSH content in cotton seedling stem under Cd treatment
在150 μmol/L镉处理下,与各自对照相比,单16叶中GSH含量(以鲜质量计)约降低33.56%,11-20增加了25.02%;在300 μmol/L镉处理下,与对照相比,单16和11-20叶GSH含量分别约降低6.46%和8.86%。单16叶GSH含量先下降再上升,11-20叶GSH含量则先上升后下降。这可能是由于镉低积累品种中GSH被用于合成了PCs,后又随着浓度的增加使得GSH增加(图6)。

图6 Cd处理棉苗叶中GSH含量Fig.6 GSH content in cotton seedling leaf under Cd treatment
2.3 植物螯合肽含量变化
如图7所示,两棉花品种根中PCs含量(以鲜质量计)均随着镉浓度的增加而增加。在150 μmol/L镉处理下,与各自对照相比,单16和11-20分别约上升38.8%,3.96%;在300 μmol/L镉处理下,单16和11-20分别约上升49.34%,11.95%。镉胁迫下,11-20根中PCs含量显著低于单16。

图7 Cd处理棉苗根的PCs含量Fig.7 PCs content in cotton seedling root under Cd treatment
如图8所示,棉苗茎中PCs含量(以鲜质量计)变化同根相似,与对照相比,均随着镉浓度的增加而增加,11-20根中PCs含量显著高于单16。在150 μmol/L镉处理下,与各自对照相比,单16和11-20分别约上升14.95%和39.07%;在300 μmol/L镉处理下,与各自对照相比,单16和11-20分别约上升17.07%和28.49%。

图8 Cd处理棉苗茎的PCs含量Fig.8 PCs content in cotton seedling stem under Cd treatment
如图9所示,棉苗叶中PCs含量(以鲜质量计)随着镉浓度的增加先增加,后趋于平缓,11-20根中PCs含量显著低于单16。在150 μmol/L镉处理下,与各自对照相比,单16和11-20分别约上升50.69%,36.51%;在300 μmol/L镉处理下,单16和11-20分别约上升50.79%和33.78%。棉苗各器官PCs合成量分布表现为根>茎>叶。

图9 Cd处理棉苗叶的PCs含量Fig.9 PCs content in cotton seedling leaf under Cd treatment
2.4 金属硫蛋白含量变化
由图10-12可知,随着镉浓度的增加,棉苗根、茎和叶中MT含量(以鲜质量计)增加,且品种间差异显著。棉苗根中,与对照相比,单16和11-20分别增加6.42%,10.22%(150 μmol/L镉处理下)和9.93%,16.88%(300 μmol/L镉处理下)。棉苗茎中,与对照相比,单16和11-20分别增加15.24%,25.8%(150 μmol/L镉处理下)和2.91%,15.91%(300 μmol/L镉处理下)。棉苗叶中,与对照相比,单16和11-20分别增加4.56%,16.92%(150 μmol/L镉处理下)和5.34%,16.61%(300 μmol/L镉处理下)。可见较高浓度(300 μmol/L)处理可诱导MT合成量增加,且表现为叶>茎>根。

图10 Cd处理棉苗根MT含量Fig.10 MT content in cotton seedling root under Cd treatment

图11 Cd处理棉苗茎的MT含量Fig.11 MT content in cotton seedling stem under Cd treatment

图12 Cd处理棉苗叶的MT含量Fig.12 MT content in cotton seedling leaf under Cd treatment
3 讨论
非蛋白巯基等含硫化合物在非超积累植物对重金属的耐性中起着重要的作用[12-13]。植物体内含巯基肽类物质含量的产生与重金属的浓度有关。本研究结果显示,Cd处理提高了棉苗根、茎和叶中NPT含量,根中NPT含量11-20显著低于单16,与黄志亮[14]研究结果类似,茎中NPT含量11-20显著高于单16,叶中NPT含量在镉处理浓度由150 μmol/L提高到300 μmol/L,表现为单16略增加,11-20略降低。棉苗根中GSH含量表现为先增后减,茎中则表现为先减后增,均为11-20品种GSH含量高于单16,叶片则没有一定规律性。棉苗各器官中PCs含量随着镉浓度的增加而增加。棉苗根和叶中PCs含量均为单16显著高于11-20,茎中PCs含量则相反。11-20和单16棉花品种 NPT、PCs 和 GSH 含量均高于地上部,可能由于根系是最先接触或受到Cd2+胁迫的植物器官;随着时间延长,植物往上运输重金属离子,因此,根系诱导合成巯基类化合物早于地上部合成,积累量相应的高于地上部,这与何娇、吴惠芳等[11,15]的研究结果相似。2个棉花品种NPT、PCs 和 GSH 含量均表现为根>茎>叶,这被认为是Cd2+胁迫下PCs在根部大量积累,与Stolt等[16]的研究相一致。此外,有些研究表明,含巯基化合物在植株体内对重金属不但具有重要的解毒作用,并且还具有促进Cd从根系向地上部长距离输送的功能[17-18]。这也许是镉高积累棉花品种镉积累量较高的原因之一。
有研究从已纯化的MT蛋白序列结合基因分析,证实MT基因可编码蛋白[19]。在一般情况下,根系中主要表达的是MT1基因,而叶中RNA水平较高的是MT2和MT3,MT4基因(包括小麦Ec)在种子中转录表达[19]。本研究结果表明,棉苗MT含量随着镉浓度的增加而增加,可见较高浓度的镉(300 μmol/L)处理可诱导MT合成量增加,且表现为叶>茎>根,这与Singh等[20]研究不一致。何娇等[11]、吴惠芳等[15]研究结果表明,根系MT 含量高于地上部。这可能是由于不同重金属所诱导的MT基因不同所致,镉诱导叶中的MT基因表达,大量合成MT。
[1] 王海鸥,钟广蓉,刘晓峰,等.小麦在铜、镉胁迫下体内含巯基物质对解毒机制的研究[J].华北农学报, 2008, 23(3): 158-161.
[2] 黄秋月.镉对稻苗生长影响初探及稻苗中金属硫蛋白的分离纯化[D].武汉:武汉轻工大学,2013.
[3] 史 静,潘根兴.外加镉对水稻镉吸收、亚细胞分布及非蛋白巯基含量的影响[J].生态环境学报, 2015, 24(5): 853-859.
[4] 高可辉,葛 滢,张春华.缺硫对镉胁迫下水稻幼苗非蛋白巯基物质含量和谷胱甘肽硫转移酶活性的影响[J].应用生态学报, 2011, 22(7): 1796-1802.
[5] Ernst W O, Krauss G J, Verkleij J C, et al. Inter-action of heavy metals with the sulphur metabolism in angiosperms from an ecological point of view[J]. Plant Cell and Environment, 2008, 31(1): 123-143.
[6] Rama D S,Rasad M N V. Copper toxicity inCeratophyllumdemersumL.(coontail),a ree floating macrophyte: response of antioxidant enzymes and antioxidants[J]. Plant Science, 1998, 138(2): 157-165.
[7] 李 玲,李娘辉,蒋素梅.植物生理学模块实验指导[M].北京:科学出版社, 2009: 100-103.
[8] Bhargava P, Srivastava A K, Urmil S, et al. Phytochelatin plays a role in UV-B tolerance in N2-fixing cyanobacteriumAnabaenadoliolum[J]. Journal of Plant Physiology, 2005, 162(11): 1220-1225.
[9] 王 黎,于立博,刘继文.新疆部分植物金属硫蛋白含量测定[J].新疆医科大学学报, 2012, 35(11): 1486-1489.
[10] 吴云辉,王俊坤,孙继鹏,等. DTNB比色法测定金属硫蛋白含量[J].食品科学, 2013, 34(16): 196-199.
[11] 何 娇,何 玉,黄楚乔,等.铯对印度芥菜和菊苣植物螯合肽和金属硫蛋白含量的影响[J].生态毒理学报, 2016, 11(3): 272-280.
[12] CobbettC T. Phytochelatins and their roles in heavy metal detoxification[J]. Plant Physiol, 2000,123(3):825-832.
[13] Salt D E, Smith R D, Raskin I. Phytoremediation annu rev plant physiol plant mol[J]. Biol,1998,49:643-668.
[14] 黄志亮.镉低积累蔬菜品种筛选及其镉积累与生理生化特性研究[D].武汉:华中农业大学, 2012.
[15] 吴惠芳,龚春风,刘 鹏,等.锰胁迫下龙葵和小飞蓬根叶中植物螯合肽和类金属硫蛋白的变化[J].环境科学学报, 2010, 30(10): 2058-2064.
[16] Stolt J P, Sneller F E C, Bryngelsson T, et al. Phytochelatin and cadmium accumulation in wheat[J].Environ Exp Bot,2003,49(1):21-28.

[18] Wei Z G, Wong J W, Zhao H Y, et al. Separation and determination of heavy metals associated with low molecular weight chelators in xylem saps of Indian mustard (Brassicajuncea) by size exclusion chromatography and atomic absorption spectrometry[J]. Biological Trace Element Research, 2007, 118(2): 146-158.
[19] Goldsbrough P B. Metal tolerancein plants: The role of phytochelatins and metallothioneins[M].US:Lewis Publishers, 2000:221- 235.
[20] Singh R K, Anandhan S, Singh S, et al. Metallothionein-like gene from Cicer microphyllum is regulated by multiple abiotic stresses[J]. Protoplasma, 2011, 248(4): 839-847.

