新型紫色大白菜15NG28后代的鉴别及其转录组分析
张德双,赵 泓,张凤兰,余阳俊,赵岫云,于拴仓,汪维红,苏同兵,卢桂香
(北京市农林科学院 蔬菜研究中心,北京 100097)
大白菜(Brassica.rapaL.ssp.pekinensis)起源于中国,种质资源丰富、生态类型多样,是名副其实的大众化蔬菜。随着居民生活质量的提高和家庭消费模式、人口结构的改变,大白菜富含的蛋白质、糖、氨基酸、维生素C、膳食纤维、胡萝卜素以及花青苷等营养品质日益受到国内外学者的重视。大白菜品种类型多样,继黄心、桔红心大白菜后,近几年育种家又成功选育出紫色叶球大白菜。紫色叶球大白菜色泽艳丽、风味独特,富含花青苷等营养成分,逐渐被消费者接纳和喜爱。植物体内的花青素为水溶性色素,在自然条件下不能稳定存在,常常结合一个或多个糖苷,形成花青苷。花青苷是黄酮类次生代谢产物,在植物细胞的内质网上合成,然后运输到液泡并积累,可以引起植物的叶片、花薹、根茎和种荚等呈现紫色、红色、蓝色和粉色等颜色,如甘蓝类的紫红色甘蓝、紫色羽衣甘蓝、紫色苤蓝和白菜类的红菜薹、紫色小白菜和紫红色芜菁等。花青苷具有吸引昆虫传粉和抵御低温、紫外线伤害以及防治植物病害等多种生理功能;也具有抗氧化衰老、抗癌、抗动脉硬化,减少夜盲症和预防近视,防止神经紊乱以及增强人体免疫力等重要的医疗保健功能;花青素还是一种安全的天然食用色素。花青素是迄今为止所发现的最强效的自由基清除剂,抗自由基氧化能力是VC的20倍、VE的50倍,并且对光、热和氧等稳定性好。因此,花青素在园艺、医药、化妆及食品等方面具有重要的应用价值和研究意义[1]。
目前,紫色大白菜来源主要有4种:紫红色芥菜[2]、紫色小白菜[3-6]、紫菜薹[7]和紫红色芜菁[8]。在国内,已育成紫罗兰、紫冠一号、紫贵妃等小白菜品种和京研紫快菜等大白菜品种,但是紫色性状均来源于紫色小白菜,其紫色仅分布在叶片的正面,而在叶片的反面和叶柄处没有分布,且叶球剖面颜色不均匀,表现为杂色[3-4],因此,该紫色性状存在一定的局限性,无法广泛利用。当前,国内还没有利用另外3种紫色性状育成白菜品种的报道。近年来,在国际上韩国首次培育出紫色大白菜品种紫宝(http://www.1688.com/chanpin/D7CFB0D7B2CB.html),该品种为细胞质不育系配制的杂交F1,紫色均匀分布在叶片的正反面、叶脉和叶柄处,且叶球剖面紫色分布均匀,颜色美观,但是由于细胞质雄性不育系具有自我保护的生物学功能,即细胞质母性遗传的特点,不能产生花粉,无法自交留种,所以该紫色资源也无法应用。目前,紫宝由国内代理公司销售,品种名称也不同,且种子价格昂贵,每粒种子平均售价为0.8~1.0元。2014年Ahmed等[9]报道了全紫色大白菜材料Palgangbaechu和部分紫色材料8053。2016年,韩国又推出了大白菜紫色品种紫裔。当前,有关紫宝、紫裔、Palgangbaechu和8053等紫色性状的来源仍不清楚,猜测有可能来源于紫色芥菜。
转录组是基因组遗传信息与生物功能蛋白质组相连接的必然纽带,也是研究基因功能及结构的基础,已广泛应用于基础研究等多个领域。转录组测序的研究对象为特定细胞在某一功能状态下所能转录出来的所有RNA的总和,目前主要是mRNA。通过新一代高通量测序技术,能够全面快速地获得紫色大白菜叶片在特定状态下的几乎全部转录本序列信息,特别是有关类黄酮、黄酮、黄酮醇和花青素合成途径相关基因的转录本信息,有利于获得差异表达的基因,阐明调控叶片花青苷合成相关基因的分子机制[10-11]。
2015年春季,笔者在1份繁育的小白菜杂交一代中发现了1株紫色材料,不仅紫色性状突出,而且叶片正反面、叶脉和叶柄均表现为紫色,命名为15NG28。随后,将15NG28与大白菜杂交、回交,继续转育该紫色性状,已初步创制了一批大白菜新型紫色资源材料。本研究拟开展15NG28及其杂交F1、回交一代BC1F1和自交等后代的植物学性状、基因组的倍性和染色体数、转录组学等研究,为拓宽新的紫色大白菜资源,最终选育出具有我国自主知识产权的深紫色白菜新品种并进一步获得控制15NG28紫色叶片花青苷合成途径候选基因奠定基础。
1 材料和方法
1.1 试验材料
2015年4月,选用2份大白菜(1份春白菜15绿1-1-26,1份秋白菜16-1081),分别与15NG28杂交,配制3组F1:15NG28×16-1081、15NG28×15绿1-1-26和15绿1-1-26×15NG28,同时在蕾期对15NG28进行人工剥蕾、自交授粉,收获全部种子。12月18日,在温室中播种15NG28自交种子、3组F1材料。2016年1月13日开始,观察全部材料叶片在幼苗期和成株期的紫色性状,并拍照。4月,配制回交一代BC1F1:16M-170-22×15绿1-1-26,收获全部种子。12月20日,播种2组BC1F1种子,2017年4月,观察2组BC1F1叶片紫色性状,并拍照,同时在蕾期对紫色BC1F1进行人工剥蕾、自交授粉,紫色BC1F1继续与白菜进行回交转育。试验材料均来源于北京市农林科学院蔬菜研究中心大白菜课题。所用试验材料的世代、名称和特性见表1。

表1 材料的世代、名称和特性Tab.1 Generation,name and characteristics of materials
1.2 观察叶片中花青素的分布情况
采用徒手切片的方法,将2把刀片并排重叠,快速切取紫色和绿色叶片,放于清水中,并用毛笔捞取,置于载玻片上,在显微镜下观察叶片中花青素的分布情况。
1.3 观察基因组倍性
参考饶琳莉[12]的方法并进行优化,观察样品的基因组倍性,具体操作为:选取样品新鲜嫩叶100 mg,加入1 mL预冷的缓冲液Galbraith(45 mmol/L MgCl2,30 mmol/L柠檬酸纳,20 mmol/L MOPS,0.1% Triton X,pH=7)于培养皿中,用锋利的刀片快速切碎嫩叶,再用50 μm孔径的尼龙膜过滤,收集滤液,1 000 r/min离心5 min,倒掉上清液,加入200 μL PI染液,振荡混匀,避光静置20 min后,用流式细胞仪进行检测分析并拍照。试验在北京市农林科学院蔬菜研究中心生物技术研究室完成。
1.4 染色体数观察
在晴天上午(9:00-11:00),选取植株盛花期花序上端的幼小花蕾,用卡诺氏液(V(无水酒精)∶V(冰乙酸)=3∶1)固定24 h,再换至70%乙醇中,置于4 ℃冰箱保存备用。以改良品红溶液染色,常规压片,在显微镜下进行观察,统计染色体数目并拍照。试验完成地点同1.3。
1.5 转录组RNA-Seq分析
选取F1紫色植株16M-170-22、BC1F1紫色植株17M-245-21和17M-247-22、F1绿色植株16M-170-23的叶片,3次生物学重复,送交杭州壹基因公司进行转录组分析,并获得测序结果报告。
获得差异表达基因的方法:以紫色单株BCZ为参考,对绿色单株BCL与紫色单株BCZ基因表达量FPKM(Fragments Per Kilobase of transcript per Million fragments mapped)进行比较,即BCL-VS-BCZ,再依据错误发现率FDR(False Discovery Rate)筛除假阳性,最终获得BCZ、BCL 2个样品之间的差异表达基因。
2 结果与分析
2.1 15NG28植物学性状
观察15NG28叶片颜色性状,结果表明,在幼苗期,15NG28的子叶和真叶正反面,叶柄、叶脉均为紫色;在成株期,15NG28叶片为长圆形,叶缘浅锯齿,叶柄窄,叶柄正面为紫色、背面为绿色,叶柄没有叶翼(图1)。由于在繁育的普通小白菜杂交种中发现15NG28材料,所以可以肯定15NG28是以小白菜为母本、父本未知的F1杂交种,因此,15NG28表现为中间类型,偏向小白菜,但不表现白菜的抱球、小白菜的束腰等性状(图1),也没有典型剖面特征;在花期,15NG28花瓣颜色为黄色,花蕾小,花瓣、花药和柱头等花器官也小,花粉偏少,但腋芽萌生能力特别旺盛,花枝细长且软。15NG28自交结实结果表明:15NG28自交结实率极低。

A.全株;B.叶柄。A.Whole plant;B.Leaf blade.
2.2 15NG28与白菜杂交的F1性状
以15NG28为母本,分别与大白菜15绿1-1-26和16-1081杂交,均可以获得少部分F1种子,而以15NG28为父本与15绿1-1-26杂交,后代结实率很高。比较15NG28及其3组F1植株叶片性状,结果表明:以15NG28为母本的2组杂交F1(15NG28×16-1081、15NG28×15绿1-1-26),其叶片颜色出现了分离,表现为紫色和绿色2类(表2)。其中紫色F1的子叶、真叶正反面均为紫色,特别是叶脉和叶柄也为紫色,且颜色深(图2-4)。另外,调查了杂交F1(15绿1-1-26×15NG28)的性状,结果表明:9株F1植株全部表现为绿色,而且植物学性状相似,因此,这9株F1应该为自交种。同时,调查了紫色F1植株16M-170-21现蕾期、抽薹期和开花期的性状,结果表明:随着植株逐渐经历现蕾期、抽薹期和开花期的过程,叶片紫色逐渐褪色、变浅和变绿,在花期,只有叶脉部分呈现出零星紫色,因此,紫色F1植株叶片紫色由深到浅的显色顺序为:苗期>现蕾期>抽薹期>开花期(图2,5)。可见,利用常规杂交的方法,可以获得少部分15NG28与大白菜的杂交F1种子,且F1后代分离出部分紫色植株。

表2 15NG28及其杂交F1的性状Tab.2 Characteristics of 15NG28 and it′s F1 hybrids

A.16M-170-21;B.16M-170-22;C.16M-171-24;D.16M-171-26。

图3 16M-170-22苗期真叶反面性状Fig.3 Abaxial leaf characteristics of 16M-170-22 at seedling stage

A.16M-171-24;B.16M-170-21;C.16M-170-22;D.16M-171-26。

图5 16M-170-21在现蕾期、抽薹期和开花期的性状Fig.5 Characteristics of 16M-170-21 at budding,bolting and flowering stage
2.3 紫色F1的自交、回交一代BC1F1植物学性状
2017年4月,重点调查了F116M-170-21的自交后代以及回交一代BC1F1(16M-170-22×15绿1-1-26)的性状。结果表明:16M-170-21自交后代表现出多种类型,其中8株的主要性状为:芥菜型,叶片颜色深紫色,圆形叶,叶缘锯齿,深浅不等,叶柄窄、细长,无叶翼;另外7株的主要性状为:白菜型,叶片颜色深紫色,圆形叶,叶柄长,有叶翼(图6)。31株BC1F1性状全部表现为白菜类型,其中14株叶片为紫色,17株叶片为绿色。10株BC1F1后代性状见图7。2017年5月8日,调查BC1F1紫色植株自交结实情况,结果表明:14株紫色植株结实性很好。

图6 16M-170-21自交后代性状Fig.6 Characteristics of self-inbred plants of 16M-170-21
2.4 叶片中花青素的分布情况
在显微镜下观察叶片花青素的分布情况,结果表明:F1紫色大白菜16M-170-22的花青素主要分布在叶片的上表皮和下表皮,下表皮少于上表皮,而在绿色大白菜16-1081的上、下表皮中均没有观察到花青素(图8)。

A.紫色株;B.绿色株。A.Purple plants;B.Green plants.

A.16-1081;B.16M-170-22。
2.5 植株的倍性分析
2.5.1 紫色F1的倍性 经流式细胞仪鉴定,二倍体白菜2n荧光强度高峰位于48(图9-A),异源四倍体芥菜4n荧光强度高峰位于96(图9-B)。在F1紫色植株中,16M-170-21荧光强度高峰位于105,倍性为4n(图10-A),16M-170-22荧光强度高峰位于80(图10-B),推测为3n,即2n+n,16M-171-24荧光强度高峰位于150,倍性为6n(图10-C),16M-171-26荧光强度高峰位于70(图10-D),推测为3n,即2n+n。
2.5.2 绿色F1的倍性 与紫色F1植株一样,绿色F1植株也存在复杂的倍性变化。图11显示为四倍体和混倍体。
2.6 染色体数分析
经观察发现,在F1紫色大白菜中,16M-170-21染色体数为36条(图12),基因型可能为芥菜型AABB,即IIA+IIB;16M-170-22染色体数为28条(图13),基因型可能为AAB,即IIA+IB;16M-171-24染色体数为24条(图14),基因型可能为ABB,即IIB+IA;16M-171-26染色体为28条(图15),基因型可能为AAB,即IIA+IB。

A.白菜二倍体;B.芥菜异源四倍体。A.B.rapa diploid;B.B.juncea heterotetraploid.

A.16M-170-21;B.16M-170-22;C.16M-171-24;D.16M-171-26。
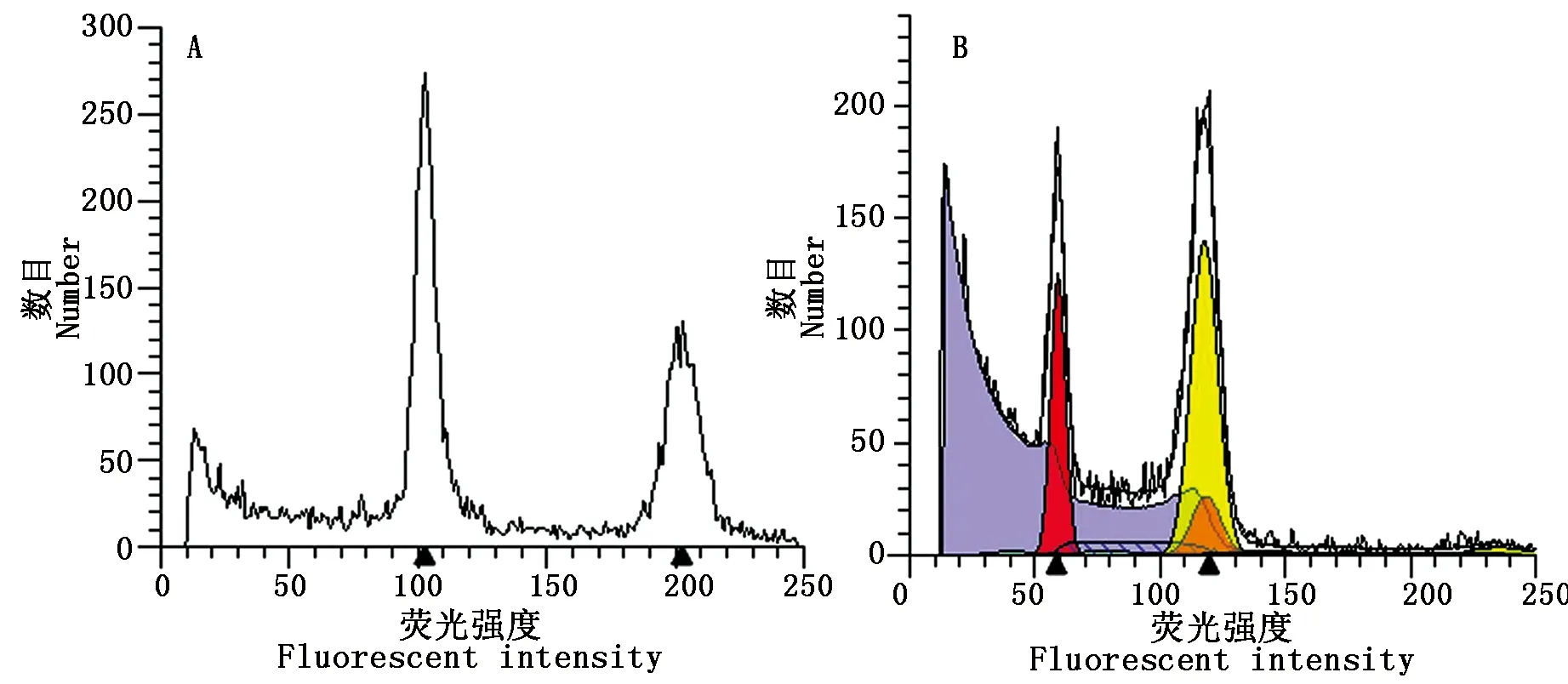
A.四倍体F1植株;B.混倍体(二倍与四倍F1植株)。A.4n;B.Mix-ploid (2n and 4n).

图12 16M-170-21染色体(4n=36,100×)Fig.12 Chromosome of 16M-170-21(4n=36,100×)
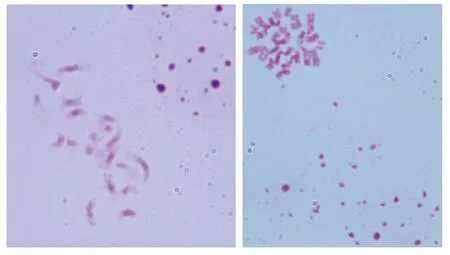
图13 16M-170-22染色体(3n=28,100×)Fig.13 Chromosome of 16M-170-22(3n=28,100×)

图14 16M-171-24染色体(3n=24,100×)Fig.14 Chromosome of 16M-171-24(3n=24,100×)
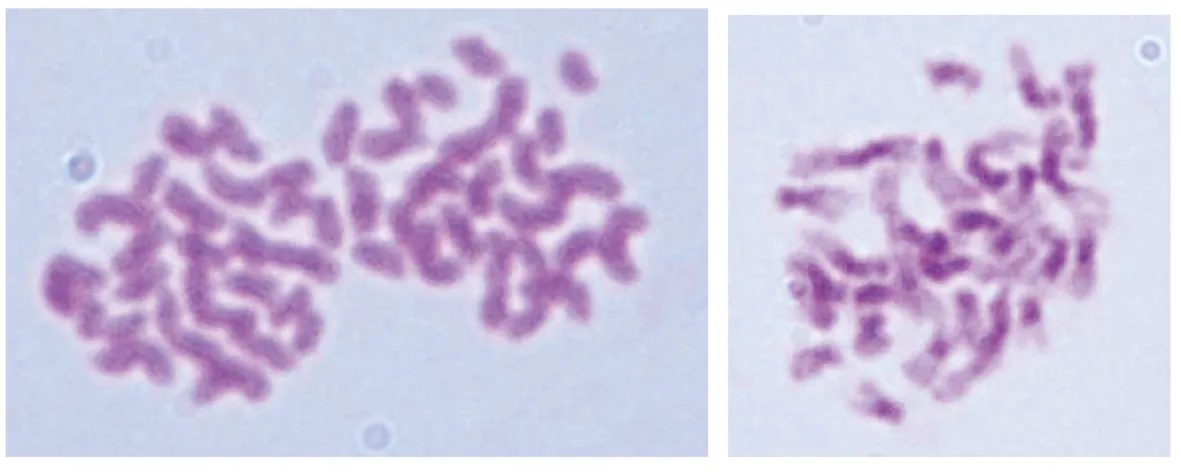
图15 16M-171-26染色体(3n=28,100×)Fig.15 Chromosome of 16M-171-26(3n=28,100×)
2.7 转录组测序分析
F1紫色植株16M-170-22、BC1F1紫色植株17M-245-21和17M-247-22、F1绿色植株16M-170-23的植物学性状特征见图16。利用Illumina HiSeqTM 4000,对紫色单株BCZ(16M-170-22、17M-245-21、17M-247-22)和绿色单株BCL(16M-170-23)进行初步的转录组测序分析。将原始序列数据(Raw data)进行过滤处理,去除接头污染Reads、低质量Reads和含N比例大于5%的Reads,最后得到Clean data。
使用比对软件Tophat(http://ccb.jhu.edu/software/tophat/index.shtml),将每个样品的Clean data与白菜参考基因组(http://brassicadb.org/brad/)进行比对。由表3可见,紫色单株BCZ的定位总个数百分比、双末端定位个数百分比、左端定位个数百分比、右端定位个数百分比均低于绿色单株BCL,体现了紫色单株BCZ基因组的复杂性,进一步证明15NG28的紫色性状可能并非来源于大白菜的事实。
以紫色单株BCZ为参考,经进一步比较紫色单株16M-170-22、17M-245-21、17M-247-22和绿色单株16M-170-23差异表达基因的表达量FPKM,并筛除假阳性,结果表明:明显上调的基因共有140个,明显下调的基因共有16个。在差异表达基因分析结果中,选取参与黄酮类合成代谢通路的相关基因,如在紫色单株明显上调表达的15个差异表达基因,进行聚类分析(图17)。

A.16M-170-22;B.16M-170-23;C.17M-245-21;D.17M-247-22。

样品Samples读码总数Totalreads定位总个数百分比/%Percentoftotalmappedreads双末端定位个数百分比/%Percentofmappedpairreads左端定位个数(百分比)Percentofmappedleftreads右端定位个数(百分比)PercentofmappedrightreadsBCL4787061484.975.920554669(85.9%)20066163(83.8%)BCZ4659573873.564.417337028(74.4%)16929714(72.7%)

每行代表一个基因,不同颜色代表基因的表达变化倍数或表达量。对于差异表达基因聚类:浅颜色表示表达量上调,深颜色表示表达量下调。对于样品聚类:黑色到白色表示表达量从小到大,颜色越浅表示差异表达基因的表达量越高。
Each row presented one gene,and different colors meant expression amount or expression level.For differentially expressed genes in each row,light color meant up-regulation and dark color meant down-regulation.For clustering chart in each column,colors from dark to light meant low to high gene expression level.
图1715个差异表达基因聚类模式图
Fig.17Clusteringchartoffifteendifferentiallyexpressedgenes
进一步对紫色单株和绿色单株差异表达基因的GO功能注释进行分类作图,结果表明:3种GO功能注释分别描述为基因的分子功能(Molecular function)、细胞成分(Cellular component)和参与的生物过程(Biological process)(图18)。图18解释了在差异基因背景和全部基因背景下,GO各二级功能的18个生物过程、10个细胞成分和7个分子功能差异基因富集情况,体现了具有明显比例差异的二级功能差异基因富集与全部基因富集的不同趋势。
同时,对紫色单株BCZ中参与花青素合成相关代谢通路及其基因进行分析,发现参与类黄酮、黄酮和黄酮醇、花青素生物合成等3个代谢通路相关的差异表达基因共12个:7个类黄酮生物合成途径基因生物,4个黄酮和黄酮醇生物合成途径基因,1个花青素合成途径基因(表4)。另外,12个差异表达基因在紫色材料BCZ中差异表达量最高的2个基因均为结构基因:Bra013652(AT4G22880)为无色花青素双加氧酶(LDOX),Bra027457(AT5G42800)为二氢黄酮醇还原酶(DFR)。12个差异表达基因在白菜和拟南芥中比较和功能见表5,将是今后的重点研究内容。
3 讨论与结论
有关大白菜紫色资源的创制以及与花青苷合成相关的基因表达、克隆等内容是目前国内外研究的热点,如紫色大白菜[13-19]、紫色小白菜[20-22]、紫色菜薹[22]等。
目前,国内普遍利用紫色小白菜与大白菜杂交,获得叶片紫色的大白菜材料,育成紫色白菜品种,如京研紫快菜等,但是该紫色性状仅在叶片正面表现出深紫色,而子叶、真叶和心叶的背面均为绿色,尤其是叶球剖面呈现出紫色、白色、黄色等多种颜色,即紫色表现不均匀,因此,该材料在大白菜育种中存在一定的局限性,该紫色品种的推广也受到一定限制[3-4]。西北农林科技大学选育出高花青素含量大白菜纯系11S91,该紫色性状来源于紫色菜薹,但其外叶、叶柄和叶脉均为绿色,只有叶球剖面的心叶部分表现为紫色,花青素主要分布在叶片表皮下2~3层细胞[15,19]。紫色性状表现优异的大白菜资源主要有2种:紫红色大白菜新种质B90335-5[2,10-11]和紫色大白菜品种,如紫宝、紫裔。研究表明,紫红色大白菜B90335-5紫红色性状不符合孟德尔遗传规律[10]。当前国内还没有育成类似于紫宝的紫色大白菜品种,因此,大白菜紫色资源的原创工作非常迫切和重要。乔海云等[23]获得了大白菜与紫色甘蓝的种间杂种。15NG28与大白菜杂交F1、回交BC1F1的紫色植株性状不仅叶片正反面、叶脉全部为紫色,而且叶柄正反面也为紫色,与紫红色芥菜、紫宝的紫色性状较一致,与来源于紫色小白菜、紫色菜薹的紫色性状明显不同。初步认为,新型紫色材料15NG28的紫色性状可能来源于紫色芥菜。同时,仅用常规方法,15NG28可以成功与白菜进行杂交、回交,转育紫色性状,且后代较容易获得种子。虽然杂交F1、BC1F1后代的倍性、染色体行为存在复杂性,这也说明芥菜的紫色性状整合到白菜基因组是一个复杂的、漫长的生物学过程,但是可喜的是,本研究仅在31株BC1F1(16M-170-22×15绿1-1-26)后代中就发现了14个紫色植株,而且全部植株均为白菜,结实性好,植物学性状、染色体数目等都具有白菜基因组AA的特征特性。下一步,笔者将利用2株BC1F1(17M-245-21、17M-247-22)分别与绿色大白菜骨干亲本系杂交,继续转育紫色性状,创制大白菜骨干亲本系的紫色资源,为选育出紫色大白菜新品种奠定基础。因此,15NG28、杂交F1,尤其是BC1F1后代中的紫色植株具有潜在的应用价值。

横坐标为GO 各分类内容,纵坐标左侧为基因数目所占百分比,右侧为基因数目。矩形直方图代表上调基因,椭圆图代表下调基因。

通路Pathway注释通路的DEG基因DEGswithannotationpathway(107)注释通路的全部注释基因Allgeneswithannotationpathway(22358)P值PvalueQ值Qvalue通路路径PathwayID差异表达的基因Differentiallyexpressedgenes类黄酮生物合成Flavonoidbiosynthesis7(6.54%)285(1.27%)0.00044723050.013864146ko00941Bra027457、Bra030550、Bra013652、Bra036208、Bra019350、Bra007142、Bra009312黄酮和黄酮醇生物合成Flavoneandflavonolbiosynthesis4(3.74%)127(0.57%)0.0032644060.050598293ko00944Bra034677、Bra009312、Bra008316、Bra035271花青素生物合成Anthocyaninbiosynthesis1(0.93%)13(0.06%)0.060475140.288419898ko00942Bra038445

表5 白菜差异表达基因在拟南芥中名称和功能注释Tab.5 Names and annotations of differentially expressed genes in B.rapa and A.thaliana
芸薹属禹氏三角(U′s triangle)包括3个二倍体基本种:白菜AA(B.rapa,2n = 20)、甘蓝CC(B.oleracea,2n = 18)、黑芥BB(B.nigra,2n = 16)和3个四倍体复合种:甘蓝型油菜AACC(B.napus,2n=38)、芥菜型油菜AABB(B.juncea,2n=36)和埃塞俄比亚芥BBCC(B.carinata,2n=34)。测序结果表明,白菜基因组大小为485 Mb,黑芥基因组大小为591 Mb,甘蓝基因组大小为630 Mb,而芥菜基因组大小为922 Mb。本研究中,以观察15NG28、杂交F1、回交BC1F1后代的倍性和染色体数目为辅助手段,重点选择具有更多AA基因组特征的后代进行人工自交、回交授粉,以减少工作量,进而快速获得具有大白菜性状的紫色中间材料,如17M-245-21、17M-247-22等。在试验中,流式细胞仪峰值的位置一方面受植物染色体组成决定,另一方面还有2.5%~5.0%的系统误差。通过流式细胞仪,很难确定某个材料的基因组组成。下一步,将利用黑芥的特异标记等,辅助筛选具有芥菜紫色性状的大白菜中间材料。同时,我们还发现,16M-171-24染色体数为24条,可能为三倍体,但流式细胞仪检测的结果为六倍体,二者结果不同,可能原因是16M-171-24同株上同时出现了三倍体和六倍体的枝条,而笔者选取了三倍体花蕾观察染色体数目。在白菜和芥蓝等芸薹属小孢子培养过程中,经常可以发现在同一DH植株上生长不同倍性枝条的情况。同样,即使经过多次人工自交和与白菜回交,仍没能获得16M-171-24自交种子以及回交后代种子,说明16M-171-24具有复杂的染色体和基因组。
目前,有关大白菜花青苷结构基因和转录因子等有关研究已见报道。Xie等[11]对紫红色和绿色大白菜进行转录组学研究,共获得可定位在白菜参考基因组上的差异表达基因(DEGs)930个,其中389个基因上调表达,541个基因下调表达。通过进一步重新组装未定位的reads,又发现了2 031个Unigenes。作者认为芥菜的R2R3-MYB转录因子c3563g1i2被导入到大白菜基因组中,可能参与大白菜花青素合成。本研究对F1的1个绿色植株16M-170-23、1个紫色植株16M-170-22和BC1F1的2个紫色植株17M-245-21、17M-247-22分别进行转录组测序,结果表明:在紫色材料中差异表达量最高的2个基因均为结构基因:Bra013652(LDOX),Bra027457(DFR),该结论与Xie等[11]报道控制紫红色大白菜的R2R3-MYB转录因子c3563g1i2完全不同,但与Xie在比对花青素合成途径的转录子后发现花青素合成途径中Bra013652和Bra027457基因的上调表达量最高及这2个基因的Log2FC值10.05和10.07也最高的结论相吻合。由此可见,15NG28及其杂交、回交后代可能为新的大白菜紫色资源材料。
2017年秋季,将进一步调查14株BC1F1紫色白菜的自交后代和回交二代BC2F1的植物学性状和叶片颜色分离情况,重点研究17M-245-21和17M-247-22的自交后代和BC2F1后代的性状,以期获得一批紫色大白菜中间材料,再通过人工加代等多代自交和游离小孢子技术获得紫色大白菜的纯合系和DH系,最后配制紫色与绿色的F1,构建叶片颜色分离群体,如F2和DH群体,进一步开展紫色性状的遗传规律、染色体定位等相关研究。同时,将利用实时定量荧光PCR(qRT-PCR)技术,对12个差异表达基因进行分析,进一步研究控制15NG28紫色性状花青素合成途径的相关基因。
[1] 张德双,张凤兰,于拴仓,等.与紫色大白菜花青苷合成相关的基因[J].分子植物育种,2015,13(11):2619-2625.
[2] 孙日飞,张淑江,章时蕃,等.紫红色大白菜种质的创新研究[J].园艺学报,2006,33(5):1032-1032.
[3] 张德双,张凤兰,余阳俊,等.紫色大白菜育种材料的创造[J].长江蔬菜,2007(11):52-53.
[4] 张德双,张凤兰,余阳俊,等.紫色大白菜育种思路初探[J].长江蔬菜,2008(22):14-17.
[5] 刘 瑾,汪维红,张德双,等.控制白菜叶片紫色的pur基因初步定位[J].华北农学报,2013,28(1):49-53.
[6] Wang W H,Zhang D S,Yu S C,et al.Mapping theBrPurgene for purple leaf color on linkage group A03 ofBrassicarapa[J].Euphytica,2014,199(3):293-302.
[7] 张明科,张鲁刚,巩振辉,等.白菜紫色性状RAPD连锁标记的筛选与染色体定位研究[J].西北植物学报,2008,28(5):901-906.
[8] Hayashi K,Matsumoto S,Tsukazaki H,et al.Mapping of a locus regulating anthocyanin pigmentation inBrassicarapa[J].Breeding Science,2010,60(1):76-80.
[9] Ahmed N U,Park J I,Jung H J,et al.Anthocyanin biosynthesis for cold and freezing stress tolerance and desirable color inBrassicarapa[J].Functional & Integrative Genomics,2015,15(4):383-394.
[10] 张淑江.大白菜紫红色基因定位和候选基因分析[D].北京:中国农业科学院研究生院,2014.
[11] Xie L L,Li F,Zhang S F,et al.Mining for candidate genes in an introgression line by using RNA sequencing:the anthocyanin over accumulation phenotype inBrassica[J].Frontiers in Plant Science,2016,7:1245.
[12] 饶琳莉.榨菜与紫甘蓝种间异源六倍体的植物与分子特性初探[D].杭州:浙江大学,2015.
[13] Burdzinski C,Wendell D.Mapping the anthocyaninless (anl) locus in rapid-cyclingBrassicarapa(RBr)to linkage group R9[J].BMC Genetics,2007,8:64.
[14] Zhang J,Lu Y,Yuan Y,et al.Map-based cloning and characterization of a gene controlling hairiness and seed coat color traits inBrassicarapa[J].Plant Molecular Biology,2009,69(5):553-563.
[15] 段岩娇,张鲁刚,何 琼,等.紫心大白菜花青素积累特性及相关基因表达分析[J].园艺学报,2012,39(11):2159-2167.
[16] Guo N,Cheng F,Wu J,et al.Anthocyanin biosynthetic genes inBrassicarapa[J].BMC Genomics,2014,15(1):426.
[17] Kim C K,Kim J A,Kikuchi S,et al.Computational identification of Chinese cabbage anthocyanin-specific genes[J].BioChip Journal,2011,5(2):184-192.
[18] Wang Z,Tang J,Hu R,et al.Genome-wide analysis of the R2R3-MYB transcription factor genes in Chinese cabbage (Brassicarapassp.pekinensis) reveals their stress and hormone responsive patterns[J].BMC Genomics,2015,16:17.
[19] He Q,Zhang Z F,Zhang L G.Anthocyanin accumulation,antioxidant ability and stability,and a transcriptional analysis of anthocyanin biosynthesis in purple heading Chinese cabbage (BrassicarapaL.ssp.pekinensis)[J].Journal of Agricultural and Food Chemistry,2016,64(1):132-145.
[20] 张 彬.芸薹属植物花青素生物合成代谢途径调控机制的研究[D].重庆:重庆大学,2011.
[21] Zhang Y J,Chen G P,Dong T T,et al.Anthocyanin accumulation and transcriptional regulation of anthocyanin biosynthesis in purple Bok-Choy (Brassicarapavar.chinensis)[J].Journal of Agricultural and Food Chemistry,2014,62(51):12366-12376.
[22] 郭 宁.白菜花青苷和黄酮醇苷自然变异及遗传机制研究[D].北京:中国农业科学院,2014.
[23] 乔海云,李 菲,张淑江,等.大白菜与紫甘蓝种间杂种的获得与鉴定[J].植物科学学报,2012,30(4):407-414.

