水稻土中痕量多环芳烃的分析测定方法
何明江,沈浩然,查婷,于雄胜,刘杏梅
多环芳烃(polycyclic aromatic hydrocarbons,PAHs)是一类广泛存在于环境中的持久性有机污染物,具有致癌、致突变和致畸的作用,目前已受到越来越广泛的关注。作为全球水稻生产和消费大国,我国水稻田土壤的质量关系到粮食安全和农业可持续发展。PAHs污染物一旦进入到农田生态系统,可通过食物链富集,进而威胁人类的健康和生存[1]。目前,我国农业产业标准只对土壤中的重金属和pH作了限量[2],而对PAHs类污染物却未作限定。因此,建立准确、可靠的PAHs检测方法,对维护土壤生态系统及食品安全具有重要的现实意义。
近年来,PAHs的检测在环境、食品、植物等领域都有了广泛的研究[3-6],通常用于分析PAHs的方法主要有高效液相色谱法(high-performance liquid chromatography,HPLC)[6]、气相色谱法和气相色谱-质谱法(gas chromatography-mass spectrometry,GCMS)[3-5]。GC-MS相对HPLC而言,具有高选择性、高灵敏度和快速的特点,适合复杂环境中的PAHs检测。鉴于土壤基质复杂,土壤中PAHs的含量又常以痕量/超痕量级存在[7],因此样品的前处理至关重要,同时也是当代环境分析中的一个前沿课题。由于目前仍缺乏一种完善的针对水稻土中痕量PAHs的前处理方法,因此,本研究采用超声提取法,从样品的提取溶剂、净化柱、洗脱溶剂及最适用量、氮吹温度等4个方面进行研究,并利用GC-MS对16种优先控制的多环芳烃物质进行定量分析,以求获得一种较为精确、灵敏度高、重复性好且环境友好型的分析测试方法,为维护土壤质量及粮食安全提供理论指导。
1 材料与方法
1.1 仪器与材料
实验仪器:N6890/5975B气相色谱质谱联用仪(Agilent公司,美国),旋转蒸发仪(真空泵V-800,Heidolph公司,德国),XW-80A涡旋混合器(上海精科实业公司),D-37520高速冷冻离心机(Sigma公司,德国),氮吹仪(北京康林科技公司),SK8210HP超声仪(上海科导超声仪器公司),FreeZone 2.5 L立式冷冻干燥机(Lanconco公司,美国)。
实验材料:色谱纯丙酮、二氯甲烷、正己烷,购于天津博纳艾杰尔科技公司。多环芳烃混合标样(16种PAHs质量浓度均为200 mg/L)购自美国Supelco公司,包括:萘、苊烯、苊、芴、菲、蒽、荧蒽、芘、苯并(a)蒽、屈、苯并(b)荧蒽、苯并(k)荧蒽、苯并(a)芘、茚并(1,2,3-cd)芘、二苯并(a,h)蒽、苯并(g,h,i)苝。上述混合标样用色谱纯正己烷配置成实验所需浓度,避光保存于4℃冰箱中备用。玻璃层析柱(长50 cm,内径1 cm)购于江苏省海门市仪器厂。手工装填硅胶/氧化铝柱层析柱所需材料均购于国药集团化学试剂公司,其前处理和保存方法如下:填充物为无水硫酸钠(分析纯),于450℃活化2 h,冷却后密封存于干燥器中备用;中性氧化铝(层析纯,200~300目)和硅胶(层析纯,100~200目)各自分别在(250±2)℃、(180±2)℃活化12 h,待试剂冷却至室温,分别收集于广口玻璃瓶中密封贮存备用。固相萃取小柱包括:弗罗里硅土固相萃取柱(6 mL,500 mg),硅胶固相萃取柱(3 mL,500 mg)和C18固相萃取柱(6 mL,500 mg),均购于天津博纳艾杰尔科技有限公司。
1.2 供试土壤
供试土壤样品采自浙江省温岭市水稻田,采样深度0~20 cm。将土壤样品在-40℃下真空冷冻干燥48 h,除去石块、根系等异物,研磨过2 mm筛,装入棕色密闭容器,于4℃冰箱中保存。土壤pH、有机碳、颗粒组成均采用常规分析方法进行测定[8],其中,黏粒、粉粒和砂粒质量分数分别为20%、49%和30%,有机质质量分数为5%,pH值为6。
1.3 污染土壤样品的制备
准确称取5 g供试土壤样品于50 mL棕色玻璃离心管中,加入1 mL 500 μg/L 16种多环芳烃混合标样,在通风橱中待溶剂挥发后,于涡旋混合器上充分混匀,平衡24 h,制备成100 μg/kg污染土壤样品。根据前处理优化实验所需,配置多份。
1.4 样品前处理
称取5 g供试土壤置于50 mL棕色玻璃离心管中,采用超声提取方法,准确加入10 mL合适的提取溶液,超声提取30 min(25 ℃,100 kHz),之后在3 000 r/min下离心10 min,将上清液倒至旋转蒸发杯中。将上述步骤再重复2次,最后将3次超声提取所得的全部上清液合并至旋转蒸发杯中,再旋转蒸发(30 ℃,180 r/min,2.8×104Pa)至1 mL左右,得到提取浓缩液。转移浓缩液至合适的净化柱中,选取适量的洗脱溶剂进行洗脱。将洗脱液收集至氮吹管中,在一定温度条件下氮吹,由高纯氮气吹至干燥,准确加入1 mL正己烷溶液并涡旋振荡使之充分溶解,最后转移至棕色进样瓶中,待上机测定。
样品前处理是本文的核心研究内容。以上前处理过程中采用的提取溶剂、净化柱、洗脱溶剂及其用量、氮吹温度条件等详见后文结果与分析部分。在前处理优化实验中,土壤样品中PAHs的回收率采用土壤基质加标法测定,即每个实验处理中以供试土样和污染土样为待测样品,分别检测样品加标前后的PAHs含量,计算回收率。
1.5 仪器条件
气相色谱条件如下。色谱柱为HP5-MS(30 mm×250 μm×0.25 μm),进样口温度280 ℃;升温程序:初始温度60℃,保持2 min,以30℃/min升至120℃,再以5℃/min升至280℃;载气:高纯氦气(99.999%),流速1 mL/min;进样方式:不分流进样;进样量:1 μL。
质谱条件:电子轰击离子源;电离能量70 eV,离子源温度230℃,传输线温度280℃,扫描质量范围(m/z)为50~450,溶剂延迟5.5 min。
2 结果与分析
2.1 GC-MS定性及定量离子的选择
根据气相色谱-质谱条件,利用全扫描方式对1 000 μg/L的16种PAHs混合标样进行全扫描,得到各化合物的总离子流图(图1)。根据色谱峰保留时间和检索质谱谱库,对16种PAHs定性;选择无干扰、丰度较高的碎片离子作为选择离子检测模式下的定量离子。16种PAHs的保留时间和定性、定量离子见表1。最后用选择离子扫描模式进行检测。

图1 16种多环芳烃标准样品的总离子流图Fig.1 Total ion chromatogram of 16 polycyclic aromatic hydrocarbons(PAHs)in the standard sample
2.2 样品前处理条件的优化
2.2.1 提取溶剂的选择
对于土壤中PAHs的提取,不同文献报道了不同的提取溶剂,常用的有丙酮、二氯甲烷、正己烷以及它们的组合。崔艳红等[9]对污灌区土壤中多环芳烃的提取、净化和测定进行了研究,比较了二氯甲烷、二氯甲烷-丙酮(体积比为1∶1)、正己烷-丙酮(体积比为1∶1)提取土壤样品的效率,结果表明,二氯甲烷-丙酮、正己烷-丙酮混合液的提取效率和回收率比二氯甲烷高。本研究结合实验室条件,选择弱极性溶剂正己烷和丙酮混合溶液作为提取剂。为确定两者的最佳用量,分别将V(正己烷)∶V(丙酮)=1∶1和1∶2的混合溶液作为提取溶剂,提取制备污染土样中的PAHs,以比较2种混合溶液的提取效果。结果(图2)发现:当提取溶剂选用正己烷/丙酮体积比为1∶2时,16种PAHs的回收率在69%~95%之间;当正己烷/丙酮体积比达到1∶1时,PAHs的回收率在78%~98%之间。可见,随着正已烷比例的增加,土壤样品中PAHs的回收率有所提高,尤其是低环PAHs的回收率明显提升。这主要与低环和高环的PAHs在溶剂中分配系数不同有关。因此,认为V(正己烷)∶V(丙酮)=1∶1的混合溶液是较优的提取溶剂,本文的其他实验也均采用这种提取溶剂。
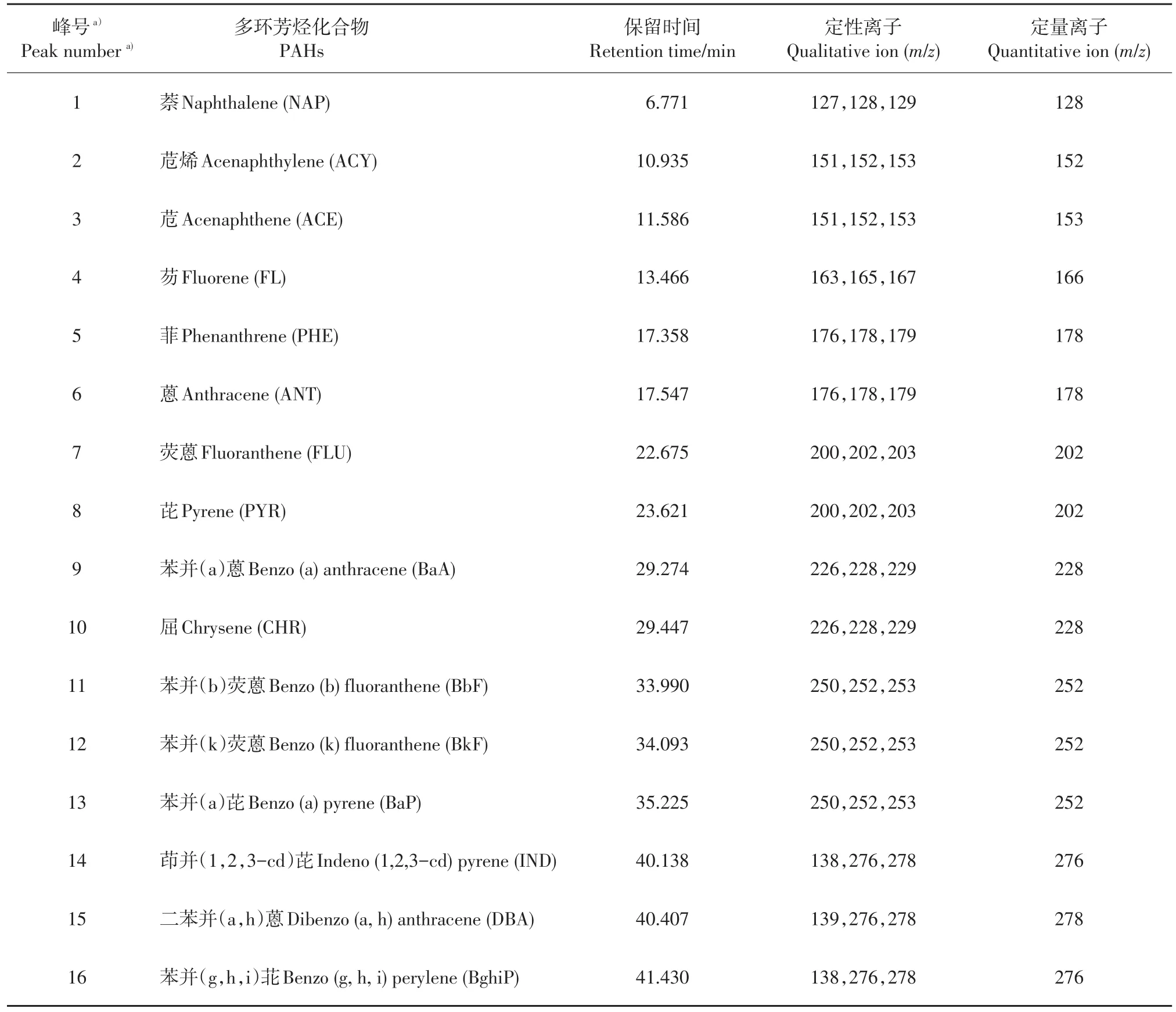
表1 16种多环芳烃化合物的保留时间、定性和定量离子Table 1 Retention time,qualitative and quantitative ions of 16 PAHs

图2 不同比例体积的正己烷/丙酮混合溶液对土壤样品中PAHs的提取效果Fig.2 Effect of different volume ratios of n-hexane to acetone on extraction recovery rate of PAHs in soil samples
2.2.2 净化柱的选择
根据已有研究[10-12],本文对比了4种常用净化柱对土壤中16种PAHs的净化回收效果。这4种净化柱分别为1种手工装填硅胶/氧化铝层析柱和3种固相萃取(solid phase extraction,SPE)小柱(C18柱、硅胶柱及弗罗里硅土柱)。手工装填硅胶/氧化铝层析柱的装柱、净化步骤参见冯雪等[10]的方法。SPE小柱的净化步骤为:加入3 mL正己烷活化SPE小柱,弃滤液;转移样品浓缩液至柱中,采用与上述手工层析柱相同的洗脱溶剂V(正己烷)∶V(二氯甲烷)=7∶3的混合溶液对浓缩液进行洗脱,洗脱试剂体积定为14 mL,用量略大于参考文献中常用洗脱剂的用量[11-12],目的是使样品充分洗脱,但同时也会把一些杂质淋洗出来,使得上机测定时形成杂峰,对分离检测造成一定干扰。
通过GC-MS选择离子扫描发现,用4种净化柱分别净化上述提取液(2.2.1节)时,C18柱净化的样品的基线噪音相对较低,表明C18柱去除干扰物的能力较强,净化效果较好。进而对比4种净化柱的样品回收率,结果(图3)表明,采用C18固相萃取柱净化样品时,土壤样品中PAHs总量回收率最高,回收率均值达到84.5%,其次为手工装填的硅胶/氧化铝层析柱,回收率均值为80.9%,而硅胶柱回收率均值为76.4%,弗罗里硅土柱回收率均值为73.7%。手工装填的硅胶/氧化铝层析柱,由于难以统一每个层析柱内部吸附剂的疏密程度,实验误差较大,在样品回收率上也没有优势。比较每种净化柱的回收率和净化效果发现,选用C18固相萃取柱净化样品,不仅净化效果好,而且样品回收率高,实验误差较低。
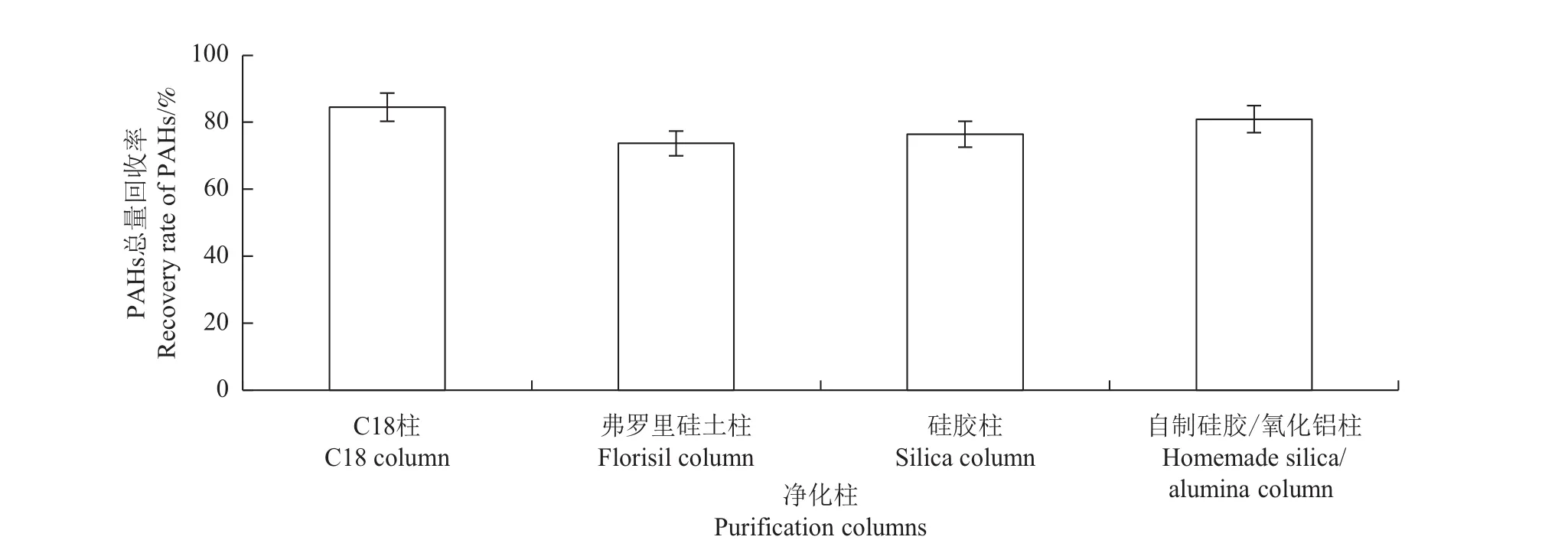
图3 在不同净化柱条件下PAHs总量回收率Fig.3 Recovery rate of PAHs using different purification columns
2.2.3 洗脱溶剂及最佳用量
多环芳烃属于非极性、弱极性物质,洗脱溶剂的种类与体积对多环芳烃洗脱效果存在很大的影响。溶剂极性太弱,会导致不必要的杂质被洗脱出来;溶剂极性太强,有些目标组分则不易被洗脱。在确定C18固相萃取柱之后,本研究选择常用的3种淋洗溶剂:正己烷溶液、正己烷/二氯甲烷(体积比为1∶1)混合溶液、正己烷/二氯甲烷(体积比为7∶3)混合溶液,对上述提取液(2.2.1节)进行洗脱。结果(图4)表明,在采用V(正己烷)∶V(二氯甲烷)=7∶3的混合溶液洗脱提取液时,土壤样品中PAHs总量回收率最高,其次为V(正己烷)∶V(二氯甲烷)=1∶1的混合溶液,而正己烷溶液洗脱效果最差。因此,本文选用V(正己烷)∶V(二氯甲烷)=7∶3的混合溶液作为洗脱溶剂进行最佳用量实验。
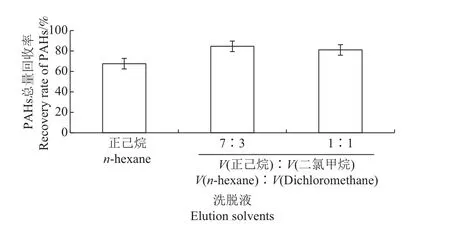
图4 不同洗脱液对PAHs总量回收率的影响Fig.4 Effect of different elution solvents on recovery rate of PAHs
从节约时间和减少溶剂消耗的角度考虑,本文考察了洗脱剂用量分别为4、6、8、10、12、14 mL时的样品回收率,从而进一步确定所需洗脱剂的最佳用量。结果(图5)表明:随着洗脱剂用量的增加,土壤样品中16种PAHs总量回收率呈上升趋势;当洗脱剂量大于8 mL时,洗脱剂用量的增加对回收率的影响已不明显,16种PAHs总量回收率趋于稳定,表明此时PAHs已经能够被完全有效洗脱。因此,认为8 mL V(正己烷)∶V(二氯甲烷)=7∶3的混合溶液为最佳洗脱剂用量条件。

图5 不同洗脱剂用量对PAHs总量回收率的影响Fig.5 Effect of different elution volumes on recovery rate of PAHs
2.2.4 氮吹温度
为确定最适氮吹温度,本研究采用16种PAHs混合标样(每份10 mL,100 μg/L)考察在不同氮吹温度(20、30、40℃)下16种PAHs的回收率。结果(图6)显示,随着实验所设氮吹温度的升高,16种PAHs的回收率呈下降趋势,其中低环PAHs尤其明显。这主要是由于低环PAHs沸点较低,氮吹温度的升高加速了其挥发损失。因此,20℃时16种PAHs的挥发损失最少,回收率最高,为最佳氮吹温度。
2.3 方法学验证
2.3.1 线性关系与检出限
在实验设定的气相色谱-质谱条件下,配制7个质量浓度梯度的标准溶液制作标准曲线,PAHs混合标样(每个组分)的质量浓度分别为10、20、50、100、200、500、1 000 μg/L,以特征离子响应的峰面积为定量依据,进行线性回归分析。结果(表2)显示:16种PAHs的相关系数均大于0.999(0.999 0~0.999 9),线性关系良好;在3倍信噪比(S/N)条件下确定方法检出限为0.022~0.470 μg/kg。说明这种分析条件能够满足水稻土中PAHs物质的痕量分析要求。
2.3.2 方法精密度及回收率
选用供试土壤样品(1.2节),分别加入1 mL质量浓度为200、400、1 000 μg/L的16种PAHs混合标样制备成40、80、200 μg/kg的污染土壤样品(按1.3节污染土壤制备方法处理)。按优化后的前处理条件,用GC-MS法进行测定,外标法定量,进行土壤基质加标回收实验,每个浓度水平做5次平行。
结果(表3)显示,萘的回收率相对较低(70.2%~82.9%),其余PAHs在3个不同水平加标量下的回收率均较高。这主要是由于萘本身化学性质不稳定且易挥发,在提取净化过程中较易损失,在其他研究中也存在类似结果[13]。16种PAHs在3种实验处理下平均加标回收率在70.2%~110.8%之间,变异系数在1.8%~9.8%之间,显示出较好的精密度。与相关文献报道[14-15]相比,本文确定的分析方法的回收率和分析方差均较优。

图6 16种多环芳烃在不同氮吹温度条件下的回收率Fig.6 Recovery rate of 16 PAHs under different nitrogen blowing temperatures
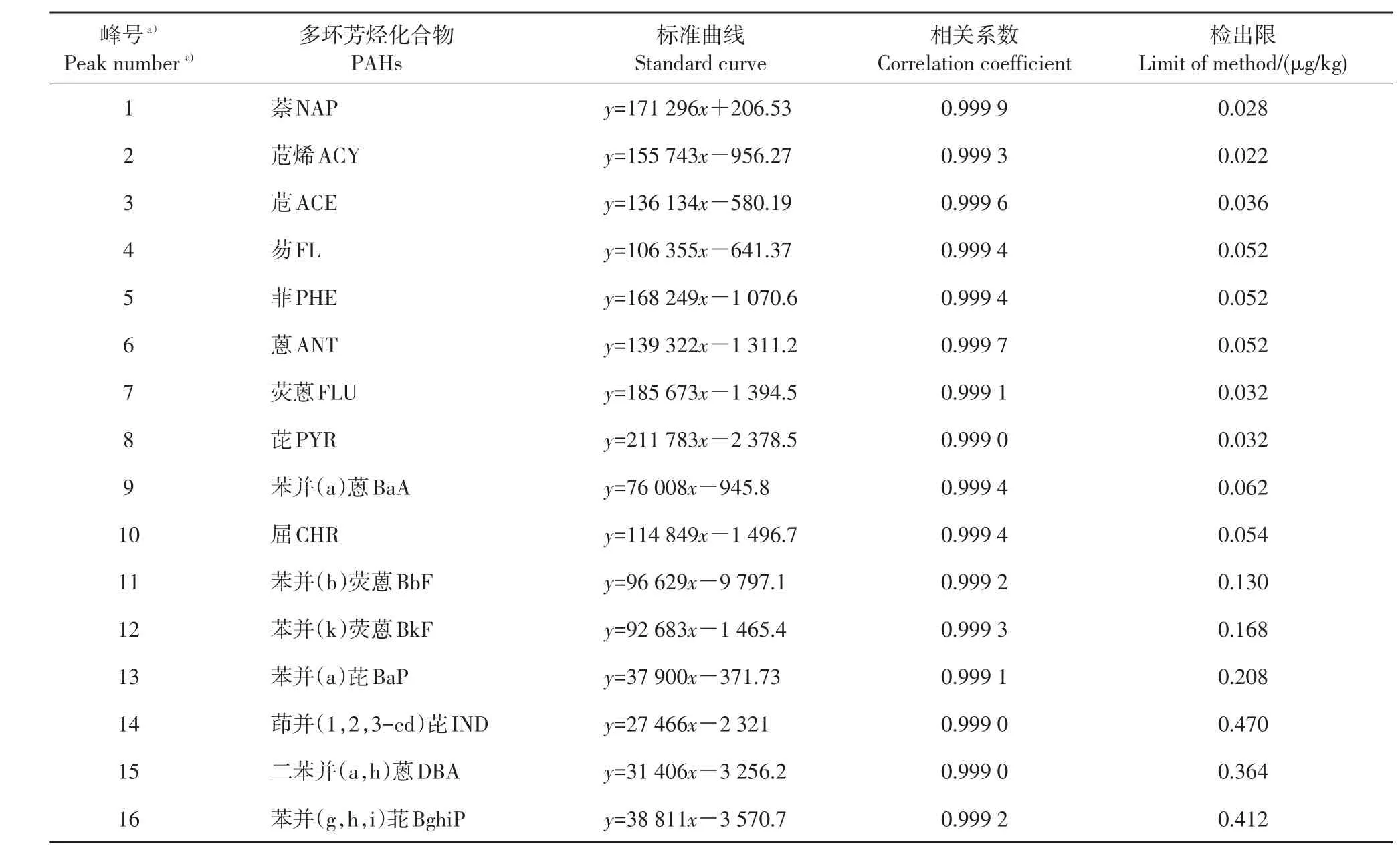
表2 16种多环芳烃的线性方程、相关系数及检出限Table 2 Linear equations,correlation coefficients and detection limits of 16 PAHs
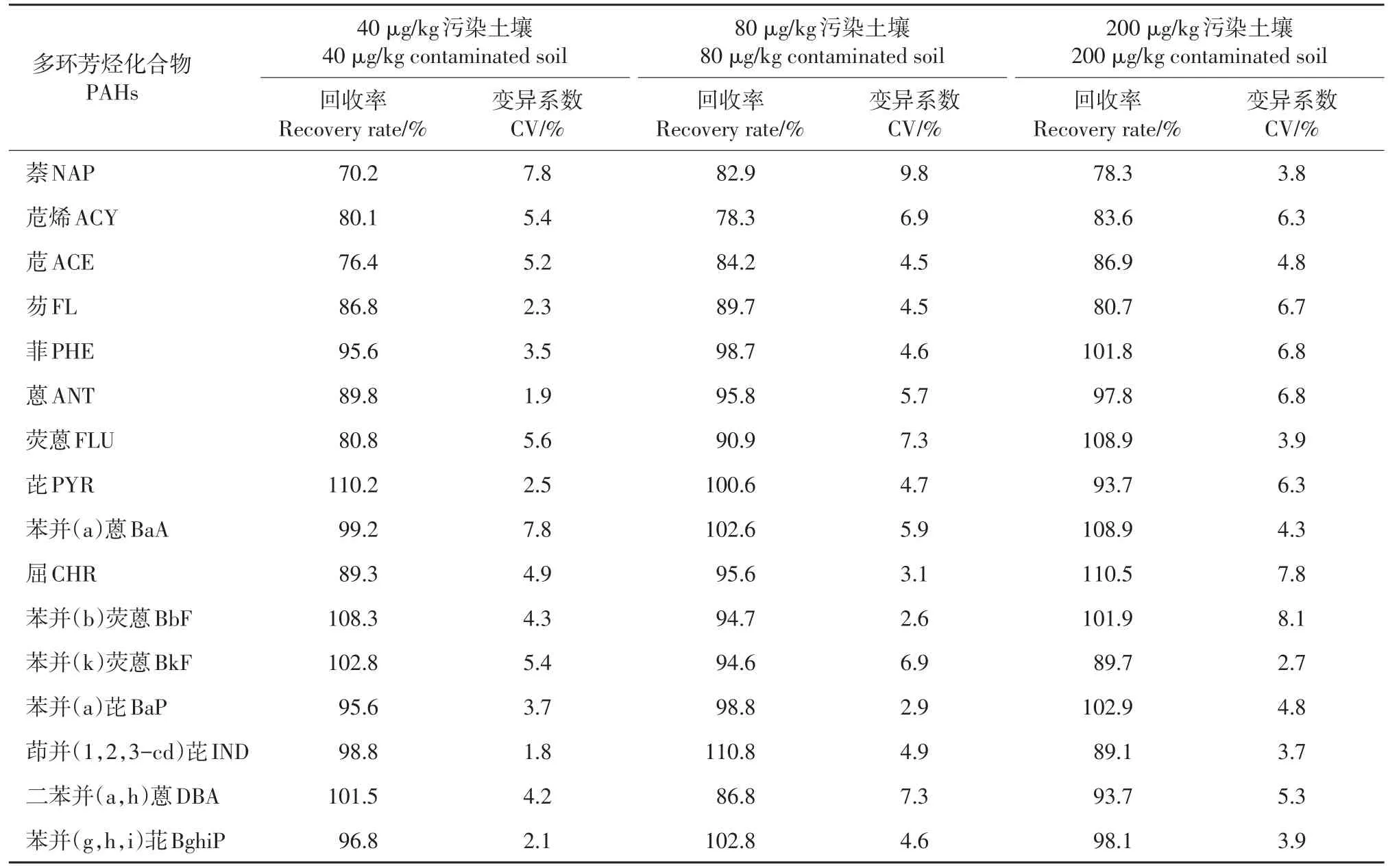
表3 16种多环芳烃土壤加标回收率及相对标准偏差(n=5)Table 3 Average recovery rate and relative standard deviation(n=5)of 16 PAHs in spiked soils
3 讨论
土壤中PAHs测定的关键步骤是样品的提取和净化,不同文献提供了不同的提取和净化方法,但各有优劣。土壤中多环芳烃常用的提取方法有索氏提取、超声提取、加速溶剂萃取技术等。马栋等[16]比较了超声提取、索氏提取和振荡提取3种方法对土壤中多环芳烃的提取效果,结果表明,3种方法均能有效地将土壤中的多环芳烃提取出来,且回收率较好。索氏提取法虽然提取效率高,适用范围广,但是提取时间长且操作繁琐,溶剂使用量大,而且在2次旋蒸和样品转移过程中容易造成多环芳烃中易挥发组分的损失。加速溶剂萃取技术法萃取效率高,自动化程度高,但是其在从土壤样品中提取PAHs的应用还处于探索阶段,且设备投资大,运行成本高,受到一定限制。超声提取法相对于其他方法操作简单、省时,提取效率高,可减少分析时间和溶剂消耗,适合实验室条件下操作。本测定方法采用3次30 min超声提取,既保证了对目标物的充分提取,也避免了由于单次长时间的超声波作用于液体产生“空化效应”而使小分子物质被轰击溢出的损失[17]。
马军等[18]在测定植烟土壤中的多环芳烃时,比较了正己烷、二氯甲烷、V(正己烷)∶V(二氯甲烷)=1∶1混合液3种洗脱剂的洗脱效果,结果发现:采用正己烷作为洗脱剂时,16种PAHs的加标回收率为67.8%~83.2%,洗脱率低;采用二氯甲烷作为洗脱剂时易将提取液中的色素、极性物质等杂质带入洗脱液,上机测定时会形成大量杂峰,干扰分离检测;采用正己烷-二氯甲烷混合液作为洗脱液时,16种PAHs的加标回收率为83.6%~112.8%,洗脱效率高,杂质少,效果最佳。与本实验所确定的V(正己烷)∶V(二氯甲烷)=7∶3混合溶液作为洗脱剂效果较好的结果一致。崔艳红等[9]比较了天津污灌区土壤中多环芳烃的提取条件、样品净化方法和测定条件,认为在140℃下用V(二氯甲烷)∶V(丙酮)=1∶1混合溶液提取5 min,再用硅胶柱净化后用GC-MS测定可以得到很好的效果,该方法的回收率在57%~140%范围内,检出限为3.5×10-4~1.1×10-3mg/L。固相萃取净化柱是对样品中多环芳烃净化运用较多的方法,常用的有硅胶、弗罗里硅和C18固相萃取净化柱。本文采用商品化的C18固相萃取小柱代替人工填充的层析柱,不仅简化了实验操作步骤,减少了人为污染,更提高了方法的精确度和重现性。
4 结论
本文以水稻土为研究对象,优化了样品前处理条件,完善了水稻土中痕量PAHs的分析测定方法。以V(正己烷)∶V(丙酮)=1∶1混合溶液为提取溶剂,经3次超声提取后,浓缩液采用C18固相萃取小柱和8 mL的V(正己烷)∶V(二氯甲烷)=7∶3洗脱溶液净化提取液,在20℃氮吹温度条件下浓缩洗脱液,利用气相色谱-质谱法进行定性和定量分析。结果显示,16种PAHs在10~1 000 μg/L质量浓度范围内线性相关良好,方法检出限为0.022~0.470 μg/kg,回收率在70.2%~110.8%之间,相对标准偏差为1.8%~9.8%。与其他测定方法相比,该方法分析精密度高、重复性好,能减少样品的损失和污染,且在实验室条件下易于实现并能减少有机试剂的消耗和人体暴露接触,适用于水稻土中痕量PAHs的检测。
[1] WANG X T,MIAO Y,ZHANG Y,et al.Polycyclic aromatic hydrocarbons(PAHs)in urban soils of the megacity Shanghai:Occurrence,source apportionment and potential human health risk.Science of the Total Environment,2013,447:80-89.
[2] 中华人民共和国农业行业标准.绿色食品产地环境质量标准:NY/T391—2000.北京:中国标准出版社,2003.Agriculture Industry Standards of the People’s Republic of China.Environmental technical terms for green food production area:NY/T391—2000.Beijing:Standards Press of China,2003.(in Chinese)
[3] 孙剑英,刘五星,骆永明,等.气相色谱-质谱法测定含油污泥污染土壤中的多环芳烃.土壤,2013,45(1):111-115.SUN J Y,LIU W X,LUO Y M,et al.Determination of PAHs in oily sludge-contaminated soil by gas chromatography-mass spectrometry.Soils,2013,45(1):111-115.(in Chinese with English abstract)
[4] 高军刚,孔祥虹,何强,等.气相色谱-串联质谱法测定大豆提取物中16种多环芳烃和16种邻苯二甲酸酯类.分析实验室,2013,32(5):65-70.GAO J G,KONG X H,HE Q,et al.Determination of 16 kinds of PAHs and 16 kinds of PAEs in soybean extract by gas chromatography-tandem mass spectrometry.Chinese Journal of Analysis Laboratory,2013,32(5):65-70.(in Chinese with English abstract)
[5] 刁春燕,周启星,周俊良,等.土壤、沉积物和植物样品中多环芳烃(PAHs)不同提取与净化方法比较.农业环境科学学报,2011,30(12):2399-2407.DIAO C Y,ZHOU Q X,ZHOU J L,et al.Comparison of extraction and purification methods for polycyclic aromatic hydrocarbons(PAHs)in soil,sediment and plant samples.Journal of Agro-Environment Science,2011,30(12):2399-2407.(in Chinese with English abstract)
[6] 胡琳玲,刘遵莹,刘秋玲,等.高效液相色谱法同时检测黑茶中16种多环芳烃化合物.茶叶科学,2014,34(4):324-330.HU L L,LIU Z Y,LIU Q L,et al.Simultaneous determination of 16 polycyclic aromatic hydrocarbons in dark tea by HPLC.Journal of Tea Science,2014,34(4):324-330.(in Chinese with English abstract)
[7] 平华,李杨,潘立刚,等.加速溶剂萃取-气相色谱质谱法测定土壤中多环芳烃的含量.食品安全质量检测学报,2012,3(6):695-699.PING H,LI Y,PAN L G,et al.Determination of polycyclic aromatic hydrocarbons residues in soil by GC/MS equipped with accelerated solvent extraction.Journal of Food Safety and Quality,2012,3(6):695-699.(in Chinese with English abstract)
[8] 鲁如坤.土壤农业化学分析方法.北京:中国农业科技出版社,1999:60-67.LU R K.Analytical Methods of Soil Agrochemistry.Beijing:China Agricultural Science and Technology Press,1999:60-67.(in Chinese)
[9] 崔艳红,朱雪梅,郭丽青,等.天津污灌区土壤中多环芳烃的提取、净化和测定.环境化学,2002,21(4):392-396.CUI Y H,ZHU X M,GUO L Q,et al.Measurement of PAHs in soil samples from wastewater irrigated soil from Tianjin.Environmental Chemistry,2002,21(4):392-396.(in Chinese with English abstract)
[10]冯雪,李剑,滕彦国,等.吉林松花江沿岸土壤中有机氯农药残留特征及健康风险评价.环境化学,2011,30(9):1604-1610.FENG X,LI J,TENG Y G,et al.Residues and health risk assessment of organochlorine pesticides in soils on the shore of Songhua River in Jilin City,China.Environmental Chemistry,2011,30(9):1604-1610.(in Chinese with English abstract)
[11]张晓梅,张竹青,黄文鹏.超声萃取-高效液相色谱法测定土壤中多环芳烃.环境科学与管理,2010,35(7):124-127.ZHANG X M,ZHANG Z Q,HUANG W P.Determination of polycyclic aromatic hydrocarbons in soil by ultrasonic extractionhigh performance liquid chromatography.Environmental Science and Management,2010,35(7):124-127.(in Chinese with English abstract)
[12] 朱莹莹,赵新建,吴晓雯,等.涂料中16种多环芳烃的气相色谱-质谱法研究.涂料工业,2013,43(3):73-77.ZHU Y Y,ZHAO X J,WU X W,et al.Determination of 16 polycyclic aromatic hydrocarbons in coatings by gas chromatography-mass spectrometry.Paint and Coatings Industry,2013,43(3):73-77.(in Chinese with English abstract)
[13]倪进治,王军,李小燕,等.超高效液相色谱荧光检测器测定土壤中多环芳烃.分析试验室,2010,29(5):25-28.NI J Z,WANG J,LI X Y,et al.Determination of polycyclic aromatic hydrocarbons in soil by ultra performance liquid chromatography with a fluorescence detector.Chinese Journal of Analysis Laboratory,2010,29(5):25-28.(in Chinese with English abstract)
[14]张茜,刘潇威,罗铭,等.快速溶剂(ASE)提取、凝胶渗透色谱(GPC)联合固相萃取(SPE)净化,高效液相色谱法测定土壤中的多环芳烃.环境化学,2011,30(4):771-776.ZHANG Q,LIU X W,LUO M,et al.Determination of polycyclic aromatic hydrocarbons in soil by ASE-GPC-SPE purification and HPLC detection.Environmental Chemistry,2011,30(4):771-776.(in Chinese with English abstract)
[15]王道玮,赵世民,金伟,等.加速溶剂萃取-固相萃取净化-气相色谱/质谱法测定沉积物中多氯联苯和多环芳烃.分析化学,2013,41(6):861-868.WANG D W,ZHAO S M,JIN W,et al.Simultaneous determination of 28 polychlorinated biphenyls and 16 polycyclic aromatic hydrocarbons in sediments using ASE-SPE-GC-QqQ-MS/MS.Chinese Journal of Analytical Chemistry,2013,41(6):861-868.(in Chinese with English abstract)
[16]马栋,廖晓勇,阎秀兰,等.工业污染场地土壤中多环芳烃测定方法研究.内江科技,2015,36(12):35-36.MA D,LIAO X Y,YAN X L,et al.Methods of determination of polycyclic aromatic hydrocarbons(PAHs)in the soil of industrial contaminated sites.Chinese Journal of Neijiang Technology,2015,36(12):35-36.(in Chinese)
[17]潘峰,耿秋娟,楚红杰,等.油田地表土壤中多环芳烃提取方法改进研究.河南师范大学学报(自然版),2011,39(5):88-91.PAN F,GENG Q J,CHU H J,et al.Improvement research on extraction of polycyclic aromatic hydrocarbons(PAHs)in soils at oilfield ground.Journal of Henan Normal University(Natural Science Edition),2011,39(5):88-91.(in Chinese with English abstract)
[18]马军,滕应,陆引罡,等.植烟土壤中16种多环芳烃的洗脱净化技术及含量测定.环境污染与防治,2017,39(3):258-262.MA J,TENG Y,LU Y G,et al.Elution and purification of 16 polycyclic aromatic hydrocarbons in tobacco-planting soil and the content determination.Environmental Pollution and Control,2017,39(3):258-262.(in Chinese with English abstract)

