卵母细胞滑面内质网聚集对MII卵母细胞有效胚胎形成率的影响
潘家坪,阮井玲,黄媚媛,王羽,梁珊珊,滕晓明,吴海霞
(同济大学附属第一妇婴保健院生殖医学中心,上海 201202)
内质网(Endoplasmic Reticulum,ER)是一种在进化上高度特化的细胞器,调控蛋白的合成、折叠、修饰以及分泌蛋白和膜表面蛋白的转运(粗面内质网)。作为细胞内最重要的Ca2+储存细胞器,滑面内质网(Smooth Endoplasmic Reticulum,SER)对维持细胞内Ca2+自稳发挥着重要的作用[1-2],滑面内质网对受精过程中卵母细胞活化亦发挥着重要作用[3-4]。
卵母细胞内滑面内质网聚集(Smooth Endoplasmic Reticulum Aggregates,SERa)是卵母细胞胞浆内的一种异常滑面内质网聚集体,干扰Ca2+震荡从而影响卵母细胞受精[5],进而影响胚胎发育和胚胎种植。Shaw-Jackson等[6]研究发现,体外受精行促排卵患者中10%周期出现滑面内质网聚集,而19%~34%卵母细胞可出现滑面内质网聚集。已有研究证实卵母细胞出现滑面内质网聚集可导致受精、胚胎发育异常,妊娠率降低以及出现新生儿异常[3,7]。由于SERa+卵母细胞来源的胚胎移植后异常妊娠结局显著增加,2011年ESHR会议伊斯坦布尔共识不推荐移植SERa+胚胎[8],然而其他研究发现SREa+胚胎移植后可分娩正常健康的新生儿[9-10]。本研究就卵母细胞内滑面内质网聚集对卵母细胞利用率的影响进行回顾性分析。
资料和方法
一、研究对象
回顾性分析2013年1月至2014年12月在同济大学附属上海第一妇婴保健院生殖医学中心行ICSI-ET助孕治疗患者的临床资料。
纳入标准:(1)受精方式为ICSI;(2)新鲜取卵周期;(3)卵裂期胚胎。
排除标准:(1)IVF-ET;(2)冷冻卵母细胞;(3)冻融胚胎移植周期;(4)睾丸穿刺取精或副睾穿刺取精;(5)植入前遗传学诊断或筛查。
根据卵母细胞有无SERa分为两组:A组:SERa阳性组(至少有1个卵母细胞SERa+)50周期,共414个MII卵母细胞,其中包括111个SERa+卵母细胞及303个SERa-卵母细胞;B组:SERa阴性组(所有卵母细胞均无SER聚集)200周期,共1 390个MII卵母细胞。
所有患者均签署知情同意书。
二、方法
1.卵母细胞SERa:在辅助生殖的体外授精ICSI过程中,将包绕颗粒细胞的卵母细胞拆除后观察,发现有一部分异常卵母细胞的存在,在高倍镜下(×400)可见该卵母细胞带有一个甚至多个折光体,该折光体称为囊。卵母细胞内的囊由膜包裹,内为液体,液体成分通常与透明带下间隙内液体成分一致,由滑面内质网融合而成[11](图1)。此囊性结构其实就是滑面内质网聚集(SERa)。
2. ICSI及胚胎评分:ICSI后的卵细胞在卵裂培养液中培养大约16 h后,观察2PN情况,约68 h后观察受精卵有无卵裂并且对胚胎进行评分:卵裂球大小均匀,无碎片为Ⅰ级胚胎;卵裂球大小均匀,碎片<25%为Ⅱ级胚胎;卵裂球大小不均匀,无碎片为Ⅲ胚胎;卵裂球大小不均匀,碎片<25%为Ⅳ胚胎;卵裂球大小均匀或不均匀,胞质内出现大量碎片为Ⅴ胚胎;卵裂球分辨不清,且胞质内出现大量碎片为Ⅵ胚胎。Ⅰ~Ⅱ级为优质胚胎,Ⅰ~Ⅳ级胚胎为可利用胚胎,Ⅴ及Ⅵ级胚胎因胚胎质量差或被丢弃。
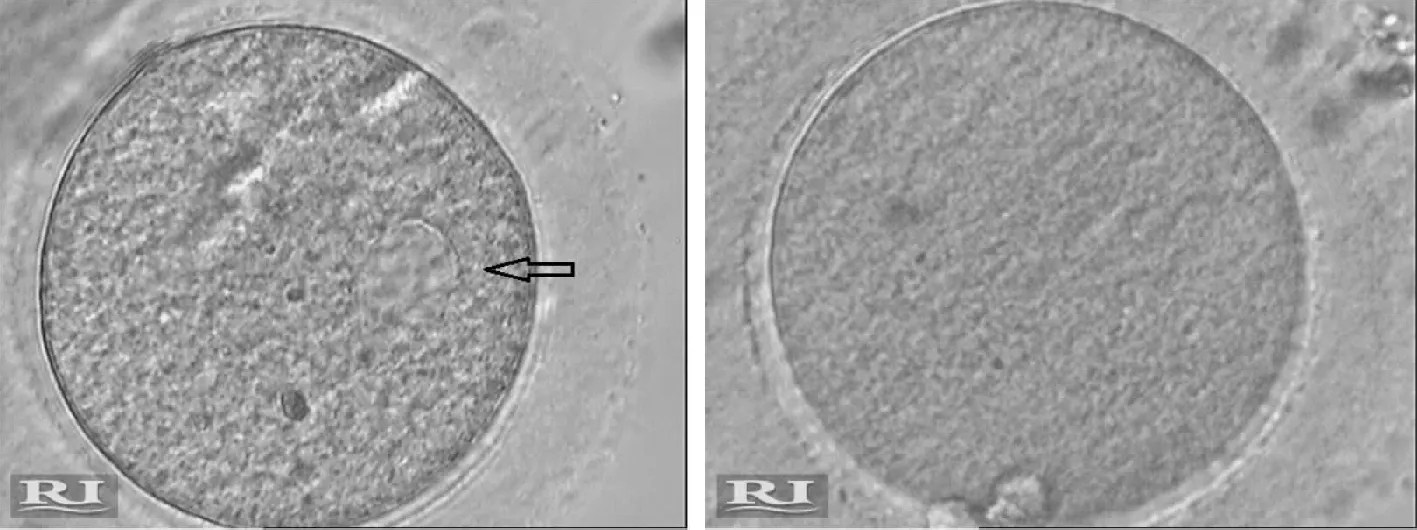
A:SERa+卵母细胞(箭头示SERa);B:正常卵母细胞图1 拆除颗粒细胞后的卵母细胞光镜下形态(×400)
3.主要观测指标:MII卵率以MII卵数/获卵数×100%计算;受精率以受精数/MII卵母细胞数×100%计算;异常受精率以异常受精卵母细胞数(>2PN)/MII卵数×100%计算;卵裂率以卵裂胚胎数/受精数×100%计算;有效胚胎形成率以可用卵裂期胚胎数/卵裂数×100%计算;卵母细胞利用率以可用卵裂期胚胎数/MII卵数×100%计算。
三、统计学分析

结 果
一、一般资料
本研究共纳入250个周期239例患者1 804个成熟卵母细胞。其中A组50周期49例患者414个成熟卵母细胞,包括111个SERa+卵母细胞及303个SERa-卵母细胞;B组200周期190例患者1 390个成熟SERa-卵母细胞。
两组患者年龄、BMI、不孕时间、基础FSH等方面比较均无统计学差异(P>0.05),两组患者COS方案、Gn用量、促排时间及HCG日血E2水平相比亦均无统计学差异(P>0.05)(表1)。
二、两组患者卵母细胞利用率比较
与B组相比,A组成熟卵母细胞率显著增加(P<0.01),卵母细胞受精后卵裂率、有效胚胎形成率及卵母细胞利用率显著降低(P<0.05),异常受精率显著增加(P<0.05)(表2)。

表1 两组患者一般情况比较[(-±s),%]
注:与B组比较,*P<0.05
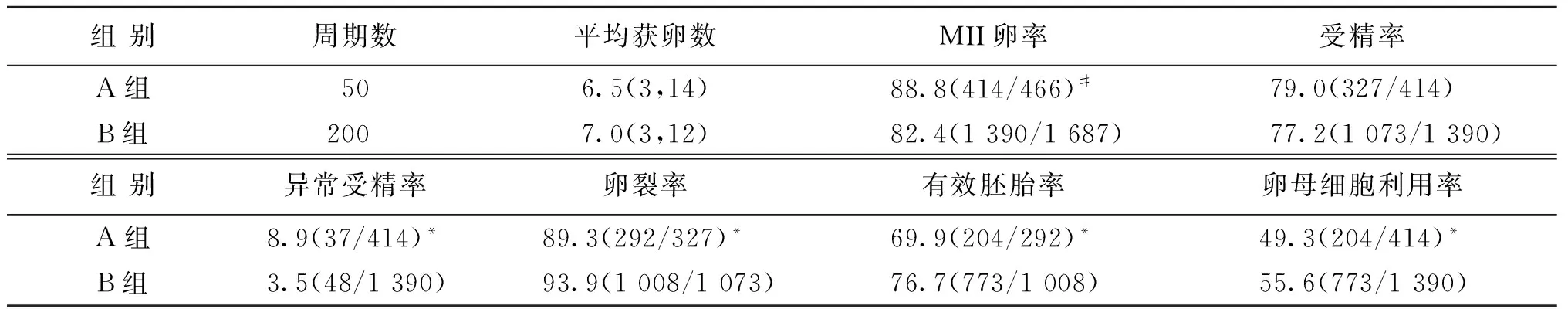
表2 两组患者卵母细胞利用率比较(%)
注:获卵均数不符合正态分布,所以用秩和检验;与B组比较,*P<0.05,#P<0.01
三、A组中SERa-卵母细胞与B组SERa-卵母细胞的利用率比较
同样我们的研究提示,A组中的SERa-卵母细胞成熟率、异常受精率均显著高于B组SERa-卵母细胞,而受精后的卵裂率、有效胚胎形成率及卵母细胞利用率均显著低于B组(P<0.05)(表3)。
四、A组中SERa-卵母细胞与A组SERa+卵母细胞的利用率比较
除了SERa+卵母细胞异常受精率显著增加(P<0.05)外,两种卵母细胞成熟率,受精率、卵裂率、有效胚胎形成率及卵母细胞利用率均无显著性差异(均P>0.05)(表4)。
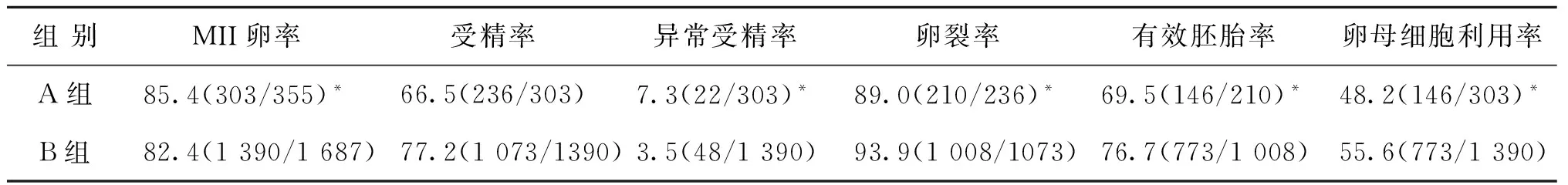
表3 A组中SERa-卵母细胞与B组SERa-卵母细胞的利用率比较(%)
注:A组SERa-卵母细胞与B组SERa-卵母细胞比较,*P<0.05

表4 A组中SERa+卵母细胞与SERa-卵母细胞的利用率比较(%)
注:与SERa-卵母细胞比较,*P<0.05
讨 论
卵母细胞胞浆内SERa的出现可能归因于卵巢过度刺激[12],目前研究证实SERa往往出现于Gn用量多时间长的周期[7,13]。Setti等[14]进行了预测分析,发现母体年龄,FSH用量及HCG日血E2水平与SERa的出现无关,然而卵泡数目及获卵数目显著增加了卵母细胞SERa的风险。SERa可影响细胞内Ca2+震荡从而影响卵母细胞受精[5],我们的研究发现SERa+周期无论是SERa+卵母细胞还是SERa-卵母细胞,亦或者是SERa+周期与SERa-周期相比,其受精率显著降低,而异常受精率显著增加,可能与卵母细胞胞浆内滑面内质网聚集干扰受精过程中Ca2+自稳和震荡相关,这与其他研究者的发现相一致。
Braga等[15]研究发现卵母细胞内SERa可使囊胚形成率降低35%左右,妊娠率降低67%而流产率增加20%,然而Setti等[14]研究发现卵母细胞内SERa不影响受精、卵裂期胚胎质量及囊胚形成,但显著降低种植率。我们的研究发现SERa+周期无论是SERa+卵母细胞还是SERa-卵母细胞,卵裂期有效胚胎形成率及卵母细胞利用率均显著降低。Setti等[14]的研究对象主要为黄体期长方案促排卵的患者,而我们的研究纳入了所有控制性卵巢刺激方案的患者,这种不同的纳入标准可能导致研究结果的差异。由于SERa+的胚胎不作为首选移植胚胎,许多SERa+胚胎都没有机会被移植,仅少部分该类胚胎被移植,所以我们的研究只能以MII卵母细胞有效胚胎形成率作为最终观察指标,而不能以妊娠率或者是种植率等其他更直接的指标作为观察指标。所以本研究的意义可能受到限制,今后或可做某些进一步工作。
在体外培养过程中,温度、培养液pH值变化以及高氧环境均可影响植入前胚胎的发育,这些理化因素的改变激发内质网压力应对机制,内质网维持胚胎发育过程中细胞代谢、蛋白表达自稳,卵母细胞胞浆内滑面内质网聚集,可能与线粒体相互作用,干扰胚胎发育过程的能量代谢及基因表达,从而导致有效胚胎形成率降低及卵母细胞利用率低下。仍需进一步研究,实验室动物模型研究阐明滑面内质网聚集影响ICSI胚胎质量的分子机制。
在我们的研究中我们发现SERa阳性周期中即使是SERa-卵母细胞其受精率、有效胚胎形成率及利用率均显著低于SERa阴性周期的卵母细胞,Otsuki等[16]研究证实SERa+周期中普通光学显微镜下未发现SERa的卵母细胞在电子显微镜下可看到SERa,表明在SERa+周期内,即使卵母细胞在普通光学显微镜下未看到SERa,但实际上这些卵母细胞中还是存在极小的SERa,其大小往往在2~9 μm左右,因此我们研究中SERa+周期中SERa-卵母细胞利用率低下可能是因为普通光学显微镜未发现的极小SERa所致。
我们的研究还比较了SERa+周期中SERa+卵母细胞及SERa-卵母细胞利用率的差别,我们发现除了SERa+卵母细胞异常受精率显著增加外,受精率、卵裂期有效胚胎形成率及卵母细胞利用率无显著性差异,这可能与极小的电子显微镜下可见的SERa有关。在我们的研究中我们还发现出现SERa的卵母细胞成熟度显著增加,这与Setti等[14]的研究相一致,目前还需进一步通过动物实验来阐明这种SERa+卵母细胞高成熟度的分子机制。
总之,本研究证实卵母细胞内滑面内质网聚集可显著降低受精率、有效胚胎形成率进而影响卵母细胞利用率。因此,对于ICSI术中仔细观察卵母细胞有无滑面内质网聚集对指导胚胎移植策略重要的意义。我们的研究尚存在不足,样本数量太少,未涉及SERa+胚胎移植结局,因此还需大样本多中心的研究证实我们的研究结果。
[1] Krebs J,Agellon LB,Michalak M. Ca2+ homeostasis and endoplasmic reticulum(ER)stress:An integrated view of calcium signaling[J]. Biochem Biophys Res Commun,2015,460:114-121.
[2] GuzelE,Arlier S,Guzelolu-Kayisli O,et al. Endoplasmic reticulum stress and homeostasis in reproductive phsiology and pathology[J]. Int J Mol Sci,2017,63:377-382.
[3] Kovalskaya EV,Makarova NP,Syrkasheva AG,et al.Mechanisms of smooth endoplasmic reticulum aggregates creation in oocyte’s cytoplasm in IVF cycles and its clinical relevance(literature review)[article in Russian][J]. Tsitologiia,2015,57:129-134.
[4] Palmerini MG,Antinori M,Maione M,et al. Ultrastructure of immature and mature human oocytes after Cryotopvitrification[J]. J Reprod Dev,2014,60:411-420.
[5] Van Blerkom J. Mitochondrial function in the human oocyte and embryo and their role in developmental competence[J]. Mitochondrion,2011,11:797-813.
[6] Shaw-Jackson C,Van Beirs N,Thomas AL,et al. Can healthy babiesorifinae from oocytes with smooth endoplasmic reticulum aggregates? A systematic mini-review[J]. Hum Reprod,2014,29:1380-1386.
[7] Shaw-Jackson C,Van Beirs N,Thomas AL,et al. Can healthy babies originate from oocyte with smooth endoplasmic reticulum aggregates? A systermatic mini-review[J]. Hum Reprod,2014,29:1382-1386.
[8] Alpha Scientists in Reproductive Medicine and European Society of Human Reproduction and Embryology(ESHRE)Special Interest Group of Embryology.The Istanbul consensus workshop on embryo assessment:proceedings of an expert meeting[J]. Hum Reprod,2011,26:1270-1283.
[9] Mateizel I,Van Landuyt L,Tournaye H,et al. Deliveries of normal healthy babies from embryos originating from oocytes showing the presence of smooth endoplasmic reticulum aggregates[J]. Hum Reprod,2013,28:2111-2117.
[10] Hattori H,Nakamura Y,Nakajo Y,et al. Deliveries of babies with normal health derived from oocytes with smooth endoplasmic reticulum clusters[J]. J Assist Reprod Genet,2014,31:1461-1467.
[11] 孙正怡. 卵母细胞质量评估的意义和手段[J].生殖医学杂志,2007,26:399-402.
[12] Van Blerkom J,Henry G. Oocyte dysmorphism and aneuploidy in meiotically mature human oocytes after ovarian stimulation[J]. Hum Reprod,1992,7:379-390.
[13] Ebner T,Moser M,Shebl O,et al. Prognosis of oocytes showing aggregation of smooth endoplasmic reticulum[J/OL]. Reprod Biomed Online,2008,16:113-118.
[14] Setti AS,Figueira RC,de Almeida Ferreira Braga DP,et al. Oocytes with smooth endoplasmic reticulum clusters originate blastocysts with impaired implantation potential[J]. Fertil Steril,2016,106:1718-1724.
[15] Braga DP,Setti AS,Figueira RDCC,et al.Influence of oocyte dysmorphisms on blastocyst formation and quality[J]. Fertil Steril,2013,100:748-754.
[16] Otsuki J,Okada A,Morimoto K,et al. The relationship between pregnancy outcome and smooth endoplasmic reticulum clusters in MII human oocytes[J].Hum Reprod,2004,19:1591-1597.

