脐带间充质干细胞鞘内注射治疗脊髓损伤的长期临床观察
刘静 韩冬梅 薛梅 阎洪敏 董磊 朱玲 郭子宽 王恒湘
脐带间充质干细胞鞘内注射治疗脊髓损伤的长期临床观察
刘静 韩冬梅 薛梅 阎洪敏 董磊 朱玲 郭子宽 王恒湘
目的观察脐带间充质干细胞(UC-MSCs)鞘内注射治疗脊髓损伤(SCI)的临床疗效及安全性。方法对2008年1月至2013年10月收治的35例SCI患者,给予UC-MSCs鞘内注射治疗,共46疗程,每次输注细胞1×106cells/Kg,1次/周,4次为1个疗程。采用美国脊髓损伤协会制定的脊髓损伤神经功能评分标准(ASIA标准),对患者治疗前后神经功能进行评定;采用国际神经修复学会脊髓损伤功能评价量表(IANR-SCIRFS),对患者治疗前后日常生活活动能力进行评定。结果35例患者中22例有效,有效患者治疗结束后1个月(与治疗前相比),其痛觉、触觉、运动、日常生活活动能力评分均明显升高(P<0.01)。9例有效的患者接受了2~3个疗程治疗,7例疗效有进一步提高。25例不完全性SCI患者有效率达88%,10例完全性SCI患者均无效。治疗后个别患者出现头痛、腰痛或发热,均在1~3 d内消失。随访45~114个月(平均84个月),无治疗相关不良事件发生,有效患者疗效稳定。结论UC-MSCs鞘内注射治疗是安全的,可改善大部分不完全性SCI患者的神经功能,多疗程治疗有可能使患者疗效得到进一步提高。
脐带间充质干细胞 脊髓损伤 鞘内注射
SCI是一类中枢神经系统的严重致残性疾病,常导致瘫痪及大、小便失禁,对患者的生活质量造成很大影响。传统的手术、药物、康复等在促进患者神经功能恢复上并未取得显著进展,而通过细胞治疗保护甚至替代损伤神经元及胶质细胞已成为当前神经再生的新策略。UC-MSCs来源于脐带,易于获取,体外能够大量扩增,且低免疫原性。我们将体外扩增的UC-MSCs经鞘内注射治疗35例SCI患者,取得较好疗效,现报道如下。
1 资料与方法
1.1 研究对象
2008年1月至2013年10月收治的35例SCI患者。其中,男27例,女8例,年龄18~51岁(平均34岁)。损伤部位:颈髓6例,颈髓+胸髓3例,胸髓15例,胸髓+腰髓2例,腰髓7例,颈髓+胸髓+腰髓1例,腰骶髓1例。损伤时间2~204个月(平均56个月)。损伤原因:外伤所致30例,包括高空坠落11例,车祸9例,砸伤6例,跳水损伤2例,摔伤、枪伤各1例;疾病所致5例,包括脊髓炎后遗症2例,脊髓栓系综合征、放射性脊髓病、脊髓前动脉综合征各1例。治疗方法及风险均如实告知患者,患者均签署知情同意书,治疗方案经医院医学伦理委员会批准。所有患者均具有干细胞治疗适应证:无发热、感染,无凝血功能及心、肺、肝、肾等重要脏器功能障碍。术前对患者进行总体评估:体格检查,ECG、脊髓损伤部位MRI检查,血、尿、便常规、肝肾功能、凝血、手术感染8项。
损伤完全性评定:完全性损伤为损伤平面以下包括骶4~5既无感觉也无运动功能;不完全性损伤为损伤平面以下包括骶4~5有感觉(或)运动功能。35例患者中,25例为不完全性损伤,10例为完全性损伤。
1.2 方法
1.2.1 UC-MSCs制备
[1]的方法,稍加改良后进行UC-MSCs制备。简言之,经知情同意及感染源检定后收集脐带,去除外膜和动静脉,将脐带剪成0.5 cm3大小的组织块,加入等体积0.2%Ⅰ型胶原酶,37℃消化过夜。次日,加入两倍体积的0.05%的胰蛋白酶,37℃消化1 h。2 000 r/min离心10 min收集细胞,计活细胞数。将细胞悬浮于hMSC无血清培养基(杭州百威生物技术有限公司)中,按106cells/cm2底面积接种于塑料培养瓶中。1周后出现由数十个形态类似于成纤维细胞组成的集落。加入0.05%胰蛋白酶消化,并按6 000 cells/cm2底面积进行传代培养。利用流式细胞技术测定细胞表型,常规感染源检定后,收集细胞用于治疗,或收获细胞放于-80℃冰箱冻存备用。使用前,在37℃环境下快速复苏,24~48 h培养,收获贴壁生长的细胞供临床应用。
1.2.2 UC-MSCs注射
入院第3或第4天开始给患者行腰穿,鞘内注射UC-MSCs,1次/周,4次为1个疗程。按诊疗常规进行腰穿,将 UC-MSCs 10 mL(1×106cells/Kg)+地塞米松5 mg在10 min内缓慢注入蛛网膜下腔,拔针,敷以无菌辅料,嘱患者去枕平卧6 h。
治疗有效的患者前1疗程治疗结束3~6个月后且无进一步好转迹象时,经本人同意,即可给予下一疗程治疗。治疗期间给予患者常规的系统康复训练作为辅助治疗。
1.2.3 评估标准[2]
采用美国脊髓损伤协会制定的脊髓损伤神经功能评分标准(ASIA标准),对患者治疗前后神经功能进行评定:检查颈2到骶4~5神经支配的身体两侧各自28个皮节区痛觉和触觉,按消失、减退、正常分别给予 0、l、2分,痛觉、触觉总分均为112分;检查颈5到骶1神经支配的身体两侧各自10个肌节中的关键肌,按肌力0~5级分别给予0~5分,总分为100分。
采用国际神经修复学会脊髓损伤功能评价量表(IANR-SCIRFS),对患者治疗前后日常生活活动能力进行评定,包括上、下肢、躯干、全身运动功能、括约肌功能、肌张力、泌汗、皮肤营养、疼痛,最高分48分为正常。分值越低表示神经功能缺损越严重,日常生活活动能力越差。
1.2.4 不良反应及并发症观察
观察治疗中及治疗后有无发热、腰痛、头痛、头晕等不良反应。
1.2.5 随访
患者治疗后3个月随访,之后每6个月随访1次,观察病情变化。
1.2.6 统计学分析
2 结果
35例患者,22例治疗有效,总有效率62.86%。25例不完全性SCI患者中22例有效,有效率达88%,3例无效。有效患者ASIA评分及IANRSCIRFS评分显示,治疗结束1个月后(与治疗前相比),其痛觉、触觉、运动及日常生活活动能力评分有明显提高(P<0.01);10例完全性SCI患者均治疗无效(表 1、2)。

表1 22例有效患者治疗前后的评分Table 1 Scores of 22 effective patients before and after therapy
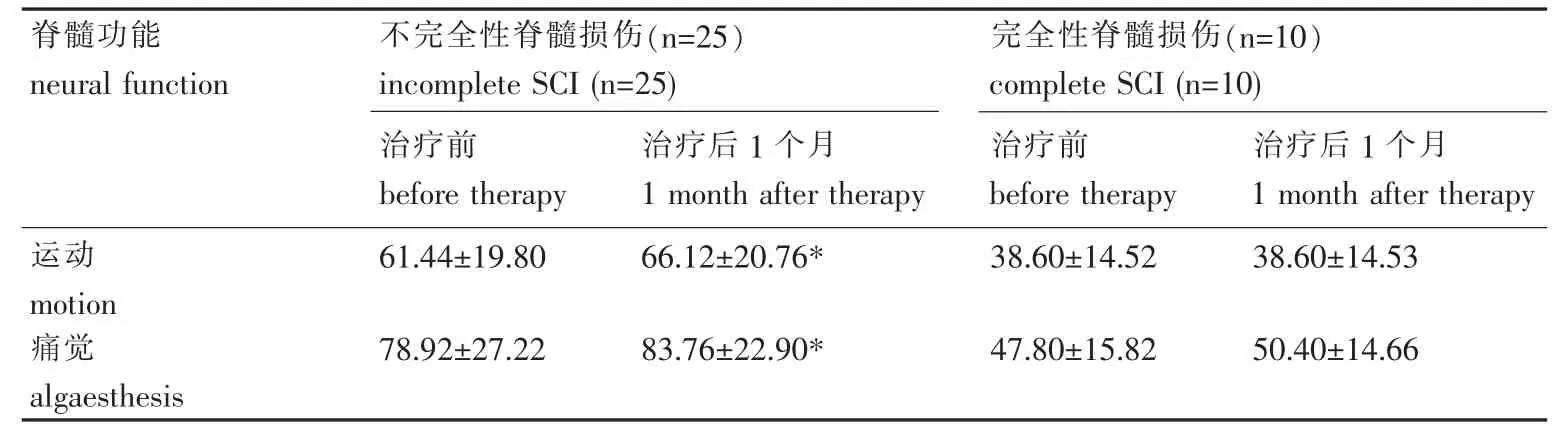
表2 不完全性SCI与完全性SCI患者治疗前后的评分Table 2 Scores of incomplete SCI patients and complete SCI patients before and after therapy
22例有效患者中13例接受了1个疗程治疗,7例接受了2个疗程治疗,2例接受了3个疗程治疗。7例接受2个疗程治疗的患者中,5例经第2疗程治疗后神经系统功能得到进一步提高,2例第2疗程治疗前后无变化;2例接受3个疗程治疗的患者中,1例每疗程治疗后神经系统功能均得到进一步提高,另1例前2个疗程治疗后神经系统功能均得到进一步提高,第3疗程治疗前后无变化。有效患者多表现为运动和/或感觉功能改善,大小便控制力增强。
脊髓损伤部位存在软化灶的7例患者中,4例为不完全性SCI,3例为完全性SCI。其中2例不完全性SCI患者有效,余均无效。
有效的22例患者损伤至治疗的平均时间为49个月(2~204个月),无效的13例患者平均为51个月(4~144 月),两组无显著差异(P>0.05)。
UC-MSCs治疗中及治疗后,患者的生命体征均平稳。2例治疗后感头痛,2例治疗后感腰痛,1例治疗后出现发热,未经特殊处理,1~3 d后症状消失。头痛患者表现为立位、坐位、活动时头痛加重,卧位时头痛减轻或消失,考虑系腰穿术后出现低颅压综合征,在后续治疗中通过增加鞘注液体量至15 mL缓慢鞘注后未再出现头痛,无其他不良反应。
22例有效患者共接受了33个疗程的治疗,其中31个疗程治疗有效:18个疗程治疗结束1个月后疗效不再增加;8个疗程治疗结束3月后疗效不再增加;4个疗程治疗结束6个月后疗效不再增加;1个疗程治疗结束1年后疗效不再增加。35例患者结束治疗至2017年8月平均84个月 (45~114个月),无治疗相关不良事件发生,有效患者疗效稳定,13例无效患者病情无变化。
3 讨论
SCI表现为损伤平面以下感觉、运动功能丧失和大、小便失禁,呈高发生率、高致残率、高耗费、发病年轻化等特点。SCI可分为外伤性和非外伤性两种,外伤是SCI的主要原因。本组86%的患者因外伤所致,前3位的原因为高空坠落、车祸和砸伤。SCI由原发性损伤(包括机械损害、出血等)和继发性损伤(包括水肿、炎症反应、缺血、细胞因子、再灌注等对脊髓产生的继发性损伤)引起,恢复极为困难。间充质干细胞(MSCs)来自中胚层,具有自我更新及多向分化的潜能,在适宜的条件下可分化为神经元及神经胶质细胞[3],并可分泌大量的生物活性物质[4],为SCI的治疗提供了新的手段。动物实验已证明,在不同的SCI模型中,应用MSCs可明显改善神经功能,如促进肢体感觉、运动功能恢复,减少脊髓空洞的形成,桥接损伤神经,促进轴突生长等[5-7]。在SCI慢性期可通过细胞替代、脊髓空洞填充、胶质瘢痕的修复、轴突生长而促进神经功能的修复[8-9]。MSCs治疗中枢神经系统损伤(SCI、颅脑损伤)及疾病(脊髓小脑性共济失调、多系统萎缩、肌萎缩侧索硬化症、脑瘫、脑卒中等)尚处于Ⅰ期及Ⅱ期临床试验阶段,显示MSCs治疗是安全有效的[10-15]。UC-MSCs来源于脐带沃顿胶,易于分离和体外大量扩增,免疫原性低,适于临床应用。前期临床试验中,我们将体外扩增的UC-MSCs鞘内注射给22例SCI患者,表明UC-MSCs鞘内注射是安全的,对不完全性SCI患者的有效率达81.25%,有效患者通过增加疗程数,疗效有一定提高[16]。在此基础上,现扩大病例数至35例,共46疗程治疗。结果显示,在不完全性SCI患者中有效率高达88%,主要表现为:①肢体肌力增加,肌张力下降,运动能力及生活自理能力增强;②感觉平面的下移,异常感觉的改善或消失;③小便控制能力增强,排便功能改善。但是,本方法对于完全性SCI患者无效;另外,SCI若存在软化灶,也会对疗效产生不利影响。
MSCs修复SCI的机制还不完全清楚,可概括为以下几个方面[5,10,17]:①通过分泌神经营养因子(脑源性神经营养因子、血管内皮细胞生长因子、神经生长因子、胶质细胞源性神经营养因子、胰岛素样生长因子1)保护残存的神经元,促进残存神经元轴突再生及突触形成,促进损伤局部血管再生。②改善脊髓损伤后的局部微环境,减轻炎症反应,减少受损脊髓周围组织的继续坏死,减少脊髓空洞及胶质瘢痕的形成。③在脊髓特定的环境下,分化成神经元、胶质细胞,促进轴突再生并帮助其髓鞘化,重建神经环路。移植的MSCs被观察到是通过分泌营养信号而非通过在损伤部位的植入或分化而发挥治疗作用[18]。另外,MSCs也可通过释放含有大量生物活性分子(脂质、蛋白质、mRNA、miRNA等)的微泡及外泌体到胞外,促进损伤脊髓组织的修复与再生[19-20]。
目前,细胞治疗的途径主要有鞘内注射、静脉输注、损伤局部注射。虽然损伤局部注射可以将MSCs直接注射到损伤区周围,以促进神经细胞功能的改善和恢复,但此方法有导致穿刺处脊髓二次损伤及局部出血的可能性。经静脉输注MSCs悬液,方法简单易行,风险较小,但是到达损伤局部的细胞数量较少,难以取得较理想的治疗效果。鞘内注射可有效避免上述两种治疗途径存在的问题,简便易行,对机体损伤小,进入蛛网膜下腔的MSCs可以迁移到损伤部位,并修复受损的神经细胞[21]。
Garbossa等[22]认为,在胶质瘢痕形成前数周为最佳移植时间;Syková等[23]认为,干细胞移植的最佳时间窗是SCI后3~4周内,既可避免急性期各种炎性因子对移植细胞的损害,又可避免慢性期胶质瘢痕对轴突再生的干扰。临床上大部分SCI患者均处于慢性期,药物及康复治疗难以使损伤的神经功能得到进一步恢复。本组患者多在SCI慢性期接受MSCs治疗,不完全性SCI患者有效率高达88%,提示在SCI慢性期MSCs鞘内注射治疗是有效的。
由于鞘内注射的MSCs生存时间有限[24],多次重复注射可能是改善患者神经功能的关键。Vaquero等[25]给予10例不完全SCI患者重复鞘内注射自体MSCs, 每次为 3×107个, 共 4 次 (第 1、4、7、10 个月),所有患者感觉、运动、排尿、排便功能均有不同程度改善。我们采取多次注射的方法 (每周1次,4次为1个疗程)。结果显示,25例不完全性SCI患者中22例有效,对于1个疗程治疗有效的9例患者继续给予1~2个疗程治疗 (每次间隔3~6个月),7例神经功能均有进一步改善,提示多次、多疗程治疗有可能使患者神经功能改善程度最大化。
本研究证实了UC-MSCs鞘内注射的安全性,35例患者共计46疗程、184次鞘内注射,未出现严重不良反应,仅个别患者出现头痛、腰痛、发热,未经特殊处理,1~3 d后症状消失。长期随访(平均84个月)显示,本组患者中无治疗相关不良事件发生。
本研究表明,UC-MSCs蛛网膜下腔注射治疗SCI是安全的,可使大部分不完全性SCI患者神经功能在一定程度上得到恢复,2~3个疗程治疗有可能使疗效得到进一步提高,有效患者疗效稳定。
参考文献
[1] Avanzini MA,Bernardo ME,Cometa AM,et al.Generation of mesenchymal stromal cells in the presence of platelet lysate:a phenotypic and functional comparison of umbilical cord bloodand bone marrow-derived progenitors[J].Haematologica,2009,94(12):1649-1660.
[2] 黄红云,主编.中枢神经修复学[M].北京:北京科学出版社:221-225,234-235.
[3] Messerli M,Wagner A,Sager R,et al.Stem cells from umbilical cord Wharton's jelly from preterm birth have neuroglial differentiation potential[J].Reprod Sci,2013,20(12):1455-1464.
[4] Paul G,Anisimov SV.The secretome of mesenchymal stem cells:Potential implications for neuroregeneration[J].Biochimie,2013,95(12):2246-2256.
[5] Forostyak S,Jendelova P,Sykova E.The role of mesenchymal stromal cells in spinal cord injury,reg enerative medicine and possible clinical applications[J].Biochimie,2013,95(12):2257-2270.
[6] Hejcl A,Jendelová P,Syková E.Experimental reconstruction of the injured spinal cord[J].Adv Tech Stand Neurosurg,2011(37):65-95.
[7] Boido M,Garbossa D,Fontanella M,et al.Mesenchymal stem cell transplantation reduces glial cyst and improves functional outcome after spinal cord compression[J].World Neurosurg,2014,81(1):183-190.
[8] Zurita M,Aguayo C,Bonilla C,et al.Perilesional intrathecal administration of autologous bone marrow stromal cells achieves functional improvement in pigs with chronic paraplegia[J].Cytotherapy,2013,15(10):1218-1227.
[9] Morita T,Sasaki M,Kataoka-Sasaki Y,et al.Intravenous infusion of mesenchymal stem cells promotes functional recovery in a model of chronic spinal cord injury[J].Neuroscience,2016,335:221-231.
[10] Dasari VR,Veeravalli KK,Dinh DH.Mesenchymal stem cells in the treatment of spinal cord injuries:a review[J].World J Stem Cells,2014,6(2):120-133.
[11] Satti HA,Waheed A,Ahmed P,et al.Autologous mesenchymal stromal cell transplantation for spinal cord injury:A Phase I pilot study[J].Cytotherapy,2016,18(4):518-522.
[12] Karamouzian S,Nematollahi-Mahani SN,Nakhaee N,et al.Clinical safety and primary efficacy of bone marrow mesenchymal cell transplantation in subacute spinal cord injured patients[J].Clin Neurol Neurosurg,2012,114(7):935-939.
[13] Miao X,Wu X,Shi W.Umbilical cord mesenchymal stem cells in neurological disorders:a clinical study[J].Indian J Biochem Biophys,2015,52(2):140-146.
[14] Mazzini L,Mareschi K,Ferrero I,et al.Mesenchymal stromal cell transplantation in amyotrophic lateral sclerosis:a long-term safety study[J].Cytotherapy,2012,14(1):56-60.
[15] Dongmei H,Jing L,Mei X,et al.Clinical analysis of the treatment of spinocerebellar ataxia and multiple system atrophy-cerebellar type with umbilicalcord mesenchymalstromalcells [J].Cytotherapy,2011,13(8):913-917.
[16] Liu J,Han DM,Wang ZD,et al.Clinical analysis of the treatment of spinal cord injury with umbilical cord mesenchymal stem cells[J].Cytotherapy,2013,15(2):185-191.
[5] Forostyak S,Jendelova P,Sykova E.The role of mesenchymal stromal cells in spinal cord injury,regenerative medicine and possible clinical applications[J].Biochimie,2013,95(22):2257-2270.
[17] Hawryluk GW,Mothe A,Wang J,et al.An in vivo characterization of trophic factor production following neural precursor cell or bone marrow stromal cell transplantation for spinal cord injury[J].Stem Cells Dev,2012,21(12):2222-2238.
[18] Qu J,Zhang H.Roles of mesenchymal stem cells in spinal cord injury[J].Stem Cells Int,2017,2017,5251313.?
[19] Kim HS,Choi DY,Yun SJ,et al.Proteomic analysis of microvesicles derived from human mesenchymal stem cells[J].J Proteome Res,2012,11(2):839-849.
[20] Zhang Y,Chopp M,Liu XS,et al.Exosomes derived from mesenchymal stromal cells promote axonal growth of cortical neurons[J].Mol Neurobiol,2017,54(4):2659-2673.
[21] Lim JY,Jeong CH,Jun JA,et al.Therapeutic effects of human umbilical cord blood-derived mesenchymal stem cells after intrathecal administration by lumbar puncture in a rat model of cerebral ischemia[J].Stem Cell Res Ther,2011,2(5):38-50.
[22] Garbossa D,Boido M,Fontanella M,et al.Recent therapeutic strategies for spinal cord injury treatment:possible role of stem cells[J].Neurosurg Rev,2012,35(3):293-311.
[23] Sykova E,Homola A,Mazanec R,et al.Autologous bone marrow transplantation in patients with subacute and chronic spinal cord injury[J].Cell Transplant,2006,15(8-9):675-687.
[24] Chotivichit A,Ruangchainikom M,Chiewvit P,et al.Chronicspinal cord injury treated with transplanted autologous bone marrow-derived mesenchymal stem cells tracked by magnetic resonance imaging:a case report[J].J Med Case Rep,2015,9:79.
[25] Vaquero J,Zurita M,Rico MA,et al.Repeated subarachnoid administrations of autologous mesenchymal stromal cells supported in autologous plasma improve quality of life in patients suffering incomplete spinal cord injury[J].Cytotherapy,2017,19(3):349-359.
Long-Term Clinical Observation of Umbilical Cord Mesenchymal Stem Cells in Treating Spinal Cord Injury by Intrathecal Injection
LIU Jing1,HAN Dongmei1,XUE Mei1,YAN Hongmin1,Dongl Lei1,ZHU Ling1,GUO Zikuan2,WANG Hengxiang1.1 Department of Hematology,General Hospital of the Air Force,Beijing 100142,China;2 Department of Experimental Hematology,Beijing Institute of Radiation Medicine,Beijing 100850,China.Corresponding author:WANG Hengxiang(E-mail:wanghengxiang123@aliyun.com).
ObjectiveTo observe the clinical efficacy and safety of umbilical cord mesenchymal stem cells(UC-MSCs)in treating spinal cord injury (SCI)by intrathecal injection.MethodsFrom January 2008 to October 2013,35 admitted patients with SCI were given UC-MSCs by intrathecal injection for 46 courses,at a dose of 1×106cells/kg body weight once a week,4 times as a course.American Spinal Injury Association (ASIA)standard and International Association of Neurorestoratology SCI Functional Rating Scale (IANR-SCIFRS)were used to evaluate SCI patient's neural function and ability of daily living.ResultsAmong 35 cases,22 cases were effective.Compared with the scale before therapy,effective patients'algaesthesis,tactile sensation,motion,activity of daily living scale were obviously increased one month after therapy(P<0.01).Nine effective patients
2 to 3 courses of treatment,the effects of 7 cases were further enhanced.The effective rate of 25 cases with incomplete SCI was 88.46%,whereas all of 10 cases with complete SCI had no response.After therapy,there were headache,lumbago or fever in individual patients and disappeared within 1-3 days.All patients were followed up for 45 months to 114 months(average 84 months),no treatment-related adverse events happened.The effect was stable in effective patients.ConclusionUC-MSCs therapy by intrathecal injection is safe,and can ameliorate most of incomplete SCI patient's neurological function,multiple courses of treatment is likely to further improve the efficacy of patients.
Umbilical cord mesenchymal stem cells;Spinal cord injury;Intrathecal injection
王恒湘(E-mail:wanghengxiang123@aliyun.com)。
R651.2
A
1673-0364(2017)06-0313-05
10.3969/j.issn.1673-0364.2017.06.003
首都发展基金项目(2007-2033);国家高新技术研究发展计划 (863项目,2007AA022454);国家重大新药创制基金(20092x09503-019);军队临床高新技术重大项目(2010gxjs049)。
100036 北京市 空军总医院血液科(刘静,韩冬梅,薛梅,阎洪敏,董磊,朱玲,王恒湘);100142 北京市 北京放射与辐射医学研究所(郭子宽)。
2017年10月9日;
2017年11月23日)

