CD133、CXCR4共表达与胆囊癌转移特性的相关性研究
俞远林 陈晓鹏 张卫东 彭俊璐
·论 著·(临床研究)
CD133、CXCR4共表达与胆囊癌转移特性的相关性研究
俞远林 陈晓鹏 张卫东 彭俊璐
目的探讨CD133、CXCR4共表达与胆囊癌转移特性之间的关系。方法培养胆囊癌GBC-SD细胞,并经免疫磁珠分选法分选得到CXCR4+和CXCR4-亚群胆囊癌GBC-SD细胞,分为CD133-CXCR4-、CD133-CXCR4+、CD133+CXCR4-及CD133+CXCR4+四组,以Transwell法检测四组胆囊癌GBC-SD细胞侵袭能力。Western-blot法检测CD133+CXCR4+组与CD133+CXCR4-组细胞上皮间质转化相关因子表达。Western blot法检测21例胆囊癌原发灶组织标本中CD133与CXCR4蛋白表达与淋巴结转移、肝脏侵犯、胆管侵犯及TNM分期之间的关系。结果CD133+CXCR4+组平均穿膜细胞数为(32.49±9.45),显著高于CD133+CXCR4-组的(16.17±8.55),差异具有统计学意义(P=0.02)。CD133+CXCR4+组N-cadherin蛋白灰度值为(0.8321±0.1259),显著高于CD133+CXCR4-组的(0.4572±0.0775),差异有统计学意义(P=0.004)。CD133+CXCR4+组E-cadherin 蛋白灰度值为(0.4712±0.0736),显著低于CD133+CXCR4-组的(0.8439±0.1339),差异有统计学意义(P=0.006)。CD133+CXCR4+组Snail蛋白相对灰度值为(0.9455±0.1228),显著高于CD133+CXCR4-组的(0.3219±0.0934),差异有统计学意义(P=0.003)。胆囊癌标本淋巴结转移组、肝脏侵犯组、胆管侵犯组CXCR4 蛋白表达值显著高于对应阴性组(P=0.013,P=0.024,P=0.037),Ⅰ/Ⅱ分期组显著低于Ⅲ/Ⅳ组,差异有统计学意义(P=0.016)。淋巴结转移组CD133蛋白表达显著高于对应阴性组,差异有统计学意义(P=0.009),Ⅰ/Ⅱ分期组显著低于Ⅲ/Ⅳ组,差异有统计学意义(P=0.018)。肝脏侵犯组、胆管侵犯组与相应对照组CD133蛋白相对表达差异无统计学意义(P=0.443,P=0.371)。CD133蛋白与CXCR4蛋白表达存在明显正相关(r=0.693,P<0.01)。结论CD133、CXCR4共表达预示胆囊癌具有较强的转移特性。
胆囊癌; 侵袭; CD133
胆囊癌是胆道系统最常见的恶性肿瘤,5年总生存期仅为5%[1],甚至更低。近来发现,肿瘤起始细胞(tumor initiating cells,TICs)被认为在肿瘤生成、增殖、转移及复发过程中起到关键作用[2-7]。Yu等[8]有关胆囊癌TICs分离的实验研究提示,CD133+胆囊癌GBC-SD细胞具有TICs样特性。基质细胞源性因子-1α/CXC趋化因子受体-4轴(SDF-1α/CXCR4)在多种实体肿瘤侵袭转移过程中发挥重要作用[9]。Zhang等[10]研究显示,CD133与CXCR4联合表达提示结肠癌具有较强的转移特性。本研究旨在探索CD133与CXCR4共表达与胆囊癌GBC-SD细胞侵袭能力及胆囊癌临床病理特征之间的关系。
材料与方法
一、材料
1.病例资料和组织样本 21例胆囊癌原发灶标本取自2014年12月至2016年12月期间皖南医学院附属弋矶山医院普通外科的手术病人,术后经病理检查确诊为胆囊癌。其中男性16例,女性5例;年龄39~81岁,中位年龄63岁。分期依据美国肿瘤联合会(AJCC)与国际抗癌联盟(UICC)联合制定的2010版胆囊癌TNM分期。Ⅰ期5例,Ⅱ期6例,Ⅲ期7例,Ⅳ期3例。5例行腹腔镜胆囊切除术,6例行胆囊癌标准根治术,6例行扩大根治术,4例行姑息性切除术。
2.主要实验试剂 人胆囊癌GBC-SD细胞株由中科院上海细胞生物学研究所提供;胎牛血清购自美国Hyclone公司;DMEM培养基购自中国吉诺生物医药科技有限公司;Matrigel基质胶购自美国BD公司;Transwell小室购自美国Corning公司;CD133鼠抗人单克隆抗体购自德国Miltenyi公司;CD133分选试剂盒与CD133鼠抗人单克隆抗体均购自德国Miltenyi公司;CXCR4兔抗人多克隆抗体购自英国Abcam公司;辣根过氧化物酶(HRP)标记的二抗购自美国Jackson公司;ECL发光液购自美国Thermo公司。
二、实验方法
1.细胞培养 胆囊癌GBC-SD细胞培养于含10%胎牛血清(分选后细胞用无血清培养),100 U/ml青霉素、100 U/ml链霉素的DMEM培养基(pH7.2~7.4)中,常规置于5% CO2饱和湿度、37 ℃培养箱中培养,平均每2~3 d传代一次。
2.免疫磁珠分选 收集对数生长期的胆囊癌GBC-SD细胞,经0.25% EDTA-胰蛋白酶消化后,调整细胞密度为1×107个/ml,PBS洗一次再用300 μl Buffer缓冲液重悬,在上述细胞悬液中加入100 μl CD133 microbeads及100 μl FCR Blocking溶液,充分混匀后避光置于4 ℃冰箱中孵育30 min。用2 ml Buffer缓冲液洗涤上述避光孵育液,离心后留取沉淀,并用500 μl Buffer缓冲液重悬细胞沉淀。将上述细胞悬液加入分离柱,自然流出的细胞即为CD133-亚群胆囊癌GBC-SD细胞,而留在柱内的细胞为CD133+亚群胆囊癌GBC-SD细胞。在磁场外,用分离柱配备的活塞快速将分离柱中以磁性结合的CD133+亚群胆囊癌GBC-SD细胞挤出,用2 ml Buffer缓冲液重悬行后续实验。用上述同样的方法继续分选得到CXCR4+与CXCR4-亚群胆囊癌GBC-SD细胞。根据实验设定为四组:CD133+CXCR4+组、CD133+CXCR4-组、CD133-CXCR4+组、CD133-CXCR4-组。
3.Transwell法检测GBC-SD细胞侵袭能力 用无血清DMEM培养基按照1∶1比例稀释后,取100 μl铺于Transwell上室中,置于37 ℃培养箱中, 等待上室的基质胶生长凝结,收集对数生长期GBC-SD细胞,以无血清DMEM培养基重悬,取200 μl加入Transwell上室中,调整细胞浓度为(1~5)×105个/孔,下室中加入含有20%胎牛血清的DMEM完全培养基,37 ℃培养箱培养24 h后,取出Transwell小室,用棉签擦去上室中的基质胶及细胞,4%多聚甲醛固定30 min,1%结晶紫染色30 min, 在高倍镜下平移非重叠观察9个视野,计数其中的穿膜细胞数,并计算平均数,实验结果最终以平均穿膜细胞数表示。
4.免疫蛋白印迹法(Western blot)检测 细胞及组织标本提取蛋白后行Western blot检测,实验重复3次取平均值。CD133/CXCR4蛋白表达水平以CD133/CXCR4蛋白条带密度灰度值和条带面积的乘积与GAPDH蛋白条带密度灰度值和条带面积的乘积的比值表示[5]。
三、统计学处理
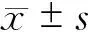
结 果
一、CD133-CXCR4-、CD133-CXCR4+、CD133+CXCR4-、CD133+CXCR4+四组细胞侵袭能力检测
Transwell法检测结果显示,CD133+CXCR4+组平均穿膜细胞数为(32.49±9.45),显著高于CD133+CXCR4-组(16.17±8.55,P=0.02)、CD133-CXCR4+组(14.85±6.41,P=0.03)和CD133-CXCR4-组(5.32±1.75,P=0.004)(图1)。
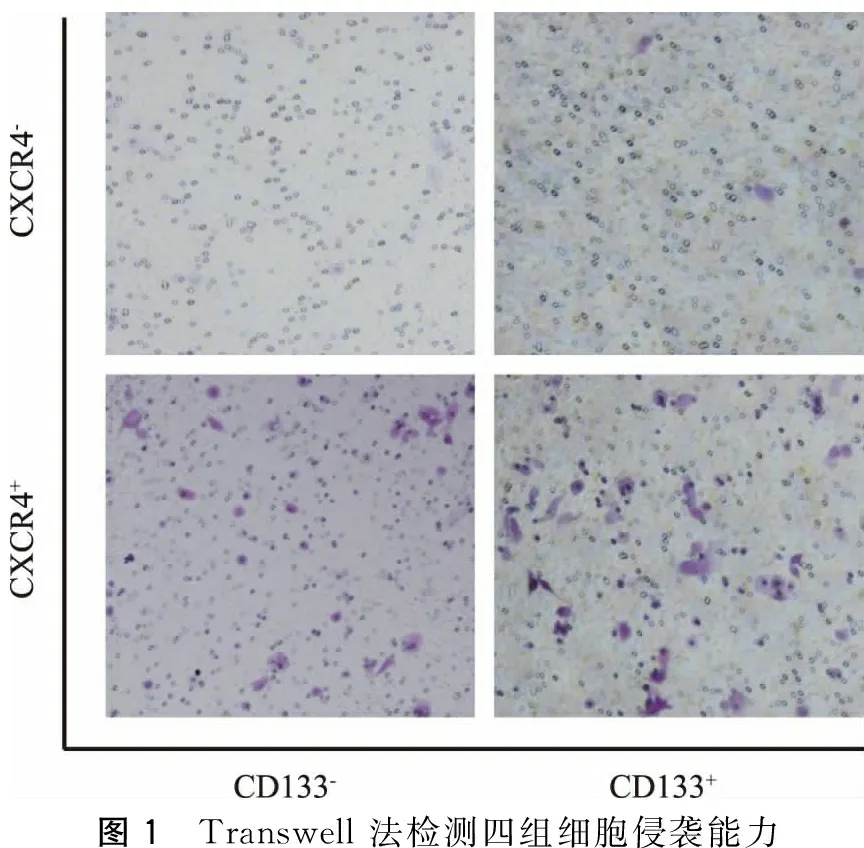
图1 Transwell法检测四组细胞侵袭能力
二、CD133+CXCR4+组与CD133+CXCR4-组细胞上皮间质转化(epithelial mesenchymal transition, EMT)相关蛋白检测
Western blot检测结果显示,CD133+CXCR4+组N-cadherin蛋白相对灰度值(0.8321±0.1259)显著高于CD133+CXCR4-组(0.4572±0.0775,P=0.004)。CD133+CXCR4+组E-cadherin蛋白相对灰度值(0.4712±0.0736)显著低于CD133+CXCR4-组(0.8439±0.1339,P=0.006)。CD133+CXCR4+组Snail蛋白相对灰度值(0.9455±0.1228)显著高于CD133+CXCR4-组(0.3219±0.0934,P=0.003)。(图2)
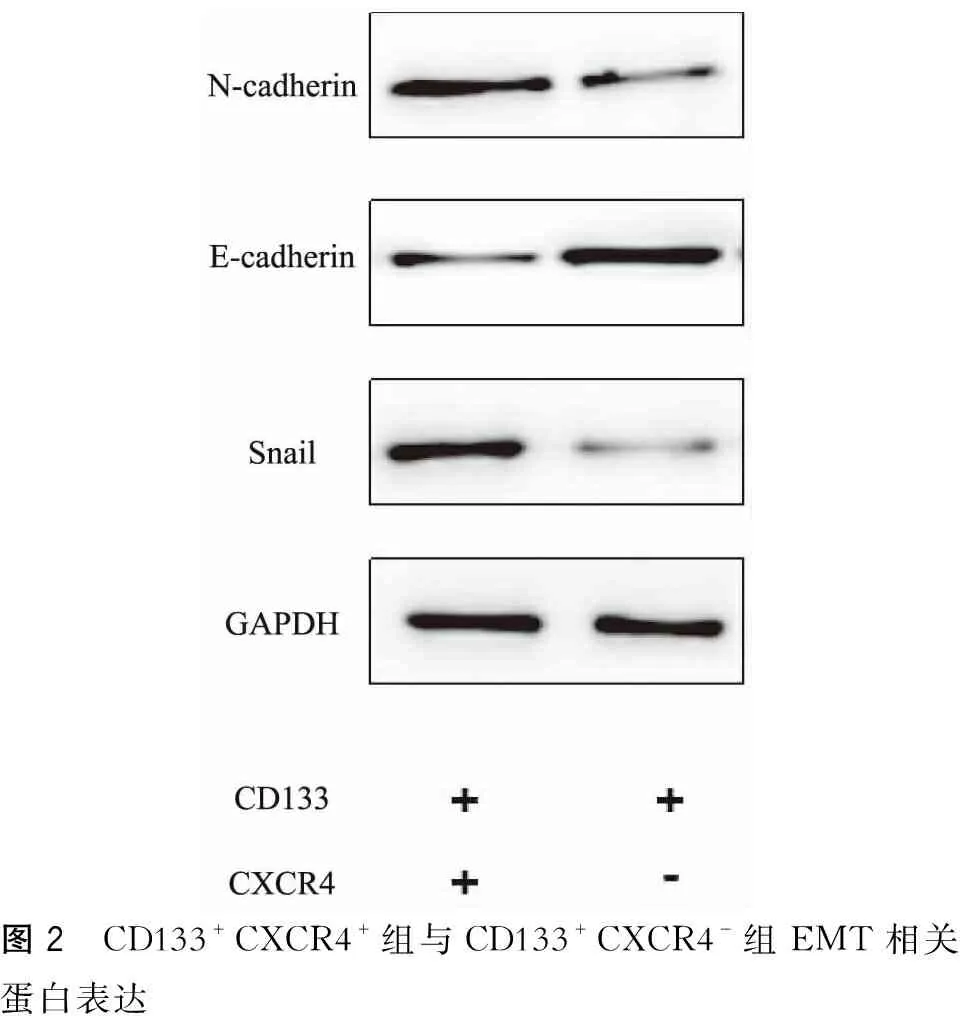
图2 CD133+CXCR4+组与CD133+CXCR4-组EMT相关蛋白表达
三、胆囊癌标本CXCR4和CD133 蛋白表达与临床病理特征的关系
胆囊癌标本淋巴结转移组、肝脏侵犯组、胆管侵犯组CXCR4 相对蛋白表达值显著高于对应阴性组(P=0.013,P=0.024,P=0.037),Ⅰ/Ⅱ分期组显著低于Ⅲ/Ⅳ分期组(P=0.016)。年龄组、性别组、肿瘤大小组CXCR4 相对蛋白表达与对应阴性组无明显差异(P=0.339,P=0.571,P=0.476)。胆囊癌淋巴结转移组CD133蛋白相对表达显著高于对应阴性组(P=0.009),Ⅰ/Ⅱ分期组显著低于Ⅲ/Ⅳ分期组(P=0.018),年龄组、性别组、肿瘤大小组、肝脏侵犯组、胆管侵犯组CD133蛋白相对表达无明显差异(P=0.423,P=0.144,P=0.327,P=0.443,P=0.371)。(表1)
四、胆囊癌标本CXCR4和CD133蛋白表达的相关性
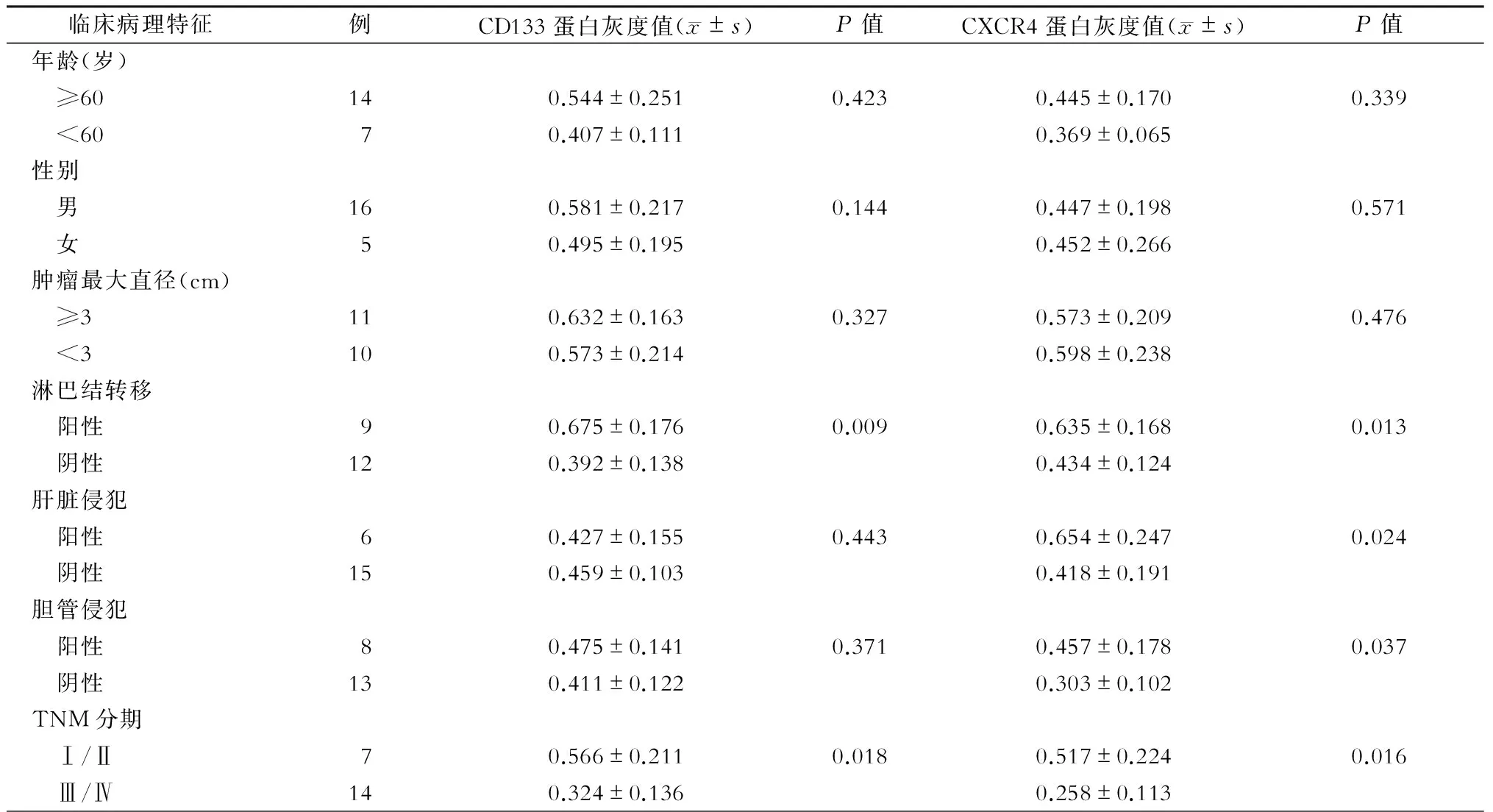
表1 21例胆囊癌标本CD133与CXCR4蛋白表达与临床病理特征的关系
Spearman统计分析结果提示,CXCR4与CD133蛋白表达存在明显正相关(r=0.693,P<0.01)(图3)。
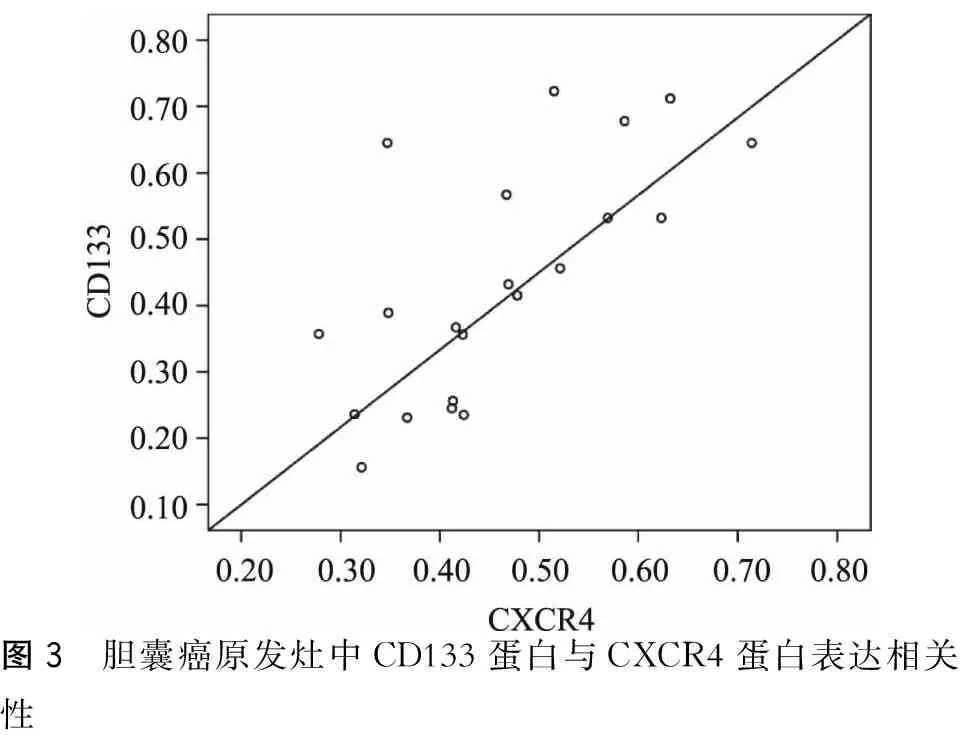
图3 胆囊癌原发灶中CD133蛋白与CXCR4蛋白表达相关性
讨 论
1997年,Bonnet等[11]在急性骨髓性白血病研究中发现,只有CD34+CD38-的癌细胞能形成急性骨髓性白血病的转移灶。研究显示,这一亚群细胞与造血干细胞具有相似的生物学特征,由此引出TICs理论。近年来,TICs理论不断的在白血病[11]、脑肿瘤[12]及乳腺癌[13]等实体肿瘤中得到实验论证。TICs理论认为,从功能和表型上看,肿瘤内部实质是一种不均一、异质性的等级结构,TICs是处于分化起始阶段的一小部分肿瘤细胞,能实现自我更新、无限增殖、多向分化潜能,因而成为恶性肿瘤发生、增殖、转移及复发的关键所在[2-7]。
CD133是一个五次跨膜的糖蛋白,起初被认为是造血干细胞的标志物。随着TICs的研究深入,CD133更多被证实为一种TICs标志物,在包括脑肿瘤[14]、结肠癌[15]、前列腺癌[16]等多种实体肿瘤中广泛研究论证。课题组前期研究发现CD133+亚群胆囊癌GBC-SD细胞具有一定的促进增殖、侵袭、耐药潜能、自我更新以及体内体外致瘤能力等TICs样特性[8]。SDF-1α/CXCR4轴是一对与细胞间信息传递、细胞迁移密切相关的信号轴。众多研究表明,SDF-1α/CXCR4轴在肿瘤侵袭、转移启动过程中至关重要[9]。有报道称[10],在结肠癌中,CD133、CXCR4共表达预示具有较强的转移特性。然而,CD133、CXCR4共表达与胆囊癌的转移特性是否存在内在联系,是本研究的出发点。
肿瘤侵袭特性是其转移的必经步骤。首先,本研究利用免疫磁珠法成功筛选出CD133+CXCR4+、CD133+CXCR4-、CD133-CXCR4+及CD133-CXCR4-四组胆囊癌细胞。通过侵袭能力检测发现,CD133+CXCR4+亚群细胞侵袭能力显著高于其他组,具有较强的侵袭特性。体外实验中,本研究对50例胆囊癌原发灶组织标本的蛋白检测发现,CXCR4蛋白在淋巴结转移、胆管侵犯及肝脏侵犯呈现相对高表达,且与CD133蛋白表达呈一定的相关性。因而CD133、CXCR4共表达预示胆囊癌具有较强的转移特性。
EMT是指上皮细胞发生形态转变,变为间质细胞的一个过程[17-20]。在肿瘤转移的过程中即伴随着EMT的发生,排列紧密的上皮样细胞转变为运动性极强的间质细胞,相对更易穿透包绕癌巢周围的基质,从而进入血管或淋巴管。研究显示,CD133+CXCR4+结肠癌细胞具备较强的侵袭转移能力,或可称为结肠癌TICs,而EMT进程是其参与获得侵袭与转移能力的重要环节[10]。而在胆囊癌是否存在类似现象,我们也进行了初步探索,以阐述为何CD133、CXCR4共表达预示胆囊癌具有较强的转移特性。我们发现,CD133+CXCR4+亚群胆囊癌细胞高表达间质标志物N-cadherin和Snail蛋白,而上皮标志物E-cadherin表达较低,即CD133+CXCR4+亚群胆囊癌细胞更易发生EMT。结合TICs理论与本研究结果,我们推测在胆囊癌TICs内部,SDF-1α/CXCR4信号轴与EMT在启动胆囊癌侵袭转移过程中存在协同效应,至于其精确的调控通路仍有待后续进一步研究。
综上所述,CD133、CXCR4共表达预示胆囊癌具有较强的转移特性。然而,更为深入的机制以及相关调控通路尚有待进一步研究。
1 Kanthan R,Senger JL,Ahmed S,et al.Gallbladder Cancer in the 21st Century.J Oncol,2015,9:1-26.DOI:10.1155/2015/967472.
2 Nguyen LV,Vanner R,Dirks P,et al.Cancer stem cells: an evolving concept.Nat Rev Cancer,2012,12:133-143.DOI:10.1038/nrc3184.
3 Melzer C,von der Ohe J, Lehnert H,et al.Cancer stem cell niche models and contribution by mesenchymal stroma/stem cells.Mol Cancer,2017,16:28. DOI:10. 1186/s12943-017-0595-x.
4 Albini A,Bruno A, Gallo C,et al.Cancer stem cells and the tumor microenvironment:interplay in tumor heterogeneity.Connect Tissue Res,2015,56:414-425. DOI:10.3109/03008207.2015.1066780.
5 Plaks V,Kong N,Werb Z.The cancer stem cell niche: how essential is the niche in regulating stemness of tumor cells?.Cell Stem Cell,2015,16:225-238. DOI:10.1016/j.stem.2015.02.015.
6 Kreso A,Dick JE.Evolution of the cancer stem cell model.Cell Stem Cell,2014,14:275-291. DOI:10.1016/j.stem.2014.02.006.
7 Meacham CE,Morrison SJ.Tumour heterogeneity and cancer cell plasticity.Nature,2013,501:328-337.DOI:10.1038/nature12624.
8 俞远林,姜波健,俞继卫,等.免疫磁珠法分离胆囊癌CD133阳性细胞及生物学行为的研究.中华实验外科杂志,2012,30:1652-1655.DOI:10.3760/cma.j.issn.1001-9030.2013.08.031.
9 Chatterjee S,Behnam Azad B,Nimmagadda S.The intricate role of CXCR4 in cancer.Adv Cancer Res,2014,124:31-82. DOI:10.1016/B978-0-12-411638-2.00002-1.
10Zhang SS,Han ZP,Jing YY,et al. CD133+CXCR4+colon cancer cells exhibitmetastatic potential and predict poor prognosis of patients.BMC Med,2012,10:85-99.DOI:10.1186/ 1741-7015-10-85.
11Bonnet D,Dick JE.Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell.Nat Med,1997,3:730-737. DOI:10.1038/nm0797-730.
12Singh SK,Hawkins C,Clarke ID,et al.Identification of human brain tumour initiating cells.Nature,2004,432:396-401.DOI:10.1038/nature03128.
13Al-Hajj M,Wicha MS,Benito-Hernandez A,et al.Prospective identification of tumorigenic breast cancer cells.Proc Natl Acad Sci USA,2003,100:3983-3988.DOI:10.1073/pnas.0530291100.
14Bao S,Wu Q,McLendon R,et al. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response.Nature,2006,444:756-760. DOI:10.1038/nature05236.
15O'Brien CA,Pollett A,Gallinger S,et al.A human colon cancer cell capable of initiating tumour growth in immunodeficient mice.Nature,2007,445:106-110. DOI:10.1038/nature05372.
16Collins AT,Berry PA,Hyde C,et al.Prospective identification of tumorigenic prostate cancer stem cells.Cancer Res,2005,65:10946-10951.DOI:10.1158/ 0008-5472.CAN-05-2018.
17Celià-Terrassa T,Kang Y.Distinctive properties of metastasis-initiating cells.Genes Dev,2016,30:892-908. DOI:10.1101/gad.277681.116.
18Ye X,Tam WL,Shibue T,et al.Distinct EMT programs control normal mammary stem cells and tumourinitiating cells.Nature,2015,525:256-260. DOI:10.1038/nature14897.
19Bao B,Azmi AS,Ali S,et al.The biological kinship of hypoxia with CSC and EMT and their relationship with deregulated expression of miRNAs and tumor aggressiveness.Biochim Biophys Acta,2012,1826:272-296.DOI:10.1016/j.bbcan.2012.04.008.
20Smith BN,Bhowmick NA.Role of EMT in metastasis and therapy resistance.J Clin Med,2016,5:2. DOI:10.3390/jcm5020017.
Correlationbetweenco-expressionofCD133,CXCR4andmetastasisabilityingallbladdercancer
YuYuanlin,ChenXiaopeng,ZhangWeidong,PengJunlu.
DepartmentofHepatobiliarySurgery,AffiliatedYijishanHospitalofWannanMedicalCollege,Wuhu241001,China
ChenXiaopeng,Email:drcxp@qq.com
ObjectiveTo explore the correlation between co-expression of CD133, CXCR4 and the metastasis ability in gallbladder cancer.MethodsTheinvasive ability in four groups of CD133-CXCR4-,CD133-CXCR4+, CD133+CXCR4-,CD133+CXCR4+wasmesured using Transwell. EMT related factor proteins of CD133+CXCR4-group and CD133+CXCR4+group were detected using Western blot. The relationship between the expression of CD133 and CXCR4 proteinsin 21 cases of primary gallbladder cancer tissue sampleswith lymph node metastasis, liver metastasis or bile duct metastasiswas analyzed by Western blot.ResultsThe number of migrating cells in CD133+CXCR4+group(32.49±9.45) wassignificantly greater than in CD133+CXCR4-group(16.17±8.55,P=0.02). The expression level of N-cadherin protein in CD133+CXCR4+group(0.8321±0.1259) was significantly higher than that in CD133+CXCR4-group (0.4572±0.0775,P=0.004). The expression level of E-cadherin protein in CD133+CXCR4+group(0.4712±0.0736)was significantly lower than that in CD133+CXCR4-group(0.8439±0.1339,P=0.006). The expression level of snail protein in CD133+CXCR4+group(0.9455 0.1228) was significantly higher than in CD133+CXCR4-group (0.3219±0.0934,P=0.003). The expression level of CXCR4 protein in the groups of lymph node metastasis, liver metastasis and bile duct metastasis was significantly higher than in control group (P=0.013,P=0.024,P=0.037, respectively). CXCR4 in stage Ⅰ/Ⅱ (TNM) group was lower than in Ⅲ/Ⅳ group(P=0.016).The expression level of CD133 protein in the group of lymph node metastasis was significantly higher than in control group(P=0.009). The expression of CD133 in stage Ⅰ/Ⅱ (TNM) group was lower than in Ⅲ/Ⅳ group(P=0.018).There was no significant difference between groups of liver metastasis and bile duct metastasis with control group(P=0.443,P=0.371).The expression level of CD133 protein was positively correlated with CXCR4 protein (r=0.693) withthe difference being statistically significant(P<0.01).ConclusionsCo-expression of CD133 and CXCR4 may indicate stronger capability for metastasis in gallbladder cancer.
Gallbladder cancer; Invasion; CD133
R657.3
A
10.3969/j.issn.1003-5591.2017.06.018
皖南医学院中青年科研基金(WF2015F06)
241001 安徽芜湖,皖南医学院附属弋矶山医院肝胆一科
陈晓鹏,Email:drcxp@qq.com
2017-04-13)

