结肠癌术后肠梗阻影响因素分析
宋林杰 李松岩 那兴邦 杨宇 张红亮 杜晓辉
·论 著·(临床实践)
结肠癌术后肠梗阻影响因素分析
宋林杰 李松岩 那兴邦 杨宇 张红亮 杜晓辉
目的随访调查结肠癌病人术后1个月肠梗阻发生率,分析其影响因素。方法系统收集2014年10月至2016年10月解放军总医院普通外科行结肠癌根治术227例病人的临床资料,术后密切随访1个月,统计病人肠梗阻发生情况,回顾分析其可能的影响因素,运用卡方检验对单因素进行筛选,并将可能的影响因素纳入多因素非条件Logistic回归分析。结果227例结肠癌病人术后1个月内共有19例发生肠梗阻,发生率为8.37%,经影像学、相关实验室检查及术中所见证实,19例肠梗阻病人中炎症性肠梗阻11例,机械性肠梗阻4例,麻痹性肠梗阻4例;其中年龄偏高、术前血红蛋白偏低、术前已发生肠梗阻、术前有胃肠肿物切除史、T分期偏高、左半结肠癌的病人术后1个月内肠梗阻发生率显著高于年龄偏低、术前血红蛋白在正常范围内、术前无肠梗阻、无胃肠肿物切除史、T分期偏低、右半结肠癌的病人;腹腔镜手术后1个月肠梗阻发生率显著低于开腹手术的病人,差异有统计学意义(P<0.05)。多因素非条件Logistic回归分析显示,年龄(OR=1.894,95%CI:1.019~2.664)、术前肠梗阻(OR=1.894,95%CI:1.019~2.664)、T分期(OR=5.542,95%CI:2.264~8.721)是结肠癌病人术后1个月肠梗阻的危险因素,而腹腔镜手术(OR=1.894,95%CI:1.019~2.664) 则是其保护因素。结论结肠癌病人术后肠梗阻发生概率较高,对于高危人群应规避风险,采取例如选择合适的术式、改善病人一般情况等必要的预防措施,避免肠梗阻的发生。
结肠癌; 肠梗阻; 影响因素
结肠癌是最为常见的消化道恶性肿瘤之一,在亚洲地区,结肠癌的发病率和死亡率均在上升,在我国结直肠癌已经跃升到恶性肿瘤发病原因的第3位,但发病率和死亡率之间的差距在不断拉大[1]。时至今日,与放射性治疗、化疗、免疫治疗等其他治疗方式比较,根治性切除手术仍然是结肠癌治疗最有效的方法[2]。对于存在手术指征的结肠癌病人,及早行根治性手术切除病灶,可获得较好的预后[3]。由于病人自身因素、肿瘤本身、手术操作以及病人术后恢复情况等因素的影响,结肠癌病人术后常常出现肠梗阻这一并发症。术后肠梗阻不仅增加了病人的痛苦,也增加了病人的住院时间,造成了医疗资源的浪费[4]。因此,了解肠梗阻发病的影响因素可以筛选出该疾病的高危人群,对这部分人群采取针对性的干预措施,从而降低肠梗阻的发病率。相关文献报道,结肠癌术后数周至数年时间内均可发生肠梗阻,但是时间越长,发生肠梗阻的概率越低[5]。本研究以术后1个月为观察时间窗口,调查227例病人结肠癌术后1个月肠梗阻发生情况,计算发病率,探讨术后肠梗阻发生的影响因素。
资料与方法
一、临床资料
采用回顾性研究方法,收集2014年10月至2016年10月解放军总医院普通外科收治的结肠癌病人临床资料,所有病人均满足下列条件: ①均采用根治性切除手术,且术后均经病理证实为结肠癌;②年龄50~70岁;③术前CT、MRI、正电子发射计算机断层显像(PET-CT)等影像学检查以及术中探查均未提示远处转移或腹腔广泛种植;④临床资料和随访资料完整,病人及家属对研究知情并表示同意。研究共纳入227例,其中男性149例,女性78例;年龄均在50~70岁,入组病人平均年龄为(61.23±12.29)岁。
二、术后随访
术后对入组病人随访1个月,统计术后肠梗阻发生情况。肠梗阻的诊断标准为:①炎症性肠梗阻:多于术后1~2周内发生,尤其是术后第5~7 d,病人主诉以腹痛、腹胀为主,体温多无高热,体检无明显肠袢或包块,术后肠功能短暂恢复,可有少量排气甚至排少许干便,但进食水后梗阻症状很快出现,腹部X线平片提示有多个大小不一的气液平面,但很少见到扩张的肠管,全腹CT提示肠壁水肿、增厚,肠管均匀扩张,腹腔内有渗出。②机械性肠梗阻:主要表现为腹胀、恶心,呕吐频繁而且量较大,反复呕吐引起脱水,腹部绞痛,疼痛持续时间较长,且程度剧烈,肛门停止排气和排便,其中部分性或单纯性肠梗阻无肌紧张,临床主要表现以肠绞痛为其特征,疼痛持续而剧烈。检查可闻及肠鸣音亢进或消失,部分病人可见肠型和肠蠕动波,腹部查体有压痛、反跳痛。实验室检查可见白细胞增多。腹部X线平片提示有多个小的液气平面,肠管扩张明显,肠腔不同程度狭窄。③麻痹性肠梗阻:病人主要表现为腹胀,部分病人可伴有腹痛,无肛门排气,体温偏高,但多低于39 ℃,胸式呼吸急促,腹式呼吸减弱,体检可见肠鸣音减弱或消失,全腹呈腹膜炎体征阳性,实验室检查可见感染指标阳性。腹部X线平片提示有广泛肠管积液、积气。腹部超声检查提示肠管扩张,肠腔可见明显积气、积液,肠管蠕动减少或消失[6]。
三、影响因素收集
影响因素主要包括年龄、性别、体质量指数(BMI)、术前合并症、术前肠梗阻、胃肠肿物切除史、术前贫血、肿瘤大小、肿瘤分期、手术方式。其中,BMI不低于18.5 kg/m2且不超过24.9 kg/m2为正常,其余为异常。术前血常规提示成年男性血红蛋白(Hb)<120 g/L、成年女性Hb<110 g/L,则认为存在术前贫血[7]。术前合并症主要包括糖尿病、高血压、心脏病、肺炎、肾功能不全、肝功能异常等慢性疾病。根据国际抗癌联盟(UICC)及美国肿瘤联合会(AJCC)颁布的第8版胃癌TNM分期系统提出的TNM分期系统将病人分为T1~T3期[8]。手术方式包括传统开腹手术和腹腔镜辅助手术。肿瘤位置主要根据术中探查所见分为右半结肠癌和左半结肠癌。
四、统计学处理
应用SPSS(22.0版)统计软件,计量资料的比较采用t检验,计数资料的比较采用χ2检验。将筛选出有统计学意义的变量纳入多元逐步Logistic 回归模型分析。计算OR值和95%CI,P<0.05为差异有统计学意义。
结 果
一、结肠癌根治术后1个月肠梗阻发生率
227例结肠癌病人术后1个月内共19例发生肠梗阻,发生率为8.37%。其中,诊断为炎症性肠梗阻病人11例,机械性肠梗阻病人4例,麻痹性肠梗阻4例。对于肠梗阻病人,均给予禁食、持续胃肠减压、营养支持、抗菌消炎、中医针灸等对症治疗,其中13例治疗有效,保守治疗无效的6例行手术治疗,治疗措施包括粘连松解、肠道造瘘、消化道重建等,经积极治疗后病人均痊愈出院。
二、影响术后肠梗阻发生的单因素分析
卡方检验结果显示,年龄偏高(超过60岁)、BMI异常、术前已发生肠梗阻、T分期偏高的病人术后1个月内肠梗阻发生率显著高于年龄偏低、术前无肠梗阻、T分期偏低、右半结肠癌的病人;腹腔镜手术后1个月肠梗阻发生率显著低于开腹手术的病人,差异均有统计学意义(P<0.05),见表1。以筛选出的因素为协变量,以发生肠梗阻为应变量,行多元逐步Logistic 回归模型分析,结果显示年龄、术前肠梗阻、高TNM分期是肠梗阻发生的独立危险因素(表2)。
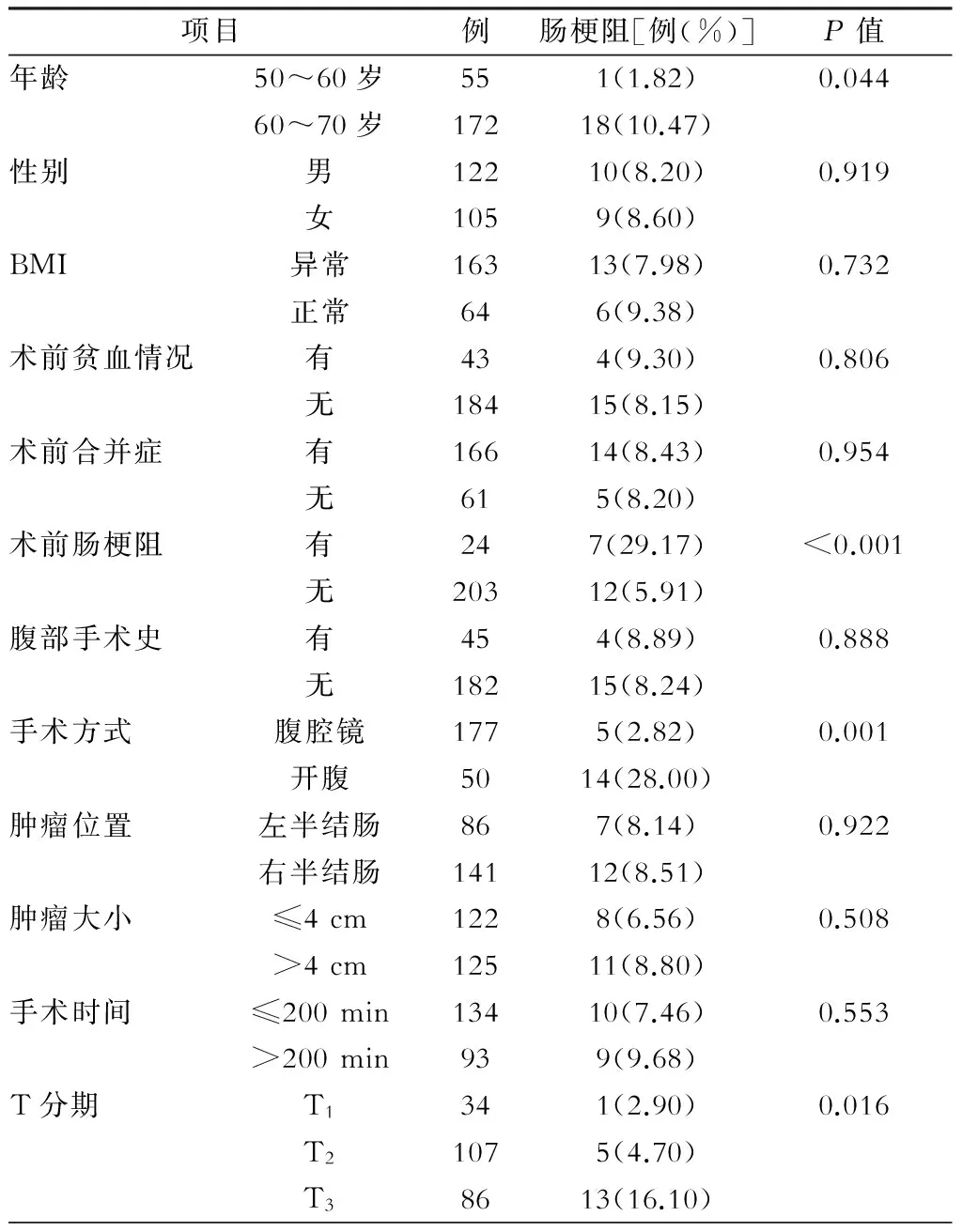
表1 全部病例临床特征
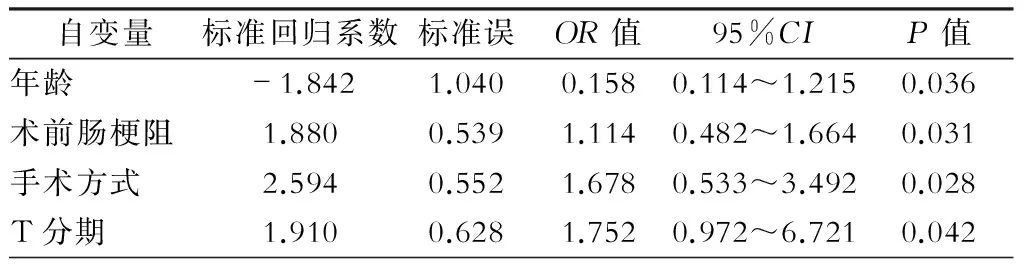
表2 多元逐步Logistic回归模型分析
讨 论
一、结肠癌术后肠梗阻发生情况
对于结肠癌术后肠梗阻发生情况国内外均有报道[9],国内许松欣等[10]及其团队曾对187例结直肠癌病人进行跟踪调查,发现有31例病人发生肠梗阻,发病率高达16.6%[10]。本研究回顾性分析了解放军总医院普通外科收治的227例结肠癌病人的临床资料,并以1个月为观察窗口,术后1个月内进行随访,统计共有19例病人出现肠梗阻,发生率为8.37%,低于国内相关报道的肠梗阻发生率。肠梗阻的发病受多种因素的影响,而且结肠癌术后从几周到若干年时间内均可发生肠梗阻,发病时间跨度较大,而本研究观察期限仅为1个月,超过1个月后发生肠梗阻的病人没有纳入到研究中,一定程度上导致本研究中肠梗阻发生率较其他国内报道为低。本研究中可见右半结肠癌术后肠梗阻发生率低于左半结肠癌,但差异无统计学意义。左右半结肠癌的临床病理特征、生物学特点、治疗及预后等方面都存在不同程度的差异。相关研究证实,右半结肠癌病人肿瘤恶性程度更高,更易发生浸润转移,血管受侵更为常见[11]。基于不同的胚胎起源,将结肠癌细分为右半结肠癌和左半结肠癌,其中右半结肠起源于中原肠,包括:回盲部、升结肠、横结肠,左半结肠起源于后原肠,包括:降结肠、乙状结肠。通常,右半结肠肠管较左半结肠为粗。从血供角度分析,左半结肠血运来源于肠系膜下动脉,右半结肠血运来源于肠系膜上动脉。左半结肠血运更易被手术操作破坏,因此有文献报道左半结肠癌术后更易发生吻合口瘘、肠梗阻等并发症[12]。因此,对于肿瘤位置是否为术后肠梗阻的危险因素尚待增加样本容量,进一步探究。
二、结肠癌病人术后肠梗阻的危险因素机制讨论
本研究通过多因素非条件Logistic 回归分析,结果发现术前存在肠梗阻、TNM分期较晚是结肠癌病人术后1个月内发生肠梗阻的危险因素,而采取腹腔镜手术则可以极大程度地降低肠梗阻的发生概率,是其保护因素。现就其危险因素和保护因素进行讨论。①高龄:高龄病人一般情况较差,术前多存在贫血、营养状况差等影响结肠癌预后的因素。老年人首次下床活动时间较晚,且下床后的活动量较少,胃肠功能术后恢复较慢,易发生粘连,引起梗阻[13]。而且不能耐受腹腔镜手术的病人多为老年人[14],这与腹腔镜手术是保护因素这一结论相一致。②术前肠梗阻: 术前肠梗阻多由于肠道肿物占据肠腔,导致的上方肠管扩张,肠腔内压力升高,肠壁静脉回流受阻,淋巴管和毛细血管淤积,肠壁炎症渗出,充血水肿;术前肠梗阻还可以引起酸碱平衡和水电解质紊乱,引发术后肠梗阻; 若术前肠梗阻部位在术区则可引起术区大量的炎症介质积聚,增加术后肠梗阻发生的风险[15]。③T分期:T分期越晚,肿瘤直径越大,出现淋巴结转移的可能性越高,手术中常需要行淋巴结清扫,会引起淋巴干和淋巴管的损伤,引起术区广泛渗液; 淋巴结转移造成淋巴液回流障碍,引起负责区域组织水肿,造成局部炎症反应加剧,增加了术后肠梗阻发生的风险。④腹腔镜手术:与传统开腹手术相比,腹腔镜手术可以将腹腔内复杂的组织结构放大后立体化呈现给术者,简化了血管、神经的识别与保护,减少了手术出血量,缩短了手术时间[16];腹腔镜手术在相对封闭的空间进行操作,降低了纱布绒毛等异物进入腹腔的风险,腹腔镜手术切口小,对腹膜损伤小,减轻了腹腔内的炎症反应;此外,腹腔镜视野下手术操作精细,可最大化减少对胃肠及系膜的牵拉,维持了胃肠黏膜免疫与神经调节的稳态[17]。
本研究结果表明,肠梗阻是结肠癌术后的常见并发症。高龄、术前存在肠梗阻的病人属于术后肠梗阻高危人群,而采取腹腔镜手术则是保护措施。对于高危人群可通过选取合适的手术方式,提高手术操作水平等措施,降低术后肠梗阻发生率,提高结肠癌围手术期的疗效,改善病人的生活质量。
1 叶德敬,刘超英,张雨洁.结直肠癌的流行病学及研究现状.世界最新医学信息文摘,2016,16:34-35.
2 顾晋,邢加迪.结肠癌治疗指南.中华胃肠外科志,2005,8:269-272.
3 李思伟,王素彬.完整结肠系膜切除在结肠癌手术治疗中的应用.中外医疗,2014,34:97-99.
4 孟付钱.结肠癌性梗阻手术治疗的方法与并发症分析.临床合理用药杂志,2017,10:169-170.DOI:10.15887/j.cnki.13-1389/r.2017.05.116.
5 王延明,岳海岭,茆成祥,等.结直肠癌根治术后肠梗阻76例分析.临床军医杂志,2015,43:441-443.
6 宋希根.CT、X线片及超声在肠梗阻诊断中的应用价值分析.中外医学研究,2017,15:49-50.
7 邓金和,贺繁荣,招伟贤.胃肠手术病人术前贫血与术后并发症的关系.广东医学,2017,55:900-902.
8 Amin MB,Edge SB,Greene FL,et al.AJCC Cancer Staging Manual.8th ed.New York: Springer,2016.203-220.
9 Kronberg U,Kiran RP,Soliman MS,et al.A characterization of factors determining postoperative ileus after laparoscopic colectomy enables the generation of a novel predictive score.Ann Surg,2011,253:78-81.
10许松欣,丁岩冰.结直肠癌术后肠梗阻相关因素分析.胃肠病学,2013,18:619-621.
11Ghazi S, Lindforss U.Analysis of colorectal cancer morphology in relation to sex,age,location,and family history.J Ggastro enterol,2012,47:619-634.DOI: 10.1007/s00535-011-0520-9.
12李晓雪,娄长杰,陆海波.左右半结肠癌生物学差异及生存预后.现代肿瘤医学,2017,25:1508-1512.
13周丽芳.腹部外科术后病人胃肠功能恢复影响因素的研究.泰山医学院学报,2015,37:535-536.
14詹天成,李明,顾晋.结直肠癌腹腔镜手术.中国肿瘤,2011,20:194-199.
15曾庆智.结肠癌致肠梗阻的外科治疗体会.右江医学,2013,42:82-83.
16Aly EH.Robotic colorectal surgery:summary of the current evidence.Int J Colorectal Dis,2014,29:1-8.DOI: 10.1007/s00384-013-1764-z.
17吴时胜,张飞.胃肠动力、功能性疾病的神经胃肠病学研究.中国实用神经疾病杂志,2014,17:95-96.
Influencingfactorsofintestinalobstructionaftercoloncancersurgery
SongLinjie,LiSongyan,NaXingbang,YangYu,ZhangHongliang,DuXiaohui.
DepartmentofGeneralSurgery,PLAGeneralHospital,Beijing100853,China
DuXiaohui,Email:duxiaohui301@sina.com
ObjectiveTo investigate the incidence of intestinal obstruction one month after surgical procedure, and the influencing factors.MethodsThe clinical data of 227 cases diagnosed with colon cancer who
colorectal surgery from Oct. 2014 to Oct. 2016 In PLA General Hospital were collected, and all patients were followed up for 1 month after operation.The incidence of intestinal obstruction was statistically analyzed. The influencing factors were analyzed by chi-square test and multi-factor unconditioned Logistic regression analysis.ResultsNineteen cases out of 227 patients with colorectal cancer suffered from intestinal obstruction with an incidence rate of 8.37%. Of 19 cases of intestinal obstruction, including 11 cases of inflammatory intestinal obstruction, 4 cases of mechanical intestinal obstruction and 4 cases of paralytic intestinal obstruction.Chi-square test showed that the patients with preoperative intestinal obstruction and higher T staging showed higher incidence of intestinal obstruction. The incidence rate of intestinal obstruction in the patients receiving laparoscope was significantly lower than that in the patients receiving traditional open operation(P<0.05). Multi-factor unconditioned Logistic regression analysis showed that age (OR=0.158, 95%CI:0.114-1.215), preoperative intestinal obstruction (OR=1.114, 95%CI: 0.482-1.664) and T staging (OR=1.752, 95%CI: 0.972-6.721) were risk factors for intestinal obstruction one month after radical surgery in elderly patients with colorectal cancer, and laparoscopic surgery (OR=1.678, 95%CI:0.533-3.492) was the protective factor.ConclusionsThe incidence of intestinal obstruction one month after radical surgery in patients with colorectal cancer is high. We should focus on high-risk groups to avoid the occurrence of intestinal obstruction by means of necessary preventive measures such as selecting appropriate operation and improving the general situation of the patients.
Colon cancer; Intestinal obstruction; Influencing factors
R657.3
A
10.3969/j.issn.1003-5591.2017.06.015
国家自然科学基金面上项目(61170123)
100853 北京,中国人民解放军总医院普通外科(宋林杰、李松岩、那兴邦、杨宇、张红亮、杜晓辉);南开大学医学院(宋林杰)
杜晓辉,Email:duxiaohui301@sina.com
2017-06-02)

