南海东北部分粒级叶绿素a和超微型光合生物的周日变化
姜歆,黄良民,谭烨辉,李佳俊,柯志新,赵春宇
(1.中国科学院南海海洋研究所中国科学院热带海洋生物资源与生态重点实验室,广东广州510301;2.广东省应用海洋生物学重点实验室,广东广州510301;3.中国科学院大学,北京100049)
南海东北部分粒级叶绿素a和超微型光合生物的周日变化
姜歆1,2,3,黄良民1,2,3,谭烨辉1,2,李佳俊1,2,3,柯志新1,2,赵春宇1,2,3
(1.中国科学院南海海洋研究所中国科学院热带海洋生物资源与生态重点实验室,广东广州510301;2.广东省应用海洋生物学重点实验室,广东广州510301;3.中国科学院大学,北京100049)
分别于2014年春、秋和2015年夏3个季节对南海东北部A站位(118°E,21.5°N)分粒级叶绿素a浓度和超微型光合生物(原绿球藻、聚球藻和超微型真核藻类)细胞丰度的昼夜变化进行了24 h时间序列连续观测和分析。通过萃取荧光法分析叶绿素a浓度,发现叶绿素a浓度呈现明显的昼夜变化,春季正午最高,秋季和夏季基本变化趋势为白天升高,夜晚降低;而因夏季中午的光抑制作用,叶绿素a的浓度相对较低。超微型光合生物(0.2~3 μm)对总叶绿素a的贡献最高(>71.49%),小型浮游植物(>20 μm)贡献率最低(<10.41%)。通过流式细胞技术检测到3个超微型光合生物类群;其中,原绿球藻为优势类群,最大细胞丰度达1.05×105cells/mL,其次是聚球藻,超微型真核藻类的细胞丰度最低,但由于其单位细胞内的叶绿素a含量高,所以可能对叶绿素a的贡献最大。聚球藻丰度基本上白天下降,傍晚到午夜上升;秋季和夏季,超微型真核藻类的丰度白天高,夜晚低,而春季则相反;原绿球藻在秋季和春季的昼夜变化规律和超微型真核藻类相似。在多种因素共同影响下,光照是调控叶绿素a浓度和超微型光合生物丰度昼夜变化的一个关键因素。季节变化上,原绿球藻的细胞丰度季节间没有统计学差异(P>0.05),聚球藻的季节变化为秋>夏>春,超微型真核藻类的季节变化规律和聚球藻相反。
分粒级叶绿素a;超微型光合生物;昼夜变化;季节变化;南海东北部
叶绿素a(chlorophyll a,Chl a)是浮游植物进行光合作用的主要色素,也是海洋浮游植物现存量的一个通用指标。根据粒径谱,粒径为0.2~2 μm(或3 μm)的浮游植物被称为超微型光合生物(picophytoplankton)(Sieburth et al,1978),是迄今发现最小的一类光合自养生物。超微型光合生物在世界各个海域中广泛存在,包括超微型真核藻类(picoeukaryotes,Euk)以及两类蓝藻——原绿球藻(Prochlorococcus,Pro)和聚球藻(Synechococcus,Syn)。它们碳氮利用效率高,尤其在寡营养海区丰度高(Raven,1998),是海洋生态系统Chl a和初级生产力的重要贡献者,在南海贡献率大于50%(Huang et al,1999)。同时,超微型光合生物在生物泵(Richardson et al,2007)和微食物环(Joint,1986;张武昌等,2016)中也发挥着不可或缺的作用。
大部分浮游植物存在昼夜波动现象,例如,在西北地中海冬季Syn和Euk从黎明到傍晚生长(Jacquet et al,1998;2002)。浮游植物的昼夜波动受到多种因素的影响,包括:理化因素,如潮汐(王磊等,2013)、光照(Bratbak et al,2011;Mitbavkar et al,2015;Six et al,2007)、浊度(Lefort et al,2013;李云等,2011)、营养盐(Liu et al,2011)等;生物因素,如摄食(Dolan et al,1999;Tsai et al,2012;2015)、病毒裂解(Tsai et al,2012;2015);以及基因因素等。其中,光照被认为是影响浮游植物昼夜波动最关键的因子(Bratbak et al,2011;Mitbavkar et al,2015;Six et al,2007),例如,Syn细胞周期与光周期一致,由基因“时钟”控制(Jacquet et al,2002;Llabres et al,2011)。浮游植物周期性的波动表明,细胞生长和分裂与被摄食和裂解相平衡,维持了群落的相对稳定性(Landry et al,1995)。
南海是西太平洋最大的半封闭边缘海,常年受东亚季风驱动的环流影响。南海东北部地形复杂,受珠江淡水输入、沿岸流、上升流、黑潮分支入侵和涡旋等物理现象影响。该区域的太阳辐射、温度、营养盐和物理过程季节变化明显。近年来,关于南海东北部超微型光合生物的昼夜波动已开展了广泛研究,都集中在近岸海域,研究表明:降水是影响大亚湾Syn和Euk昼夜波动的关键因素(Liu et al,2011),原生动物摄食、潮汐和海流性质可能共同影响了台湾海峡、珠江口附近的陆架区和东沙海域的超微型光合生物的昼夜变化(Cai et al,2007;Huang et al,2002;黄邦钦等,2003)。但在南海寡营养海区还未见关于超微型光合生物昼夜变化的报道,其变化机制也尚不清楚。以往对叶绿素的周日变化研究较多(Liu et al,2015;王磊等,2013),但多关注单个季节,缺乏季节间比较研究。本研究在南海东北部海盆区的一个连续站,在春、秋和夏3个季节进行连续观测,旨在通过分析分粒级Chl a和超微型光合生物的周日波动及季节差异,讨论其时间序列变化的影响因素,为南海东北部微型浮游生物生态过程研究和生态动力学模型的建立提供基础数据。
1 材料与方法
1.1 采样站点
搭乘“实验3”科考船,在南海东北部设置了A站(118°E、21.5°N,水深约1 433 m)进行24 h时间序列定点观测(图1)。分别于2014年5月22日(春季)6∶00、10月31日(秋季)6∶00和2015年8月17日(夏季)21∶00开始,至次日同一时刻,每3 h采样一次,各采样9次。由附于CTD(Seabird SBE 911)上的8L-Niskin采水器采集0、25、50、75、100和200 m海水。

图1 南海东北部连续站A的位置
1.2 样品采集与分析
取2 ml海水于冻存管中,设置3个平行,加入终浓度为2%的过滤甲醛混匀,暗保存15~20 min后置于液氮。回实验室后-80℃保存(Qiu et al,2010)。将冰冻样品融化后,部分样品加入YG荧光小球(1 μm;Polysciences)作为内参,用流式细胞仪(Accuri C6,Becton-Dickson,488nm和640nm激发)分析。通过侧向角信号(SSC)、橙色荧光(FL2,585±40 nm)和红色荧光(FL3,>670nm;FL4,675±25 nm)的双参数图来划分超微型浮游生物的3个类群并计数(焦念志,2006;Jiang et al,2017)。类群划分的依据如图2:Syn有橙色荧光;Euk只有较强的红色荧光而无橙色荧光;Pro只有较弱的红色荧光。通过FL3信号,Pro因与背景噪音重合无法划分(GérikasRibeiro et al,2016),会大大低估Pro的丰度,而通过FL4信号可以较好的区分Pro和噪音。对于用FL4信号Pro仍然与噪音有部分重叠的表层和25 m样品(如图2),用直方图中可清晰区分的一半乘以2得到Pro类群计数(Jiang et al,2017)。超微型光合生物细胞丰度为类群计数除以进样体积。
为了获得分粒级Chl a的样品,取海水0.5~1 L依次通过孔径为20 μm的尼龙膜、3 μm的聚碳酸酯膜(Millipore)和GF/F膜(Whatman),以>20μm,3~20 μm和0.7~3 μm粒级分别代表micro-、nano-和pico-Chl a,将滤膜置于液氮保存。回实验室后,将滤膜浸入90%丙酮溶液萃取24 h,用叶绿素荧光计(TurnerDesign10AU)测定分粒级Chl a浓度(Parsons et al,1984)。
1.3 数据处理
超微型光合生物丰度或Chl a浓度的水柱平均值用梯形积分法(谭激扬等,2013)计算。垂直分布图用Ocean Data View 4.7(Schlitzer R,http://odv.awi.de,2015)绘制。t检验用SPSS 21.0完成。其他图形绘制和数据分析用Origin 9.2完成。

图2 超微型光合生物表层样品的流式细胞图
2 结果
2.1 采样站位的环境特征
海水温盐呈现波动模式(图3)。表层温度夏>春>秋,一般是正午时段最高,春季的昼夜温差最大,为0.95℃;表层盐度季节和昼夜变化趋势和表层温度相反。垂直波动上,春季15∶00-18∶00在50~75m观察到温盐等值线抬升,呈现低温高盐特点,可能是由于深层水的涌升造成的,而在9∶00-12∶00和21∶00温盐等值线下沉。秋季,从观测开始到18∶00-21∶00,温盐等值线下沉,随后抬升。在夏季,8月17日21∶00和18日9∶00-15∶00温盐等值线抬升;18日3∶00-6∶00和21∶00下沉。对比3个季节,秋季海水比春夏季混合得均匀。
A站位3个季节200m以浅的营养盐垂直变化各有不同。如图4,3个季节0~50 m各种营养盐浓度都很低,体现出A站位寡营养的特点。对比季节变化,浓度浅层秋季稍高,50 m以深是春季最高;浓度0~50 m夏季稍高,深层则是春>秋>夏;浓度在0 m夏>春>秋,50 m以深则是春>夏>秋。
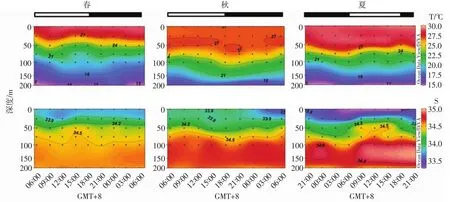
图3 南海东北部A站温盐的昼夜变化
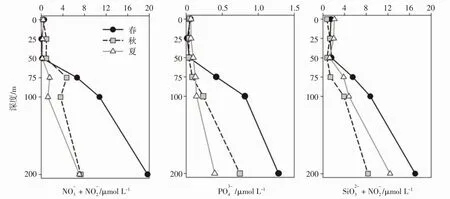
图4 A站位3个季节营养盐的垂向变化
2.2 分粒级叶绿素a的季节和昼夜变化
表层总Chla浓度在春季最低(0.05~0.08μg/L),秋季略高(0.07~0.12μg/L),夏季最高(0.06~0.17μg/L)。Chl a次表层最大值(deep chlorophyll maximum,DCM)深度春季在50 m,而秋季和夏季在75 m,最大值分别为0.51、0.37和0.47 μg/L。200 m水柱平均Chl a浓度季节间没有明显差异(P>0.05),但秋季的垂直分布更均匀(图5)。
昼夜变化上,如图5和6,春季总Chla在12∶00达到最大值,后逐渐减小并趋于稳定(除了在21∶00也观察到一个峰)。秋季从10月31日9∶00开始总Chl a呈逐渐累积趋势,在18∶00达到最大值,而在夜间总Chl a浓度逐渐下降,呈消耗状态。夏季总Chl a昼夜波动不大。总的来说,3个季节总Chla等值线和温盐等值线呈现相同的趋势,总Chla最大值出现的时刻与温度最大值吻合(图3和5)。
3个季节各粒级Chl a的昼夜变化趋势和最大值深度与总Chl a基本一致(图5),不同的是,在夏秋两季0~25 m总Chl a浓度较低,而micro-和nano-Chl a出现了高值区。用各粒级Chl a浓度除以总Chl a浓度得出各粒级的贡献率,发现3个季节pico级生物是Chl a浓度的最主要贡献者,春秋夏的贡献率为71.49±17.70%、75.31±16.67%和73.20±12.45%,季节差异不明显(P>0.05)。贡献率其次是微型(nano级)浮游植物(15.82~20.20%),贡献率最小的为小型(micro级)浮游植物(8.33~10.41%)。
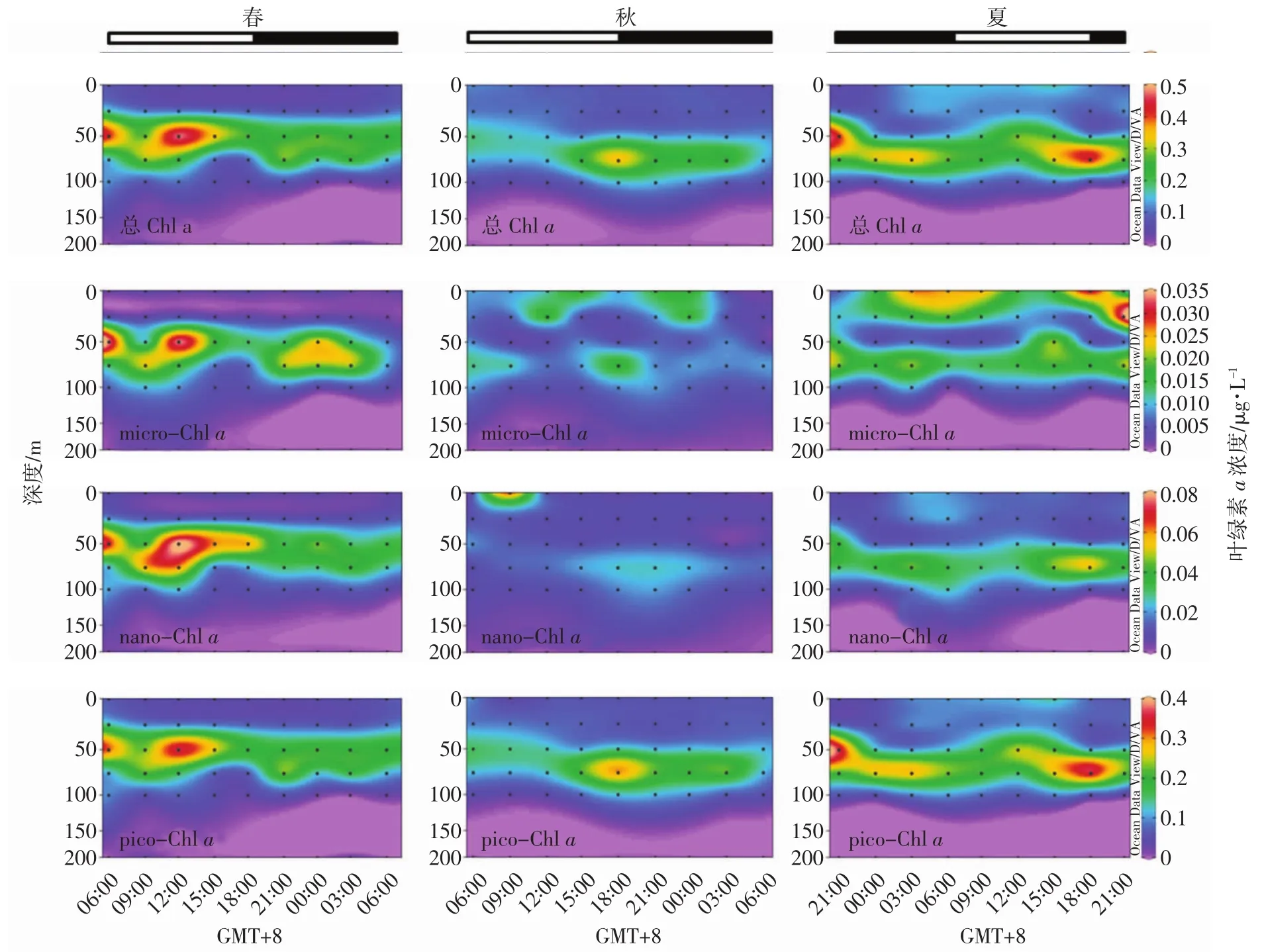
图5 分粒级叶绿素a浓度(μg L-1)的昼夜变化
2.3 超微型光合生物的季节和昼夜变化
在A站3个季节的连续观测发现,Pro是丰度最高的超微型光合生物,其次是Syn,Euk丰度最低,三者观测到的最大值分别为1.05×105、5.78×104和1.63×104cells/mL。Pro丰度没有明显季节差异(P>0.05),Syn丰度秋>夏>春,Euk丰度春>夏>秋。
在表层,Syn夏季丰度(31.81±18.91×103cells/mL)最高,秋季(13.26±3.05×103cells/mL)次之,春季(3.34±1.85×103cells/mL)最低(P<0.05)。Euk表层丰度的季节变化规律和Syn相同,且次表层丰度最大值层深度与DCM吻合。Pro表层丰度较低(0.32~5.03×103cells/mL),3个季节Pro垂向最大丰度均在75 m,100 m丰度仍很高,达6.81~50.90×103cells/mL。
超微型光合生物呈现出明显的昼夜变化特征(图6和7)。Syn丰度在春季从6∶00开始呈逐渐下降趋势(9∶00在50 m有个高值点),18∶00后丰度增加并在夜间趋于稳定,21∶00-次日0∶00丰度较高;秋季白天Syn丰度下降,6∶00-12∶00在25~50 m为高值区,15∶00达到最低后又上升;夏季Syn丰度在0∶00-5∶00表层出现高值点,变化趋势为夜间逐渐上升,到白天9∶00最高,随后减小至18∶00最低。总体来说,3个季节白天Syn丰度基本呈下降趋势,夜晚总体呈上升趋势。Euk在3个季节的昼夜变化规律不同:春季白天丰度稍高于夜间;秋季在傍晚和夜间丰度较高;夏季夜间丰度高于白天。Pro在3个季节的昼夜变化规律和Euk相似,不同的是夏季白天和夜间Pro的丰度相差无几。
从垂直的昼夜变化图(图7)上看出,超微型光合生物的3个类群与pico-Chl a的垂直分布和昼夜波动规律相似。3个类群与pico-Chl a的回归分析(图8)表明,Euk和pico-Chl a的线性关系最强,r≥0.849(P<0.001)。相比于Euk,Syn和Pro与pico-Chl a的线性关系则相对较弱。
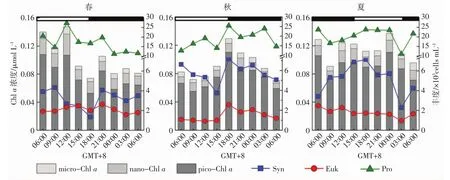
图6 叶绿素a浓度和超微型光合生物丰度200 m水柱平均值的昼夜变化
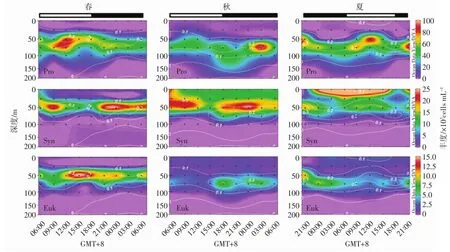
图7 超微型光合生物丰度(×103cells mL-1)的昼夜变化。叠加的白色等值线代表pico-Chl a/μgL-1

图8 超微型光合生物丰度与pico-Chl a浓度的回归分析
3 讨论
3.1 叶绿素a和超微型光合生物的昼夜变化
在南海东北部A站位,总Chl a呈现明显的昼夜变化。春季在正午温度较高、光照最强时,总Chl a浓度出现峰值,是因为藻细胞此时最活跃;秋季和夏季总Chl a浓度基本是在白天增加,在夜晚逐渐减小,说明光照有利于Chl a的积累(Liu et al,2015)。夏季9∶00-12∶00总Chl a浓度下降,是因为夏季正午光照太强,产生了光抑制作用。夏季21∶00,50 m水层的总Chl a也出现了高值,主要是因为超微型光合生物的高细胞丰度(图7)。
本文测定超微型光合生物的丰度,使用的BD Accuri C6流式细胞仪存在灵敏度低的缺陷(Gérikas Ribeiro et al,2016)。针对这个问题,采用两种弥补办法,一是用FL2-FL4流式细胞图,二是直方图校正。用上述方法得出的结果和BD FACSCalibur流式细胞仪的结果做过对比,可以在南海东北部大致弥补这个缺陷(Jiang et al,2017),但在其他海域是否能大致弥补,还需要进一步探讨。为了谨慎起见,避免误导读者,需要说明本文表层Pro数据的参考价值不大。在今后的流式细胞分析中,如果要分析Pro,建议不要使用Accuri C6,而使用灵敏度较高的机型,如FACSCalibur和FACSCanto。本研究用Accuri C6可以将Syn与背景噪音完全分开,对于Gérikas Ribeiro等(2016)得出的Accuri C6低估Syn丰度的结论,本文并未观察到。
超微型光合生物的昼夜变化受到多种因素的影响,其中,光照被认为是一个至关重要的因素(Bratbak et al,2011;Mitbavkar et al,2015)。一方面,光照促进藻细胞生长繁殖和叶绿素的形成,另一方面,强光使细胞DNA损伤的风险加大(Six et al,2007)。本研究发现,Syn丰度在3个季节基本呈现白天下降,傍晚到午夜上升的趋势,说明Syn在夜晚生长速率大于死亡速率,而白天生长速率小于死亡速率,这种现象曾被报道(Llabres et al,2011;Tsai et al,2005)。已有研究表明,Syn的死亡细胞比例在白天不断增加,以黄昏时最高(Llabres et al,2011),这是因为紫外线造成的细胞DNA损伤在白天不断累积(Boelen et al,2002)。黄昏时虽然Syn丰度最低,但其细胞分裂能力最强(Campbell et al,1986;Dolan et al,1999;Lefort et al,2013)。夜晚,Syn死亡细胞比例不断下降,而位于G1期的细胞(代表刚分裂完成的新细胞)比例不断增多(Llabres et al,2011),所以在午夜左右Syn丰度达到最高(Campbell et al,1986;Tsai et al,2005)。在白天也观察到Syn细胞丰度的高值,如秋季6∶00-12∶00在25~50 m,夏季6∶00-15∶00的表层,是由于夜晚丰度的暂时累积造成。
在A站位,Pro的细胞丰度在秋季白天高,夜晚低,春季则相反,夏季白天和夜晚相差无几。有研究表明Pro的昼夜变化规律和Syn相似,只是分裂和死亡的高峰期有时间先后差别(Jacquet et al,2001;Llabres et al,2011;Vaulot et al,1999)。本文研究显示Pro和Syn部分时段的变化规律相似,如春季15∶00-次日0∶00(r=0.95,P<0.05),秋季12∶00-次日6∶00(r=0.81,P<0.05),夏季0∶00-次日9∶00及15∶00-21∶00(r=0.77,P<0.05)(图6),在其他时间段二者的变化规律不同,说明还有其他的因素也起了关键作用,如浮游动物的选择性摄食等(Christaki et al,1999),但一般认为,在外海,病毒的裂解作用不明显(Huang et al,2002)。
光照对Syn和Pro的影响在室内纯培养实验中也早有证实。光照是调节Syn WH8101细胞生长分裂与DNA复制的关键因素之一(Binder,2000),Pro细胞周期相关基因的表达也受光照调控(Holtzendorff et al,2001;Jacquet et al,2001)。Syn和Pro都有多种生态型,不同生态型的光适应和光修复能力各有不同,得以适应海洋中复杂多变的环境(Six et al,2007),这也是它们在世界范围海域广泛分布的一个重要原因。
本研究发现,Euk和Pro的昼夜变化规律相似,推测两者可能受相同因子控制。Euk包含很多门类,包括绿藻门、不等鞭毛门、隐藻门、定鞭藻门和Alveolates等的10多个纲(宁修仁,1997;钟瑜等,2008),Euk丰度的季节差异反映出季节间存在着群落的演替(Chen et al,2011)。Euk丰度在秋季和夏季都是夜间较高,而在春季则是白天较高,说明秋季和夏季Euk的群落组成可能相似,而与春季差异很大。因此,对Euk的群落结构组成需要进一步的深入研究。
在光照影响的基础上,本研究还观察到Chl a和超微型光合生物的3个类群的垂向波动与温、盐等值线呈现相同的趋势,在春季和秋季的DCM层,Chl a、超微型光合生物与温度都呈显著相关(P<0.05),说明潮汐混合和垂向流等物理过程对它们的昼夜波动也有重要影响(王磊等,2013)。生物因素也不可忽略。在昼夜波动上,Syn和Euk在春季出现“此消彼长”的现象,12∶00-18∶00时段,Syn丰度较低,Euk丰度较高,而在其他时间段,Syn丰度较高,Euk丰度较低,这是因为Syn和Euk的最大值都在50 m,50 m的营养盐浓度很低,尤其是浓度接近检测限(图3),所以Euk和Syn可能产生竞争,在50 m二者的丰度呈显著负相关(r=-0.48,P<0.05)。在夏季和秋季,二者的生态位出现分化,最大值深度不同,所以昼夜垂直变化上竞争不明显。此外,浮游动物(纤毛虫、鞭毛虫等)的摄食也是影响超微型光合生物昼夜变化的关键因素。Tsai等(2015)认为,Syn被微型异养鞭毛虫(nanoflagellate)摄食速率以及被病毒裂解速率夜晚高于白天,抵消掉一部分Syn在夜晚的高分裂速度,以维持动态平衡(Tsai et al,2015)。
3.2 叶绿素a和超微型光合生物的季节变化
A站位于寡营养的南海海盆区,研究发现,Pro在3个季节丰度都最高,数量级为104~105cells/mL。本研究检测到的3个类群的丰度和该海区前人研究结果接近(Cai et al,2007;Chen et al,2011;Liu et al,2007;Wang et al,2016;乐凤凤等,2015;林学举,2001;宁修仁等,2003;魏玉秋等,2015;张渊洲等,2015)。历史研究表明,南海海盆区秋、冬季Syn和Euk的丰度与Chla浓度高于春、夏季,Pro则相反(Cai et al,2007;Chen et al,2011;Liu et al,2007;乐凤凤等,2015)。这是因为10月至翌年3月,东北季风盛行,海表面温度下降,风生混合加强,混合层加深,真光层营养盐浓度增加。但是本文在A站位真光层营养盐浓度季节变化规律和历史研究不同,说明除了季风的影响外,还有其他影响因素,如陆源输入、涡旋和黑潮入侵等。因此A站位的Chl a浓度和超微型光合生物的季节变化规律和历史观测结果不一致。秋季Chl a和超微型光合生物的垂直分布最均匀,是因为秋季海水垂直混合较强。
一般认为,Syn和Euk生态位相似,季节变化规律往往相似(Cai et al,2007;Chen et al,2011;Liu et al,2007),但是在本研究中,Syn丰度秋>夏>春,Euk季节变化规律却相反,原因可能是两者存在生态位的竞争和分化(Somogyi et al,2009;Winder,2009)。3.1提到的两者在春季昼夜变化上存在的“此起彼伏”现象也是生态位竞争和分化关系的体现。Pro丰度夏季最高,是因为高温对其有促进作用,但季节间没有统计学差异(P>0.05)。
3.3 不同浮游植物类群对叶绿素a的贡献差异
本研究的3个季节,超微型光合生物对总Chl a的贡献都在71%以上,其次依次是微型和小型浮游植物。已有研究表明,从近岸到外海,pico-Chla/Chl a逐渐增大(Liu et al,2015;Qiu et al,2010),在寡营养海区,大粒径的浮游植物竞争力不如小粒径的浮游植物,超微型光合生物占有重要地位,这是因为它们体积微小,比表面积大(Raven,1998),营养盐吸收半饱和常数更低,利于在寡营养海区快速高效利用低浓度营养盐。此外,由于基因缺失,Pro不能利用(Moore et al,2002;Rippka et al,2000),但可以通过降低蛋白表达或者表达氨基酸较少的蛋白来降低对氮元素的需求(Gilbert et al,2011),高浓度的营养盐对Pro有毒害作用(Mann et al,2002;Worden et al,2003),所以Pro适宜生活在寡营养海区。
本研究发现,Euk最大值层与DCM吻合,且Euk与Chl a的线性关系很好,暗示Euk可能是pico-Chl a的主要贡献者。超微型光合生物的3个类群中,Euk虽然丰度通常比Syn和Pro低1~2个数量级,但Euk往往是Chl a和碳生物量的最大贡献者(Buitenhuis et al,2012;Grob et al,2007)。这是因为Euk细胞粒径大于Syn和Pro,单位细胞内Chl a含量也高;Syn和Pro属原核类蓝藻,虽然Syn含有Chl a,Pro也含有被修饰的Chl a,但作为蓝藻,Syn和Pro的捕光色素主要是藻胆素,藻胆素的吸收光谱(470~650 nm)位于Chl a两个吸收高峰(660~665 nm,430 nm)中间的波谷地带(焦念志,2006)。同时,Euk单位细胞内碳含量远超于另外两类(Euk、Syn和Pro单细胞碳含量为1 500、115和59 fg C/cell)(Li et al,2001;Zubkov et al,1998),因此Euk对碳生物量的贡献也最大。
4 结论
南海东北部分粒级Chl a和超微型光合生物均呈现出明显的昼夜波动和季节变化特征。超微型光合生物对总Chl a的贡献大于71%。Pro是丰度最高的超微型光合生物类群,Syn次之,Euk最低。Chl a浓度和超微型光合生物的丰度昼夜波动受到多种因素的影响,光照是最主要因素。Syn丰度午夜前后最高,傍晚前后最低。秋季和夏季,Euk的丰度白天高,夜晚低,而春季则相反;Pro在秋季和春季的昼夜变化规律和Euk相似。季节变化上,Syn丰度变化为秋>夏>春,Euk和Syn季节变化规律相反,两者可能存在生态位竞争和分化。原绿球藻季节变化不明显。Euk与pico-Chl a的变化趋势最接近,Euk可能是pico-Chl a的主要贡献者。
目前,研究超微型光合生物的短期波动,除了单纯用流式细胞计数外,流式细胞法结合DNA染色定量法区分细胞周期则能提供更多的信息,这也是以后的发展趋势。此外,对Chl a和超微型光合生物昼夜波动的其他影响因素,如浮游动物的选择性摄食、病毒的裂解作用,下一步需要深入探讨。
致谢:感谢“实验3”全体成员给予的支持和帮助。向晨晖、周林滨、刘华健参与野外采样工作,在此一并致谢。
Binder B,2000.Cell cycle regulation and the timing of chromosome replication in a marine Synechococcus(cyanobacteria)during light-and nitrogen-limited growth.Journal of Phycology,36(1):120-126.
Boelen P,Post A F,Veldhuis M J W,et al,2002.Diel patterns of UVBR-induced DNA damage in picoplankton size fractions from the Gulf of Aqaba,Red Sea.Microbial Ecology,44(2):164-174.
Bratbak G,Jacquet S,Larsen A,et al,2011.The plankton community in Norwegiancoastalwaters-abundance,composition,spatial distribution and diel variation.Continental Shelf Research,31(14):1500-1514.
Buitenhuis E T,Li W K W,Vaulot D,et al,2012.Picophytoplankton biomass distribution in the global ocean.Earth System Science Data,4(1):37-46.
Cai Y M,Ning X R,Liu C G,et al,2007.Distribution pattern of photosynthetic picoplankton and heterotrophic bacteria in the northern South China Sea.Journal of Integrative Plant Biology,49(3):282-298.
Campbell L,Carpenter E J,1986.Diel Patterns of Cell-Division in Marine Synechococcus Spp(Cyanobacteria)-Use of the Frequency of Dividing Cells Technique to Measure Growth-Rate.Marine Ecology Progress Series,32(2-3):139-148.
Chen B Z,Wang L,Song S Q,et al,2011.Comparisonsof picophytoplankton abundance,size,and fluorescence between summer and winter in northern South China Sea.Continental Shelf Research,31(14):1527-1540.
Christaki U,Jacquet S,Dolan J R,et al,1999.Growth and grazing on ProchlorococcusandSynechococcusbytwomarineciliates.Limnology and Oceanography,44(1):52-61.
Dolan J R,Simek K,1999.Diel periodicity in Synechococcus populations and grazing by heterotrophic nanoflagellates:Analysis of food vacuole contents.Limnology and Oceanography,44(6):1565-1570.
Gérikas Ribeiro C,Marie D,Lopes dos Santos A,et al,2016.Estimating microbial populations by flow cytometry:Comparison between instruments.Limnology and Oceanography:Methods,14(11):750-758.
Gilbert J D,Fagan W F,2011.Contrasting mechanisms of proteomic nitrogen thrift in Prochlorococcus.Molecular Ecology,20(1):92-104.
Grob C,Ulloa O,Li W K W,et al,2007.Picoplankton abundance and biomass across the eastern South Pacific Ocean along latitude 32.5 degrees S.Marine Ecology Progress Series,33253-62.
Holtzendorff J,Partensky F,Jacquet S,et al,2001.Diel expression of cell cycle-related genes in synchronized cultures of Prochlorococcus sp strain PCC 9511.Journal of Bacteriology,183(3):915-920.
Huang B Q,Hong H S,Wang H L,1999.Size-fractionated primary productivity and the phytoplankton-bacteria relationship in the Taiwan Strait.Marine Ecology Progress Series,18329-38.
Huang B,Lin X,Liu Y,et al,2002.Ecological study of picoplankton in northern South China Sea.Chinese Journal of Oceanology and Limnology,2022-32.
Jacquet S,Lennon J F,Marie D,et al,1998.Picoplankton population dynamics in coastal waters of the northwestern Mediterranean Sea.Limnology and Oceanography,43(8):1916-1931.
Jacquet S,Partensky F,Lennon J F,et al,2001.Diel patterns of growth and division in marine picoplankton in culture.Journal of Phycology,37(3):357-369.
Jacquet S,Prieur L,Avois-Jacquet C,et al,2002.Short-timescale variability of picophytoplankton abundance and cellular parameters in surface waters of the Alboran Sea(western Mediterranean).Journal of Plankton Research,24(7):635-651.
Jiang,X.,Li J,Ke Z,et al,2017.Characteristics of picoplankton abundances during a Thalassiosira diporocyclus bloomin the Taiwan Bankin latewinter,Marine Pollution Bulletin.(In press)
Joint I R,1986.Physiological ecology of picoplankton in various oceanographic provinces.Canadian Bulletin of Fisheries and Aquatic Sciences287-309.
Landry M R,Kirshtein J,Constantinou J,1995.A Refined Dilution Technique for Measuring the Community Grazing Impact of Microzooplankton,withExperimentalTestsintheCentral Equatorial Pacific.Marine Ecology Progress Series,120(1-3):53-63.
Lefort T,Gasol J M,2013.Short-time scale coupling of picoplankton community structure and single-cell heterotrophic activity in winter in coastal NW Mediterranean Sea waters.Journal of Plankton Research,36(1):243-258.
LiWKW,HarrisonWG,2001.Chlorophyll,bacteriaand picophytoplankton in ecological provinces of the North Atlantic.Deep-Sea Research Part II-Topical Studies in Oceanography,48(10):2271-2293.
Liu H B,Chang J,Tseng C M,et al,2007.Seasonal variability of picoplankton in the northern South China Sea at the SEATS station.Deep-Sea Research Part II-Topical Studies in Oceanography,54(14-15):1602-1616.
Liu H,Song X,Huang L,et al,2011.Diurnal variation of phytoplankton community in a high frequency area of HABs:Daya Bay,China.Chinese Journal of Oceanology and Limnology,29(4):800-806.
Liu H,Xue B,Feng Y,et al,2015.Size-fractionated Chlorophyll a biomass in the northern South China Sea in summer 2014.Chinese Journal of Oceanology and Limnology,34(4):672-682.
Llabres M,Agusti S,Herndl G J,2011.Diel in Situ Picophytoplankton Cell Death Cycles Coupled with Cell Division(1).Journal of Phycology,47(6):1247-1257.
Mann E L,Ahlgren N,Moffett J W,et al,2002.Copper toxicity and cyanobacteriaecologyintheSargassoSea.Limnologyand Oceanography,47(4):976-988.
Mitbavkar S,Saino T,2015.Diurnal variability of Synechococcus abundance in Sagami Bay,Japan.Hydrobiologia,747(1):133-145.
Moore L R,Post A F,Rocap G,et al,2002.Utilization of different nitrogen sources by the marine cyanobacteria Prochlorococcus and Synechococcus.Limnology and Oceanography,47(4):989-996.
Parsons T R,Maita Y,Lalli C M,1984.A Manual of Chemical and Biological Seawater Analysis.New York:Pergamon.
Qiu D J,Huang L M,Zhang J L,et al,2010.Phytoplankton dynamics in and near the highly eutrophic Pearl River Estuary,South China Sea.Continental Shelf Research,30(2):177-186.
Raven J A,1998.The twelfth Tansley Lecture.Small is beautiful:the picophytoplankton.Functional Ecology,12(4):503-513.
Richardson T L,Jackson G A,2007.Small phytoplankton and carbon export from the surface ocean.Science,315(5813):838-840.
Rippka R,Coursin T,Hess W,et al,2000.Prochlorococcus marinus Chisholm et al.1992 subsp pastoris subsp nov strain PCC 9511,the first axenic chlorophyll a(2)/b(2)-containing cyanobacterium(Oxyphotobacteria).International Journal of Systematic and Evolutionary Microbiology,501833-1847.
Sieburth J M,Smetacek V,Lenz J,1978.Pelagic ecosystem structure:Heterotrophic compartments of the plankton and their relationship to plankton size fractions 1.Limnology and Oceanography,23(6):1256-1263.
Six C,Finkel Z V,Irwin A J,et al,2007.Light Variability Illuminates Niche-Partitioning among Marine Picocyanobacteria.Plos One,2(12).
Somogyi B,Felfoldi T,Vanyovszki J,et al,2009.Winter bloom of picoeukaryotes in Hungarian shallow turbid soda pans and the role of light and temperature.Aquatic Ecology,43(3):735-744.
Tsai A Y,Chiang K P,Chang J,et al,2005.Seasonal diel variations of picoplankton and nanoplankton in a subtropical western Pacific coastal ecosystem.Limnology and Oceanography,50(4):1221-1231.
Tsai A Y,Gong G C,Hu S L,2015.Virus Effect on Marine Synechococcus Spp.Loss in Subtropical Western Pacific Coastal Waters During Winter.Terrestrial Atmospheric and Oceanic Sciences,26(5):613-617.
Tsai A-Y,Gong G-C,Sanders R W,et al,2012.Viral lysis and nanoflagellate grazing as factors controlling diel variations of Synechococcus spp.summer abundance in coastal waters of Taiwan.Aquatic Microbial Ecology,66(2):159-167.
Vaulot D,Marie D,1999.Diel variability of photosynthetic picoplankton in the equatorial Pacific.Journal of Geophysical Research-Oceans,104(C2):3297-3310.
Wang J X,Tan Y H,Huang L M,et al,2016.Response of picophytoplankton to a warm eddy in the northern South China Sea.Oceanological and Hydrobiological Studies,45(2):145-158.
Winder M,2009.Photosynthetic picoplankton dynamics in Lake Tahoe:temporal and spatial niche partitioning among prokaryotic and eukaryotic cells.Journal of Plankton Research,31(11):1307-1320.
Worden A Z,Binder B J,2003.Application of dilution experiments for measuring growth and mortality rates among Prochlorococcus and Synechococcus populations in oligotrophic environments.Aquatic Microbial Ecology,30(2):159-174.
Zubkov M V,Sleigh M A,Tarran G A,et al,1998.Picoplanktonic community structure on an Atlantic transect from 50 degrees N to 50 degrees S.Deep-Sea Research Part I-Oceanographic Research Papers,45(8):1339-1355.
黄邦钦,洪华生,林学举,等,2003.台湾海峡微微型浮游植物的生态研究——Ⅰ.时空分布及其调控机制.海洋学报,25(4):72-82.
焦念志,2006.海洋微型生物生态学.北京:科学出版社.
乐凤凤,蔡昱明,孙军,等,2015.2009年冬、夏季南海北部超微型浮游生物的分布特征及其环境相关分析.海洋学报,37(12):41-55.
李云,李道季,张利华,等,2011.长江口极微型和微微型浮游生物的垂向变化与周日波动.海洋科学,35(9):24-30.
林学举,2001.南海北部微微型浮游生物结构及叶绿素α最大值的形成机制.厦门大学.
宁修仁,1997.海洋微型和超微型浮游生物.东海海洋,15(3):61-65.
宁修仁,蔡昱明,李国为,等,2003.南海北部微微型光合浮游生物的丰度及环境调控.海洋学报,25(3):83-97.
谭激扬,黄良民,谭烨辉,等,2013.水团对吕宋海峡浮游植物群落结构的影响.海洋学报,35(6):178-189.
王磊,钟超,柳欣,等,2013.夏季南海东北部和东海陆架浮游植物群落结构昼夜变化的比较研究.海洋学报,35(6):170-177.
魏玉秋,孙军,丁昌玲,2015.2014年夏季南海北部超微型浮游植物分布及环境因子影响.海洋学报,37(12):56-65.
张武昌,陈雪,李海波,等,2016.海洋浮游微食物网对氮、磷营养盐的再生研究综述.海洋通报,35(3):241-251.
张渊洲,张健林,杨清松,等,2015.南海北部春季微微型浮游植物丰度的分布.生物学杂志,32(5):58-62.
钟瑜,黄良民,2008.海洋微型和微微型浮游生物的区域分布与影响因素.生态科学,27(3):179-185.
Diel variations of size-fractionated chlorophyll a and picophytoplankton in the northeastern South China Sea
JIANG Xin1,2,3,HUANG Liang-min1,2,3,TAN Ye-hui1,2,LI Jia-jun1,2,3,KE Zhi-xin1,2,ZHAO Chun-yu1,2,3
(1.Key Laboratory of Tropical Marine Bio-resources and Ecology,South China Sea Institute of Oceanology,Chinese Academy of Sciences,Guangzhou 510301,China;2.Guangdong Provincial Key Laboratory of Applied Marine Biology,South China Sea Institute of Oceanology,Chinese Academy of Sciences,Guangzhou 510301,China;3.University of Chinese Academy of Sciences,Beijing 100049,China)
A time-series station(118°E,21.5°N)was assigned to study the seasonal and diurnal variations of size-fractionated chlorophyll a(Chl a)and picophytoplankton(Prochlorococcus,Synechococcus,and picoeukaryotes)in the northeastern South China Sea in spring,autumn 2014 and summer 2015,respectively.Chl a concentration showed remarkable diel variations,with the highest concentration of spring occurred in the midday.In summer and autumn,Chl a concentration generally increased in the daylight and decreased in the nighttime.However,Chl a concentration was low in the midday of summer because ofthe photoinhibition.Picophytoplankton(0.2~3 μm)was the major contributor to the total Chl a(pico-Chl a/total Chl a>71.49%),and micro-phytoplankton(>20 μm)was the minor one(micro-Chl a/total Chl a<10.41%).Three groups of picophytoplankton were identified by using flow cytometry.In the three seasons,Prochlorococcus was the most abundant in Station A with the maximum abundance 1.05×105cells/mL,followed by Synechococcus.Picoeukaryotes were the minor group but probably contributed most to Chl a due to the higher cellular Chl a content.Among various factors,light is a key factor to control the diurnal variations of Chl a and picophytoplankton.Synechococcus abundance generally decreased during the day and increased from dusk to midnight.Higher abundance of picoeukaryotes occurred during the day and the lower occurred during the night in autumn and summer.An opposite diel variation was observed in spring for picoeukaryotes.The diel variation of Prochlorococcus was similar to picoeukaryotes in spring and autumn.There was no statistical difference of Prochlorococcus abundance between seasons(P>0.05).The abundance of Synechococcus was the highest inautumn,followed by summer and spring,while the seasonal variation of picoeukaryotes was opposite to that of Synechococcus.
size-fractionated chlorophyll a;picophytoplankton;diel variation;seasonal comparison;northeastern South China Sea
Q178.1;P735
A
1001-6932(2017)06-0689-11
10.11840/j.issn.1001-6392.2017.06.012
2016-12-15;
2017-04-27
中国科学院海洋专项(XDA11020305);国家自然科学基金(41130855)。
姜歆(1991-),博士研究生,主要从事海洋生态学研究。电子邮箱:jiangxin12@mails.ucas.ac.cn。
黄良民,研究员。电子邮箱:hlm@scsio.ac.cn。
袁泽轶)

