分批培养产朊假丝酵母合成谷胱甘肽的前体氨基酸优化策略
梁国斌,林 伟,汪 斌,朱 华,贺沁婷,周全法
(江苏理工学院 化学与环境工程学院,江苏 常州 213001)
分批培养产朊假丝酵母合成谷胱甘肽的前体氨基酸优化策略
梁国斌,林 伟,汪 斌,朱 华,贺沁婷,周全法
(江苏理工学院 化学与环境工程学院,江苏 常州 213001)
通过分批培养产朊假丝酵母(Candida utilis),优化前体氨基酸(谷氨酸、甘氨酸和半胱氨酸)添加促进谷胱甘肽(GSH)合成。首先分析C.utilis培养时胞内3种氨基酸自身合成动态;菌体生长阶段,考察前体氨基酸添加对GSH合成及细胞生长的影响;GSH合成阶段,通过响应面优化混合氨基酸添加配比;最后提出菌体生长阶段添加甘氨酸及GSH合成阶段添加3种混合氨基酸的两阶段优化策略。摇瓶结果表明,菌体培养第2小时添加甘氨酸(6 mmol/L),第10小时添加混合氨基酸(谷氨酸 6 mmol/L、甘氨酸 5.5 mmol/L、半胱甘酸 6.5 mmol/L),菌体培养30 h后,细胞质量浓度和GSH产率为10.41 g/L和278 mg/L,比对照增加10.5%和116%;应用于5 L发酵罐中培养,发酵结束后,细胞质量浓度达12.81 g/L,GSH产率为328 mg/L。
产朊假丝酵母(Candida utilis);谷胱甘肽;氨基酸;响应面
0 引言
γ-谷氨酰半胱氨酰甘氨酸又称谷胱甘肽(GSH),在生命活动中具有抗氧化,免疫功能调节,促进糖类、脂肪及蛋白质代谢等作用,广泛应用于医药保健、护肤美容、食品工业等行业[1]。目前工业化生产GSH的方法主要有酶法及发酵法[2]。研究表明,通过低pH值或氧化胁迫[3-4]、优化培养基补料方式[5]、能量代谢[6]、酶活控制均可促进GSH合成[7]。
发酵法生产GSH时,如果胞内3种前体氨基酸(谷氨酸、甘氨酸及半胱氨酸)不能满足GSH合成和菌体生长,将会导致GSH最终产率下降。研究表明,半胱氨酸可显著促进GSH合成,但同时抑制酵母菌体生长[8-9]。尽管前人在氨基酸添加促进GSH合成方面做了相关研究,但添加方式相对单一[10-11]。因而有必要系统考察C.utilis胞内谷氨酸、甘氨酸和半胱氨酸合成动态,提出针对性的优化策略。
为此,本研究通过考察C.utilis培养过程中菌体胞内前体氨基酸合成动态变化情况,指出氨基酸优化策略,为发酸法生产GSH提供一个全新的思路。
1 材料与方法
1.1 材料与试剂
酵母菌株:Candida utilis JSUT-08。
葡萄糖:分析纯,上海实验试剂有限公司;蛋白胨:生物试剂,上海中科昆虫生物技术开发有限公司;酵母粉:生物试剂,安琪酵母股份有限公司;硫酸铵、硫酸镁:分析纯,国药集团化学试剂有限公司;磷酸二氢钾:分析纯,上海恒信化学试剂有限公司。
种子培养基(g/L):葡萄糖 20,蛋白胨 20,酵母粉 10;调培养基pH为6.0。
发酵分批培养基(g/L):葡萄糖15,硫酸铵5,酵母粉2,磷酸二氢钾(KH2PO4)1.5,硫酸镁 0.25;调培养基pH为5.5.
1.2 仪器与设备
YM-50L型不锈钢立式电热蒸汽消毒器:上海三申医疗器械有限公司;SPX-150B生化培养箱:上海跃进医疗器械厂;LG10-2.4A型高速离心机:北京医用离心机厂;HS-840-U洁净工作台:苏州安泰空气技术有限公司;CARY-50型紫外分光光度计:American Varian Pty Ltd;自动发酵罐(KFT-5 L):Korea KoBio Tech Co.,Ltd.
1.3 试验方法
1.3.1 培养方法
斜面培养:在配制好的种子液体培养基中加入一定量琼脂粉,灭菌后制作斜面,待冷却至室温,无菌条件下,接种斜面并放置生化培养箱培养,为分批培养C.utilis合成GSH所用。
种子培养:无菌操作条件下,通过接种环取一环菌体接种至装有100 mL液体培养基的300 mL摇瓶中,放置摇床培养。
分批培养:全自动发酵罐KFT-5 L中装发酵培养基3.0 L,接种量10%。
1.3.2 分析方法
细胞质量浓度测定:取一定量发酵液,5 000 r/min离心15 min, 去上清液,65℃烘至恒质量。
葡萄糖测定:3,5-二硝基水杨酸法[12]。
胞内GSH提取及测定:取GSH培养液,5 000 r/min离心15 min,去上清液,40%乙醇抽提,离心得上清液用于GSH分析检测;GSH测定方法参照文献[13]。
氨基酸测定:C.utilis菌体胞内3种氨基酸(谷氨酸、甘氨酸及半胱氨酸)测定方法参照文献[14]。
2 结果与分析
2.1 C.utilis分批培养时胞内前体氨基酸合成动态
设置初始葡萄糖质量浓度为15 g/L,5 L发酵罐中考察C.utilis分批培养时菌体胞内谷氨酸、甘氨酸、半胱氨酸的动态变化。由图1可知,发酵到第10小时时葡萄糖已基本耗完,此时菌体量为10.6 g/L,而GSH继续合成,30 h达最大值150.6 mg/L。无论是在菌体生长阶段还是GSH合成阶段,胞内3种氨基酸含量均较低,当培养10 h葡萄糖被耗尽时,胞内3种氨基酸含量则急剧降低。与半胱氨酸和甘氨酸相比,谷氨酸质量浓度则相对较高,说明半胱氨酸和甘氨酸可能是GSH合成的关键限制因子。
2.2 C.utilis生长阶段优化前体氨基酸添加促进GSH合成
C.utilis分批培养时,在GSH合成阶段可通过外部添加半胱氨酸或3种混合氨基酸提高胞内GSH含量;而对于菌体生长阶段,菌体自身是否可以提供足够多的前体氨基酸用于GSH合成和细胞生长,却少有报道。为此,作者进一步探究C.utilis生长阶段(2~8 h)前体氨基酸添加对GSH合成的影响。
2.2.1 C.utilis生长阶段优化谷氨酸添加
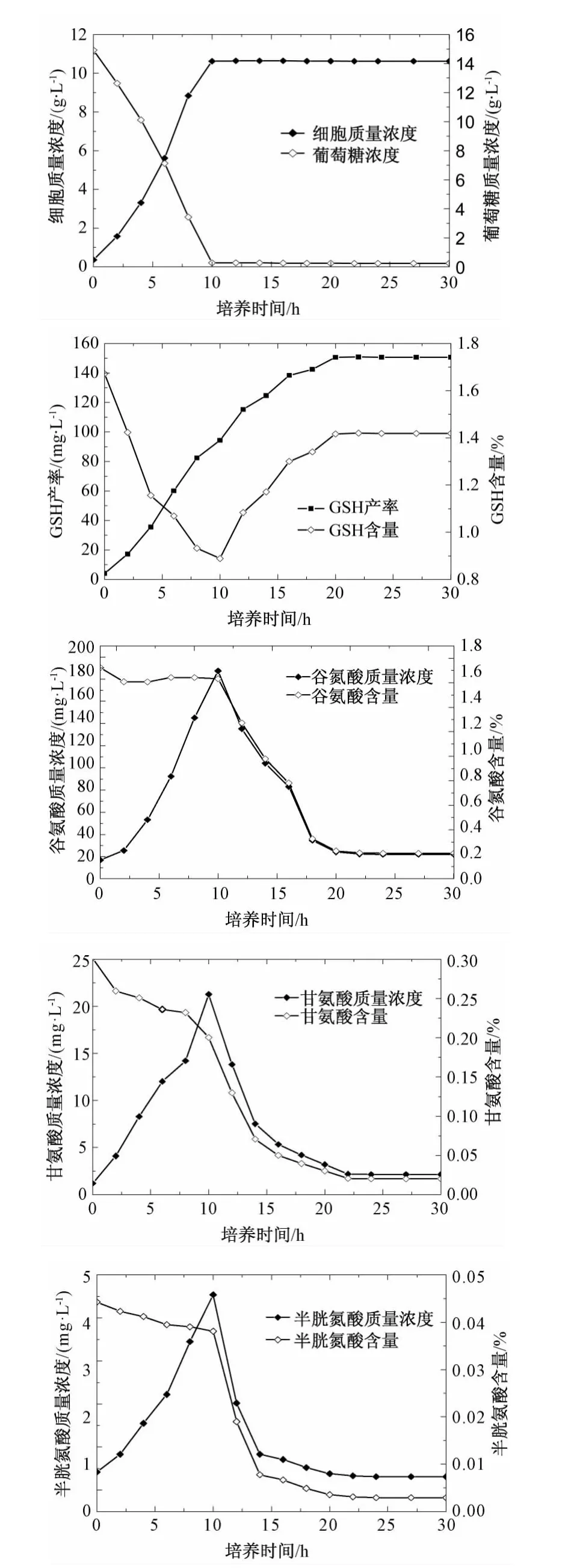
图1 C.utilis分批培养时细胞生长、GSH合成及胞内前体氨基酸变化Fig.1 Cell growth,GSH production and three precursor amino acids concentrations in 5 L fermentor batch culture
如表1所示,摇瓶条件下,不添加谷氨酸(对照),菌体停止生长时(第10小时),细胞质量浓度达9.46 g/L,此时GSH产率为93.2 mg/L;随着谷氨酸添加时间延迟,细胞质量浓度和GSH产率均相应下降;添加浓度低于4 mmol/L可促进细胞生长和GSH合成。第2小时添加4 mmol/L谷氨酸,培养至第10小时时,细胞质量浓度和GSH产率分别达最大值10.06 g/L和104.3 mg/L,分别比对照提高了6.3%和11.8%。上述结果表明,菌体生长阶段谷氨酸对GSH合成影响不显著,说明C.utilis菌体可通过胞内自身代谢合成大量谷氨酸(Glu)[15]。
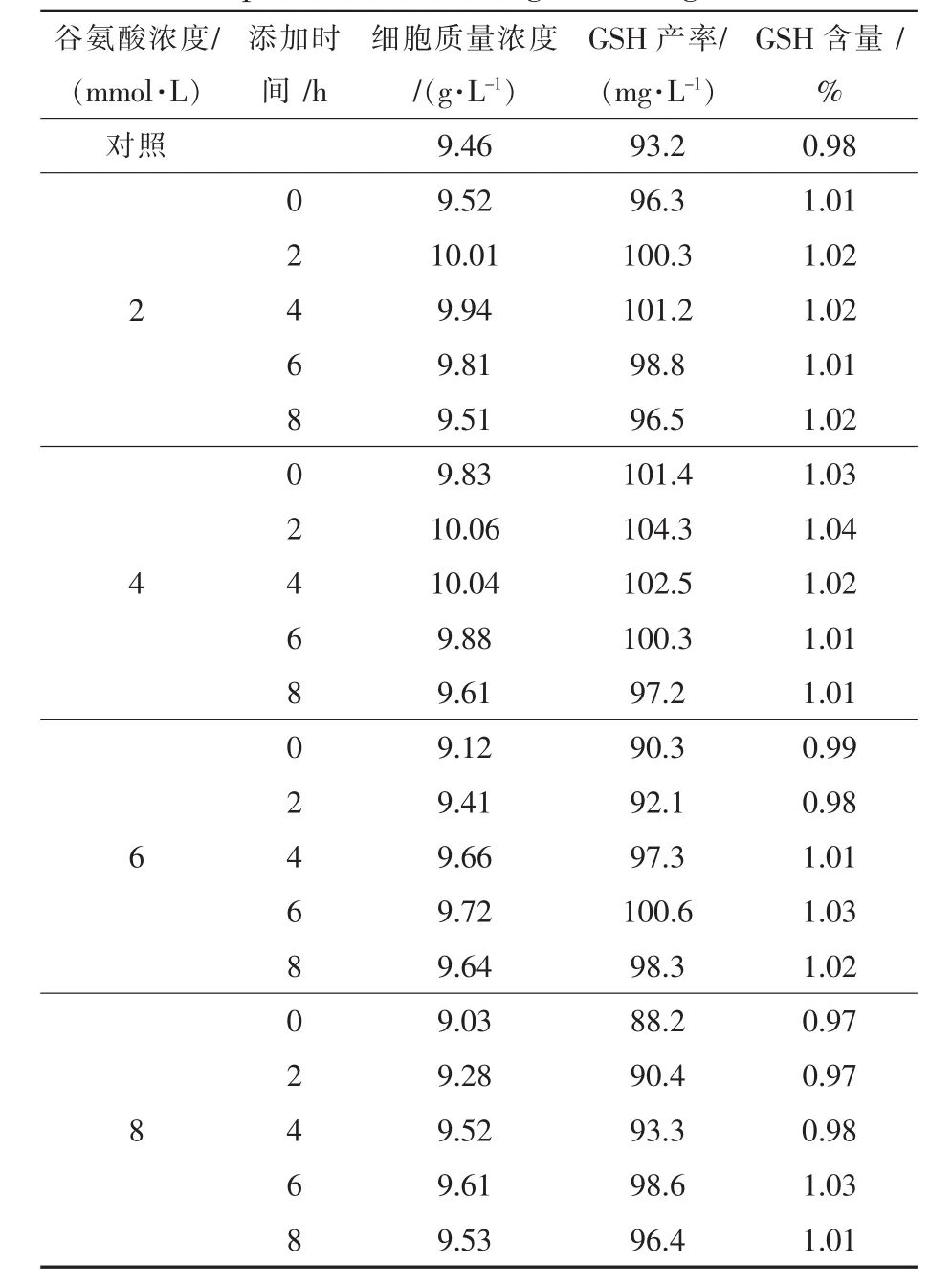
表1 C.utilis生长阶段谷氨酸添加对GSH合成的影响Table 1 Effect of glutamic acid addition on GSH production at cell growth stage
2.2.2 C.utilis生长阶段优化甘氨酸添加
由表2可知,C.utilis细胞生长阶段(2~8 h),通过外部添加甘氨酸浓度低于6 mmol/L时,随着添加时间提前,促进细胞生长和GSH合成效果愈加显著;添加浓度为8 mmol/L时,C.utilis生长和GSH合成均受到抑制而导致菌体量和GSH产率下降。研究结果表明,菌体生长阶段甘氨酸最佳添加时间和浓度为:第2小时添加6 mmol/L甘氨酸,培养至第10小时,菌体量和GSH产率分别为10.41 g/L和125.0 mg/L,分别比对照提高10.1%和34.1%。
由于酵母胞内甘氨酸合成不仅步骤多而且需在很多酶的催化下才能形成,导致其含量相对较低[16]。通过外部添加甘氨酸,一方面可直接促进GSH合成,另一方面胞内自身代谢产生的丝氨酸则不需要转化成甘氨酸而用于其他物质合成。

表2 C.utilis生长阶段甘氨酸添加对GSH合成的影响Table 2 Effect of glycine addition on GSH production at cell growth stage
2.2.3 C.utilis生长阶段优化半胱氨酸添加
发酵法合成GSH时,其分子中巯基由半胱氨酸提供,胞内半胱氨酸含量较低,可通过外部添加促进GSH合成[17]。由于半胱氨酸极易氧化,因而通过控制溶解氧水平提高其利用效率[18]。由表3可知,半胱氨酸显著抑制菌体生长,抑制程度与添加浓度成正比,与添加时间成反比。上述结果表明,菌体生长阶段通过外部添加半胱氨酸(Cys)能显著提高C.utilis细胞GSH合成能力,但同时细胞菌体生长受到抑制,最终导致GSH总产率下降。
2.3 响应面(Central-Composite)优化混合氨基酸添加浓度和比例
响应面分析常用于目标产品合成过程中多因素水平优化及影响显著性预测[19-20]。为此,在C.utilis分批培养的GSH合成阶段,通过Central-Composite优化3种混合氨基酸添加量及配比。

表3 C.utilis生长阶段半胱氨酸添加对GSH合成的影响Table 3 Effect of cysteine addition on GSH production at cell growth stage
选择谷氨酸、半胱氨酸与甘氨酸为3个因素,以GSH产量为响应值,Central-Composite优化GSH合成的氨基酸添加。
Central-Composite设计基于二阶数学模型:

式中:Y 为响应值(GSH 产率);茁0为常数项;茁i、茁ij、茁ii为回归系数;Xi、Xj为编码后的变量(谷氨酸、半胱氨酸和甘氨酸)。
为了将合成GSH前体氨基酸有效转化为目标产物GSH,3种氨基酸添加浓度范围设定在2~10 mmol/L(表 4)。
2.3.1 GSH合成模型方程建立
由表5可知,摇瓶试验条件下,GSH产率最大值和最小值分别为273.5 mg/L和231.1 mg/L。
表6结果显示,甘氨酸和半胱氨酸显著影响GSH合成 (P<0.05),而谷氨酸则不明显。

表4 试验变量编码和水平Table 4 Codes and levels of variables
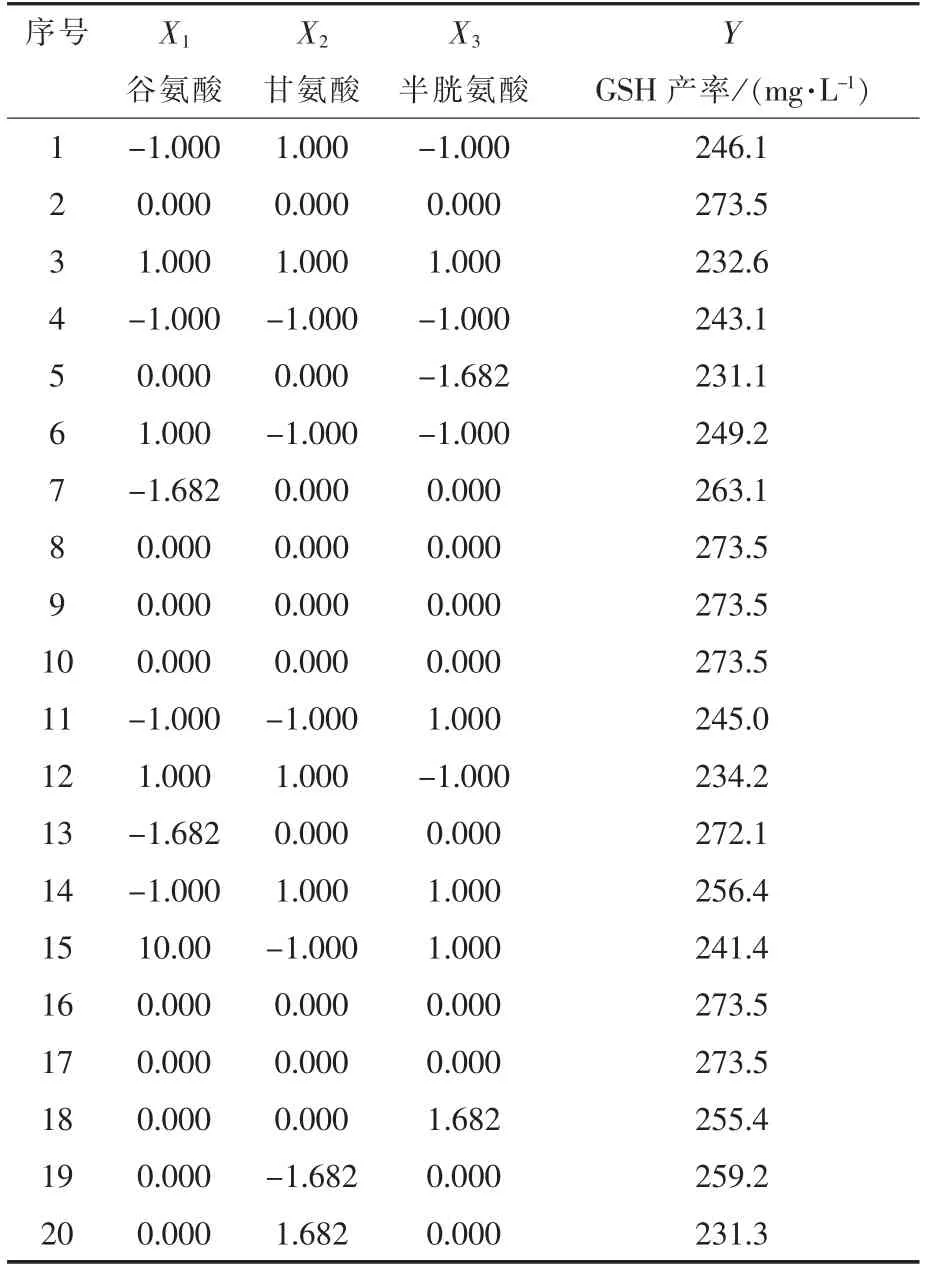
表5 Central-Composite试验设计合成GSHTable 5 GSH production with central-composite experiments design
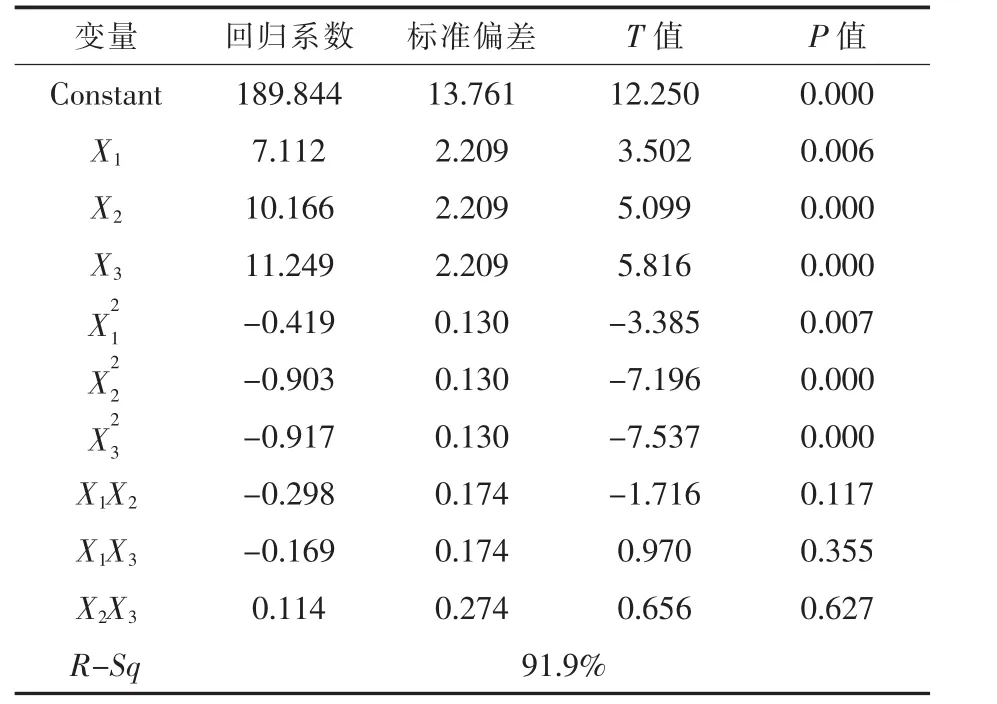
表6 Central-Composite优化GSH合成回归方程系数及其显著性检验Table 6 Regression coefficients and significances test for GSH production optimized by centralcomposite design
Y=189.844+7.112X1+10.166X2+11.249X3-式中:Y 代表 GSH 产率(mg/L);X1、X2和 X3代表谷氨酸、甘氨酸和半胱氨酸添加浓度,mmol/L。
2.3.2 C.utilis分批培养时前体氨基酸对GSH合成影响的交互作用
图2(a-c)为3种前体氨基酸交互影响GSH合成响应图。与谷氨酸相比,甘氨酸和半胱氨酸对GSH合成影响显著,此外,甘氨酸还显著促进菌体生长。

图2 前体氨基酸添加交互作用对GSH合成的响应曲面Fig.2 Response surface plot of effect of interaction of three precursor amino acids addition on GSH production
2.3.3 C.utilis分批培养时前体氨基酸对GSH合成交互作用分析
回归方程取一阶偏导等于0,得到混合氨基酸添加最佳浓度与比例:谷氨酸 6 mmol/L、甘氨酸5.5 mmol/L、半胱氨酸 6.5 mmol/L,在此条件下,理论GSH产率可达278.3 mg/L。摇瓶实验表明,在此条件下,实际GSH产率为277.9 mg/L,实验值与模型预测值高度统一。
2.4 C.utilis分批培养时两阶段氨基酸添加策略优化GSH合成和菌体生长
如图3所示,摇瓶实验条件下,不添加氨基酸,经过10 h培养,葡萄糖耗尽(第10小时)时细胞停止生长,此时细胞质量浓度达最大值9.46 g/L,GSH产量为 93.2 mg/L,且30 h后GSH终产量达最大值128.4 mg/L;当2 h添加6 mmol/L甘氨酸,到第10小时时,细胞质量浓度和GSH产率分别为10.41 g/L和125.2 mg/L;通过两阶段氨基酸添加策略,菌体培养30 h后,GSH产率达278 mg/L,胞内GSH含量为2.61%。
由于摇瓶实验不能有效控制培养液pH变化,因而进一步在5 L罐上考察C.utilis分批培养时两阶段氨基酸添加优化策略。如图4所示,未加氨基酸,菌体培养10 h后,细胞质量浓度为10.6 g/L,GSH产率为 104.3 mg/L,且30 h后GSH产率达最大值150.6 mg/L;当2 h添加6 mmol/L甘氨酸,细胞质量浓度和GSH产量在第10小时分别为12.81 g/L和150.3 mg/L;通过两阶段氨基酸添加策略,菌体培养 30 h后,GSH产率达328 mg/L,GSH胞内含量为2.56%。

图3 C.utilis分批培养时两阶段氨基酸添加策略促进GSH合成和菌体生长Fig.3 Enhanced GSH production and cell growth with two-stage amino acids addition strategy in batch culture
3 结论

图4 发酵罐条件下两阶段氨基酸添加策略促GSH合成和菌体生长Fig.4 Enhance GSH production and cell growth with two-stage amino acids addition strategy in 5 L fermentor
与谷氨酸相比而言,C.utilis分批培养时胞内甘氨酸和半胱氨酸含量相对较低;培养第2小时添加6 mmol/L甘氨酸可显著促进GSH合成和菌体生长;GSH合成阶段(10 h)添加3种混合氨基酸最佳配比为:谷氨酸 6 mmol/L、甘氨酸 5.5 mmol/L和半胱氨酸 6.5 mmol/L;为此,作者得出菌体生长阶段(2 h)添加甘氨酸及GSH合成阶段(10 h)添加混合氨基酸的两阶段氨基酸优化策略。摇瓶条件下,培养30 h后,细胞质量浓度和GSH产率达到 10.41 g/L和278 mg/L,5 L发酵罐中分别为12.81 g/L和328 mg/L。本研究提出的两阶段氨基酸优化策略为发酵法生产GSH提供了一种全新思路。
[1] LI Y,WEI G Y,CHEN J.Ghtathione:a review on biotechnological production[J].Applied Microbiology Biotechnology,2004,66(3):233-242.
[2] PENNINCKY M J.An overview on glutathione in Saccharomyces versus non-conventional yeasts[J].FEMS Yeast Research,2002,2:295-305.
[3] 郑丽雪,王斌,朱娉,等.利用低pH处理促进酿酒酵母2-10515生产谷胱甘肽[J].生物工程,2014,35(21):116-118.
[4] 万红贵,邓春亚,谭海涛,等.两类外源刺激对啤酒废酵母发酵产谷胱甘肽的影响[J].食品与发酵工业,2015,41(1):7-10.
[5] 潘亚磊,贺小贤,陈珊.补料分批发酵生产谷胱甘肽的研究[J].生物工程,2010,31(1):177-180.
[6] 王玉磊,卫功元,邵娜,等.基于能量代谢分析的S-腺苷蛋氨酸和谷胱甘肽联合高产方法[J].化工学报,2012,63(1):223-229.
[7] 方聪明,刘联杰,周安,等.基于酶活性调节的酿酒酵母谷胱甘肽发酵调控研究[J].中国酿造,2014,33(6):79-83.
[8] WADA M,TAKAGI H.Metabolic pathways and biotechnological production of l-cysteine[J]. Applied Microbiology Biotechnology,2006,73:48-54.
[9] WEN S H,ZHANG T,TAN T W.Utilization of amino acids to enhance glutathione production in Saccharomyces cerevisiae[J].Enzyme Microbial Technology,2004,35:501-507.
[10] WEN S H,ZHANG T,TAN T W.Optimization of the amino acid composition in glutathione fermentation[J].Process Biochemistry,2005,40:3474-3479.
[11] 尹良鸿,吴晓玉,廖鲜艳,等.产朊假丝酵母发酵生产谷胱甘肽的氨基酸添加策略[J].过程工程学报,2008,8(2):333-338.
[12] 北京大学生物系生物化学教研室.生物化学实验指导[M].北京:高等教育出版社,1984:22-24.
[13] TIETZE F.Enzymic method for quantitative determination of nanogram amounts of total and oxidized glutathione:application to mammalian blood and other tissues[J].Analytical Biochemistry,1969,27:502-522.
[14] 王一红,冯家力,潘振球,等.液相色谱-质谱/质谱联用技术分析18种游离氨基酸[J].中国卫生检验杂志,2016,16(2):161-163.
[15] YOKOTA A,LINDLEY N D.Central metabolism:sugar uptake and conversion[C]//Eggeling L,Bott M.Handbook of corynebacterium glutamicum.Boca Raton,FL:CRC Press, 2005:215-240.
[16] HAN L,DOVERSKOG M,ENFORS S O,et al.Effect of glycine on the cell yield and growth rate of Escherichia coli:evidence for cell-density-dependent glycine degradation as determined by13C NMR spectroscopy [J].Journal of Biotechnology,2002,92:237-249.
[17] LIANG G B,DU G C,CHEN J.A novel strategy of enhanced glutathione production in high cell density cultivation of Candida utilis-Cysteine addition combined with dissolved oxygen controlling[J].Enzyme and Microbial Technology,2008,42:284-289.
[18] 梁国斌,堵国成,陈坚.半胱氨酸添加与溶氧控制及pH胁迫相结合促进产朊假丝酵母合成谷胱甘肽[J].过程工程学报,2009,9(4):786-790.
[19] 熊科,熊苏玥,支慧伟,等.一株降解赭曲霉素A的新颖米曲霉菌株筛选鉴定及其产酶优化[J].河南工业大学学报(自然科学版),2017,38(2):80-87.
[20] 汪芳芳,孙建宏,叶建斌,等.静息细胞降解叶黄素生产香味物质的条件优化[J].河南工业大学学报(自然科学版),2017,38(1):94-100.
ENHANCED GLUTATHIONE PRODUCTION BY OPTIMIZING PRESURSOR AMINO ACIDS ADDITION IN BATCH CULTURE CANDIDA UTILIS
LIANG Guobin,LIN Wei,WANG Bin,ZHU Hua,HE Qinting,ZHOU Quanfa
(School of Chemistry and Environmental Engineering,Jiangsu University of Technology,Changzhou 213001,China)
Glutathione(GSH) has the ability of antioxidant,immune function regulation,promoting carbohydrates,fat and protein metabolism in life activities,and is widely used in medicine,health care,skin care,beauty,food additives and other industries. Glutathione (GSH) production was optimized by precursor amino acids addition in batch cultivation of Candida utilis in the study. Initially,the dynamic changes of glutamic acid,glycine and cysteine in batch culture process were analyzed. Then,the effect of addition times and amounts of the three precursor amino acids on cell concentration and GSH production at bacterial growth stage was investigated.Finally, the two-stage addition optimization strategy of adding glycine at cell growth stage and mixed three kinds of amino acids at GSH production stage was developed. The results showed that glycine (6 mmol/L) was added at 2 h of C.utilis culture,stage and the mixed amino acids (glutamic acid of 6 mmol/L; glycine of 5.5 mmol/L;cysteine glycine of 6.5 mmol/L) were added at 10 h. After C.utilis culturing for 30 h, the cell dry weight and the yield of GSH was 10.41 g/L and 278 mg/L, respectively, which increased by 10.5% and 116% compared with control without amino acids addition. When the obtained two-stage amino acid addition strategy was applied in 5 L fermentor cultivation, the cell concentration was reached to 12.81 g/L and the yield of GSH was 328 mg/L after fermentation, which indicating the feasibility of adopted strategy.
Candida utilis;glutathione(GSH); amino acids;response surface methodology
TS201.2
B
1673-2383(2017)06-0062-07
http://kns.cnki.net/kcms/detail/41.1378.N.20171226.1723.022.html
网络出版时间:2017-12-26 17:24:10
2017-06-16
国家自然科学基金项目(21502074);江苏省产学研前瞻联合性研究项目(BY2015028-04)
梁国斌(1975—),男,陕西安康人,博士,副教授,硕士生导师,研究方向为微生物工程、酶工程。

