超声和酶处理对乳化猪油体外消化特性的影响
许笑男,刘元法,李进伟,蒋 将*
(江南大学食品学院,江苏 无锡 214122)
超声和酶处理对乳化猪油体外消化特性的影响
许笑男,刘元法,李进伟,蒋 将*
(江南大学食品学院,江苏 无锡 214122)
本研究以猪油为原料,超声诱导脂肪晶体发生重排,采用谷氨酰胺转氨酶(transglutaminase,TG)交联浓缩乳清蛋白作为乳化剂,制备改性乳化猪油,进而探讨乳化猪油未吸附蛋白含量的变化,并在体外消化模型中以平均粒径、Zeta电位、游离脂肪酸释放量以及脂肪颗粒微观结构作为评价指标,对改性乳化猪油体外消化特性进行研究。结果表明,超声和TG处理分别对乳化猪油产生不同的作用,超声处理后乳化猪油未吸附蛋白含量低于未处理样品,乳化稳定性降低,而TG处理则提高了乳化猪油的乳化稳定性。超声处理后的乳化猪油在体外消化过程中的游离脂肪酸的释放量、平均粒径显著高于未处理样品(P<0.05),Zeta电位明显低于未处理样品。而TG交联浓缩乳清蛋白促使乳化猪油颗粒更加细小,在体外消化过程中游离脂肪酸的释放量显著降低(P<0.05)。超声处理的乳化猪油更易于消化,TG处理则减缓了乳化猪油的消化速率。
乳化猪油;超声;谷氨酰胺转氨酶;体外消化
由于消费者对食品的品质要求越来越高,并且脂肪的结晶结构在整个产品品质中都起到非常重要的作用[1],故近些年研究者们对原料油及其乳化液进行了结晶特性的探索。例如猪油及乳化猪油,有研究发现猪油与乳化猪油的晶体晶型和大小虽然未发生明显变化[2-3],但猪油作为起酥油,却存在晶体颗粒粗大的缺点,影响其制品的品质。
食物通过消化道时其化学成分和结构可能会发生变化,但油在食品中的最初形态对其消化分解有一定的影响,因此,其在食物中的存在形式会影响油的生物利用度[4-5]。目前,关于超声技术改善油脂结晶形态和结晶颗粒大小的研究较多,但对经超声处理的油及乳化液在消化过程中的特性变化的研究比较少。关于谷氨酰胺转氨酶(transglutaminase,TG)交联乳蛋白后改善蛋白性质的研究较多,但鲜见对交联后乳清蛋白和酪蛋白在消化过程特性变化的研究。
超声作为一种被广泛应用的技术应用于制备乳化液,对乳化液起着促进乳化或破坏乳化的作用[6]。除此之外,在有关超声对油的影响中发现,超声能改变脂肪的结晶,如Frydenberg[7]、Martini[8]和Ueno[9]等在对脱水乳脂肪进行高强度超声后,研究其对脱水乳脂肪结晶结构的影响时,发现超声会促进脂肪球形颗粒的形成以及使颗粒具有更高的粒径均一性。在可可脂和纯油体系中,高强度的超声在改变超声频率和时间的情况下,能够控制晶体晶型的形成。
蛋白质作为一种乳化剂不仅能提高乳化液的稳定性,还能延缓油脂氧化,延长油脂食品的货架期。但是对于低油脂含量(油脂含量不超过50%)乳化液,蛋白质的加入仍无法大幅增加乳化液的黏度,导致其在食品中的应用较少。因此采用添加TG,通过其与蛋白质交联增加乳化液之间的黏度,从而扩大低油脂含量乳化液的应用范围。TG是一种可有效改善食品蛋白质凝胶性能的新型酶制剂,被誉为“21世纪超级黏合剂”。它通过催化蛋白质分子间或蛋白质分子内形成ε-(γ-谷氨酰基)赖氨酸共价键产生分子间的交联,生成超大网络状蛋白质分子,从而提高蛋白质的乳化性、热稳定性、水溶性和起泡性,进而改善食品中蛋白质的质构、外观和风味[10-11],TG在医药、纺织、化妆品、食品等领域具有重要的应用价值。
为解决乳化猪油结晶颗粒粗大的问题,以及更深入地了解改性后的乳化猪油对人体的影响,本研究以猪油作为主要原料,采用超声和酶处理手段制备乳化猪油,并在体外消化模型中以粒径、Zeta电位、游离脂肪酸释放量以及脂肪颗粒微观结构作为评价指标,对改性的乳化猪油体外消化特性进行深入研究。
1 材料与方法
1.1 材料与试剂
猪背部肥膘肉购买于无锡天鹏市场。
浓缩乳清蛋白(whey protein concentrate,WPC)美国Hilmar公司;酪蛋白、胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶、胰脂肪酶 北京百灵威科技有限公司;谷氨酰胺转氨酶 江苏一鸣生物制品有限公司;猪胆盐国药集团化学试剂有限公司。
1.2 仪器与设备
pH计 梅特勒-托利多仪器(上海)有限公司;T18高速搅拌机 德国IKA公司;JJ-1B强力恒速电动搅拌器 金坛市金南仪器厂;HH-2数显型恒温水浴锅金坛市精达仪器制造有限公司;高压均质机 日本ATS公司;Zetasizer nano ZS Zeta电位仪 英国马尔文公司;LSM710激光共聚焦显微镜 德国Zeiss公司。
1.3 方法
1.3.1 猪油的提取
参照Wang Qingling等[12]的水酶法提取猪油。
1.3.2 乳化猪油的制备
按照表1的配方制备乳化猪油,在70 ℃条件下搅拌30 min后,高速剪切,然后30 MPa均质3 次,得到稳定的乳化液,并且乳化猪油全是现配现用。
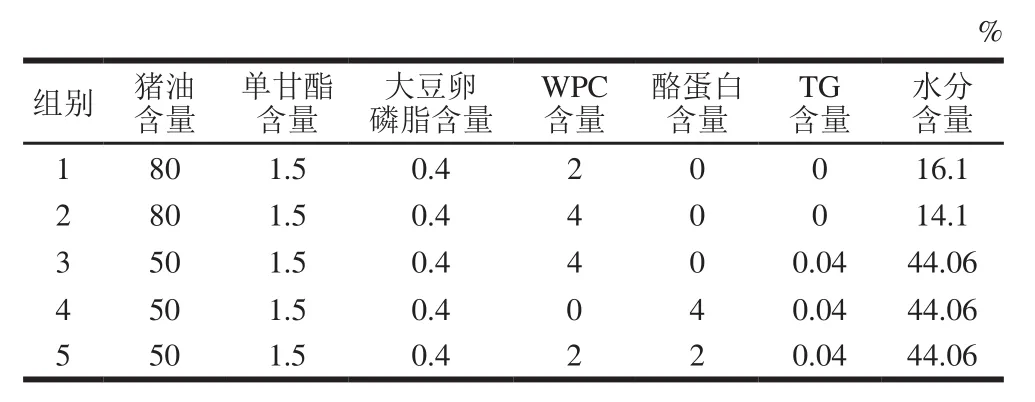
表1 乳化猪油的制备配方Table 1 Formulations of emulsif i ed lard
其中WPC、酪蛋白与TG的混合方法为:将TG与蛋白以质量比1∶100的比例混合后,在40 ℃条件下调节pH值至7.0左右,搅拌60~120 min。
1.3.3 超声处理乳化猪油
将乳化猪油放置在细胞粉碎机中,超声探头深入到样品中,475 W频率下超声处理0(未超声)、5 min,脉冲条件为超声5 s,静止5 s。
1.3.4 体外消化实验
按照Minekus等[13]的方法制备消化液并对乳化猪油进行消化处理。模拟胃液:各物质终浓度分别为6.9 mmol/L KCl、0.9 mmol/L KH2PO4、25 mmol/L NaHCO3、47.2 mmol/L NaCl、0.1 mmol/L MgCl2•6H2O、0.5 mmol/L(NH4)2CO3,稀HCl溶液调节至pH 2.0。模拟肠液:各物质终浓度为6.8 mmol/L KCl、0.8 mmol/L KH2PO、84 mmol/L NaHCO3、38.4 mmol/L NaCl、0.33 mmol/L MgCl2•6H2O,稀NaOH溶液调节至pH 7.0。将制备好的1~5 组乳化猪油分别取10 mL,置于37 ℃的恒温水浴锅中,各组乳化猪油中分别加入7.5 mL模拟胃液,1.6 mL猪胰蛋白酶溶液(25 000 μg/mL),最后用HCl溶液(1 mol/L)调节pH值达到2.0,模拟胃液消化2 h,期间持续搅拌(95 r/min)。取20 mL在37 ℃恒温水浴振荡2 h的乳化猪油,往其中加入11 mL模拟肠液后,继续放置在37 ℃恒温水浴锅中,之后在再加入0.5 mL的胰脂肪酶溶液、胰牛凝乳蛋白酶溶液(800 μg/mL)、2.5 mL的胆盐(160 mmol/L)混合均匀后,用NaOH溶液(1 mol/L)调节pH值达到7.0,消化2 h,期间持续搅拌(95 r/min)。
1.3.5 未吸附蛋白含量和界面蛋白含量的测定
取一定量乳化液15 000×g离心45 min,取下层乳清液再次以相同转速离心30 min,用针管小心吸取下层清液,过0.22 μm滤膜后用Lowry法[14]测定吸附蛋白含量。按式(1)计算未吸附蛋白含量。

式中:Wt为蛋白的总含量/(m g/m L);Ws为吸附蛋白含量/(mg/mL);Ww为未吸附蛋白含量/(mg/mL)(即水相中的蛋白含量)。
1.3.6 游离脂肪酸释放量的测定
乳化猪油消化结束后,用0.01 mol/L的NaOH溶液滴定中和释放出的游离脂肪酸,再加入胰脂肪酶后,分别在0、120 min取样,按式(2)计算游离脂肪酸的释放量,3 次平行取平均值。
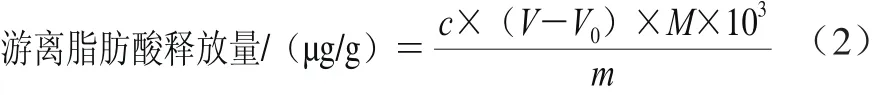
式中:c为NaOH溶液的浓度(0.01 mol/L);V、V0分别为120、0 min时消耗的NaOH溶液体积/mL;M为NaOH的摩尔分子质量(40 g/mol);m为猪油的质量/g。
1.3.7 粒径的测定
水解前以及水解过程中乳化猪油平均粒径和粒度分布的测定采用基于静态光散射的激光粒径仪。取一定量的乳化猪油用磷酸盐缓冲液稀释1 000 倍后进行测定,以避免多重散射效应的影响[15]。
1.3.8 表面Zeta电位的测定
根据电场中粒子的运动方向和速率确定乳化液中脂肪颗粒的Zeta电位[16]。取出一定量的乳化液用磷酸盐缓冲液稀释1 000 倍,用Zetasizer nano ZS Zeta电位仪测定乳化液中脂肪颗粒的表面Zeta电位,设定温度20 ℃,至少读取10 个点,计算平均值。
1.3.9 微观结构观察
将1~5组乳化猪油以及消化后的乳化猪油稀释10 倍,取1 mL稀释后的乳化液,分别加入30 μL的异硫氰酸荧光素(fluoresceinisothiocyanate,FITC)和尼罗红染色液,漩涡振荡混匀后避光染色20 min,取一滴染色后的乳化液于载玻片上,再用硅油密封盖玻片的边缘。其中尼罗红的激发波长为514 nm,FITC的激发波长为488 nm[17]。
1.4 数据统计分析
结果取3 次平行实验的平均值,以 ±s表示。数据由Origin 8.0和Sigmaplot 12.5软件处理,显著性分析使用SPSS 20.0软件的Duncan法。
2 结果与分析
2.1 乳化猪油的蛋白含量
在两性物质(例如蛋白)的水溶液与油混合、均质成稳定的乳化液后,在脂肪的表面会快速形成一层保护膜,这个保护膜可以根据表面活性剂的吸附量来降低油-水界面的界面张力,增加脂肪的密度。蛋白质作为一种表面活性剂,其在乳化液中的含量是影响乳化液稳定性的重要指标,也是影响肠道消化脂肪的重要因素。
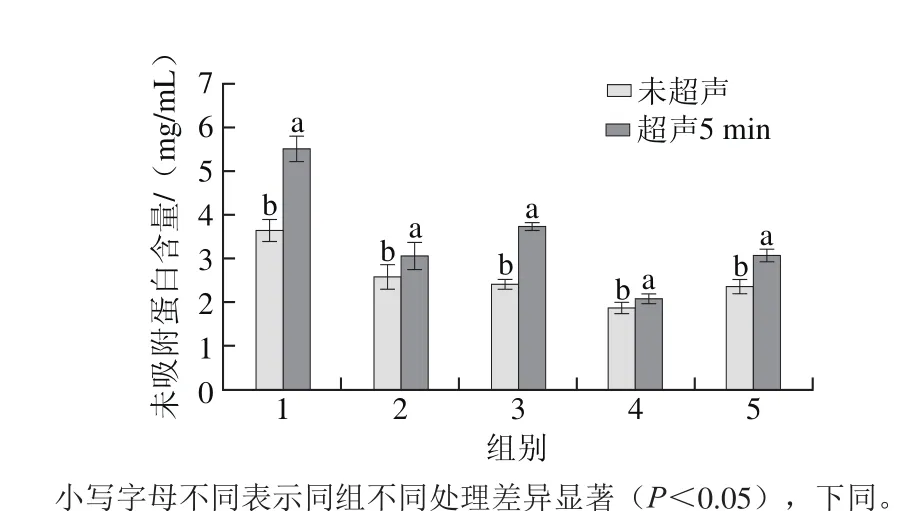
图1 乳化猪油的未吸附蛋白含量Fig. 1 Unadsorbed protein concentration of emulsif i ed lard
从图1可以看出,超声处理5 min的乳化猪油中未吸附蛋白含量显著高于未超声处理(P<0.05),这是由于乳化猪油经过超声处理后,空穴作用使蛋白质构象展开,暴露更多的亲水部位,从而增加了与水分子的结合[18],导致超声处理后乳化猪油界面吸附量要比未超声处理的小。其中1、2组相比,未吸附蛋白含量降低,即用于乳化液中的有效蛋白减少,乳化稳定性降低,即油滴上结合的蛋白也相应减少了。在3、4、5组中,由于酪蛋白的分子质量比WPC大,其乳化性在一定程度上优于WPC,因此可以看出,酪蛋白制备乳化猪油中的未吸附蛋白含量最低,WPC最高。而从不同猪油含量的乳化猪油未吸附蛋白含量来看,3、4、5组的未吸附蛋白含量明显低于1、2组,这是因为TG能交联蛋白质从而提高其乳化性[19]。由图1可以得出,乳化猪油的液滴越小,则具有更大的表面积,从而使得蛋白质在油-水界面具有更大的界面分布。
2.2 乳化猪油在体外消化过程中的游离脂肪酸释放量
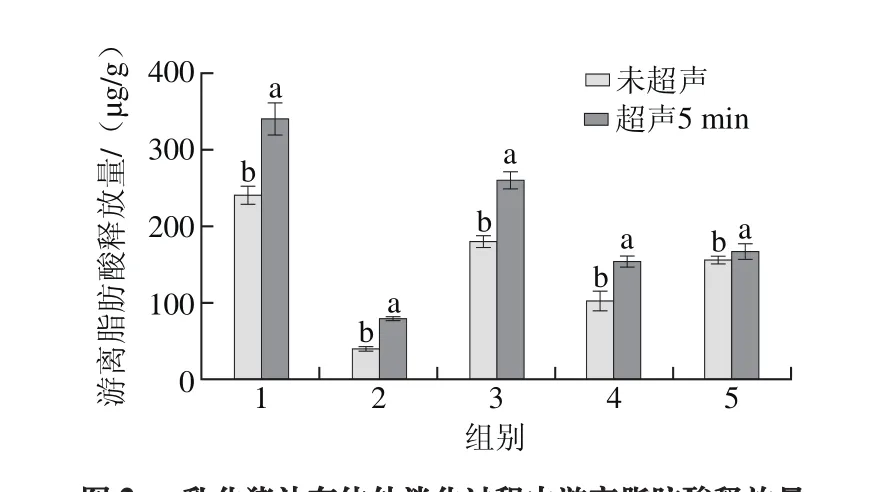
图2 乳化猪油在体外消化过程中游离脂肪酸释放量Fig. 2 Release of FFA from emulsif i ed lard during in vitro digestion
TG在消化过程中,会分解释放出脂肪酸和单甘脂,测定各个样品在消化过程中不同时刻的游离脂肪酸释放量,可以直观地反映各种样品在消化过程中的消化速率[20]。测量模拟肠消化2 h后的游离脂肪酸释放量结果如图2所示。模拟肠消化2 h后的乳化猪油未完全被水解,不同的乳化猪油释放游离脂肪酸的程度不同。经过超声处理的乳化猪油游离脂肪酸显著高于未超声处理(P<0.05),是因为超声处理破坏了蛋白的结构,从而使胰脂肪酶更容易接近油滴,释放出更多的游离的脂肪酸,加快了消化速率。2组(4% WPC)的游离脂肪酸释放量明显低于1组(2% WPC),这是因为蛋白含量高,与油滴接触的蛋白就更多,致使消化受到了阻碍。在3、4、5组中WPC制备的乳化猪油的消化速率远高于酪蛋白以及二者混合物制备的乳化猪油,这是由于酪蛋白的乳化性能要强于WPC,从而包裹油滴的蛋白增多,抑制消化进程。而油含量80%的乳化猪油消化速率高于油含量50%的样品,一方面原因是油含量明显的差异,另一方面是TG对乳化猪油的消化有明显的影响。TG在油滴之间形成了一层很厚的保护膜,从而抑制了脂肪酶与油滴的接触。根据未吸附蛋白含量(图1)推论膜厚度[21],说明膜的厚度不会阻止脂肪的消化,但对其有一定的缓释效果。
2.3 乳化猪油在消化过程中粒径的变化
乳化液食物在被人体摄入后,消化吸收过程主要经过3 个部位:口腔、胃、肠,然而随着乳化液在消化通道中停留时间的不同,其性质(例如流变学性质、离子条件、pH值、微观结构、尺寸、形状,化学组成等)都会发生变化。
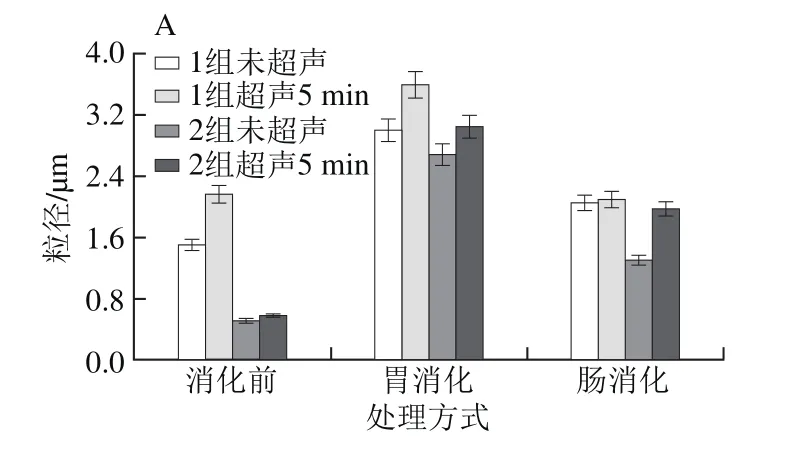
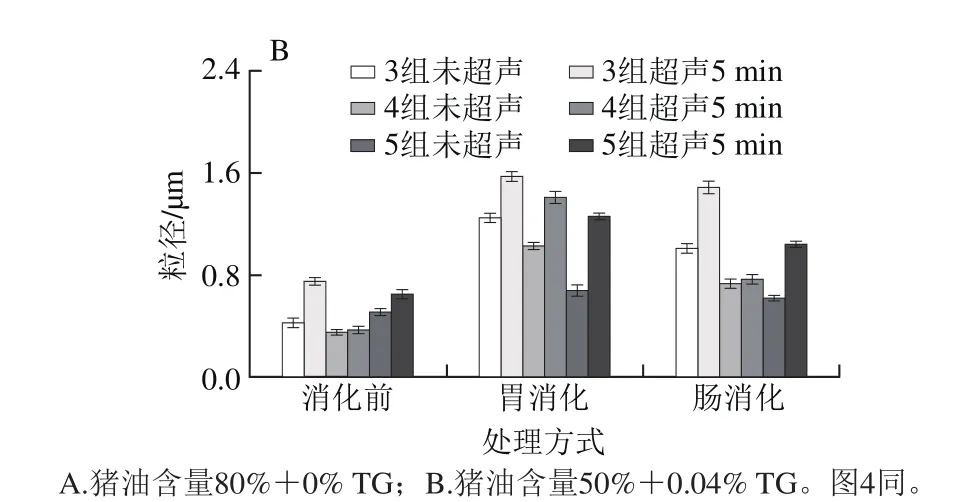
图3 乳化猪油在体外消化过程中粒径的变化Fig. 3 Change in droplet size of emulsif i ed lard during in vitro digestion
从图3可以看出,经超声处理的乳化猪油均比未超声处理的粒径大,这主要是因为超声降低了界面蛋白的含量,乳化性降低,界面膜变薄。1、2组的粒径大于3、4、5组,是因为界面蛋白含量降低使其形成颗粒较大。2组(4% WPC)乳化猪油在整个消化过程中粒径低于1组(2% WPC),这也是由于界面蛋白的含量不同而引起的。3、4、5组中蛋白为酪蛋白的乳化猪油粒径要小于蛋白为WPC的,这是由于酪蛋白乳化性能强于WPC。在模拟胃消化(pH 2)过程中,由于添加胃蛋白酶破坏了蛋白质的完整结构,降低其乳化性,各乳化猪油的粒径大小相较于未消化时均增大。脂肪在胃消化过程消化量很小,其消化作用主要是在小肠[22-23],当经过胃消化的乳化猪油进入肠道后,由于胰脂肪酶的存在对脂肪进行了消化水解(pH 7),肠消化后的乳化猪油粒径与胃消化相比均有所降低(图3),这可能是因为胆盐的存在使得被消化的乳化猪油分子进行再次乳化,从而使分子粒径变小。
2.4 乳化猪油在体外消化过程中Zeta电位的变化

图4 乳化猪油在体外消化过程中Zeta电位的变化Fig. 4 Change in zeta-potential of emulsif i ed lard during in vitro digestion
在体外消化过程中测定乳化液的Zeta电位能够直观地反映界面组成的变化。由图4可知,WPC制备的乳化猪油未消化前的Zeta电位约为-30~-40 mV,这是因为维持油滴稳定的WPC在中性条件下是带负电的(pI=5)[24]。在乳化液界面组成没有发生变化的情况下,在胃消化中pH值低于蛋白的等电点因而带正电[25-26]。当乳化猪油在进行胃消化(pH 2)时发现其电负性相较于消化前变小,这是因为WPC和酪蛋白带上正电,然而这个变化一部分归因于消化环境的变化(如离子强度、pH值),一部分是由于表面活性剂的竞争性替换,或者原始表面活性剂间的吸附。由图4可知,在模拟胃消化过程中,超声处理后乳化猪油的Zeta电位比未超声处理的高,这是由于超声破坏了乳化猪油的稳定结构,使得胃蛋白酶更容易破坏了覆盖在油滴上的蛋白质的结构,从而使其发生了竞争性替换[27-28],然而在3、4、5组中,模拟胃消化的Zeta电位与未消化相比相差不大,可能是因为TG对蛋白进行交联处理后,乳化猪油的保护膜变厚则抵抗消化的能力增强,其中3组Zeta电位大于4组,可能是因为WPC不易被移动。当乳化猪油由胃到肠消化后,乳化猪油的Zeta电位均明显增加(图4),这是因为模拟肠液中的胆汁盐和脂肪酶替代WPC和酪蛋白吸附在油滴上,然而在3、4、5组中WPC的电负性最小是因为该蛋白不易被移动。
2.5 模拟消化对乳化猪油微观结构的影响



图5 乳化猪油在体外消化过程中微观结构的变化Fig. 5 Change in microstructure of emulsif i ed lard during in vitro digestion
乳化猪油在消化前后的微观形状由图5可知,消化前的乳化猪油液滴的颗粒细小并呈现均匀分散。然而经过含有胃蛋白酶的体外胃消化后出现了大量的液滴聚集体,此时超声处理与未超声处理相比其聚集体间距更大。但在3、4、5组中TG的加入反而减少了聚集体的产生,除了与油含量的多少有关外,还与TG的强交联性有关。
在模拟胃液中,由于pH值远低于WPC、酪蛋白和TG的等电点,所以蛋白稳定的乳化液为阳离子型。已经有报道证明,在含有胃蛋白酶的模拟胃液中,界面蛋白质的消化水解会使液滴表面的正电荷逐渐流失,并且还会降低界面膜的厚度,残留在油滴表面的蛋白和小肽产生的静电排斥作用和空间位阻不足以克服油滴之间的吸引,因而大量的油滴发生絮凝聚结[29]。然而在进入肠消化后,乳化猪油由于胆汁盐和脂肪酶的作用导致再次发生乳化,使液滴无法聚结,而且再次被保护起来。这也是图2中肠胃消化过程粒径大小发生变化的原因之一。
3 结 论
本实验主要研究了超声和TG处理对乳化猪油界面吸附蛋白含量及其体外消化影响。通过对胃、肠消化的模拟,探讨超声前后乳化猪油粒径、Zeta电位、游离脂肪酸释放量和微观结构变化,发现超声对乳化猪油起着破乳的效果,降低蛋白与油的结合紧密度和界面蛋白的含量,从而促进消化。
乳化猪油中加入TG后,由于TG起着促进蛋白质交联的作用,具有改善蛋白的起泡性、黏度以及乳化能力的作用。TG交联蛋白对乳化猪油起着促进乳化的作用,使蛋白与油滴之间结合更加紧密,增加界面蛋白含量,从而延缓了消化。这两种方法在以后对不同食品的消化要求起着重要的作用。
[1] DEMAN L, DE MAN J M, BLACKMAN B. Physical and textural characteristics of some North American shortenings[J]. Journal of the American Oil Chemists Society, 1991, 68(2): 63-69. DOI:10.1007/BF02662318.
[2] LOPEZ C, LESIEUR P, KELLER G, et al. Thermal and structural behavior of milk fat: 1. unstable species of cream[J]. Journal of Colloid and Interface Science, 2000, 229(1): 62-71. DOI:10.1006/jcis.2000.6988.
[3] CAMPBELL S D, GOFF H D, ROUSSEAU D. Comparison of crystallization properties of a palm stearin/canola oil blend and lard in bulk and emulsified form[J]. Food Research International, 2002,35(10): 935-944. DOI:10.1016/S0963-9969(02)00156-4.
[4] JOHNSON L R, ALPERS D H, CHRISTENSEN J, et al. Physiology of the gastrointestinal tract, 3rd edn[J]. Liver International, 2010, 14(5): 279.
[5] MCCLEMENTS D J, DECKER E A, PARK Y. Physicochemical and structural aspects of lipid digestion[J]. Understanding and Controlling the Microstructure of Complex Foods, 2007, 6(9): 483-503.
[6] AWAD T S, MOHARRAM H A, SHALTOUT O E, et al.Applications of ultrasound in analysis, processing and quality control of food: a review[J]. Food Research International, 2012, 48(2):410-427. DOI:10.1016/j.foodres.2012.05.004.
[7] FRYDENBERG R P, HAMMERSHØJ M, ANDERSEN U, et al.Ultrasonication affects crystallization mechanisms and kinetics of anhydrous milk fat[J]. Crystal Growth & Design, 2013, 13(12): 5375-5382. DOI:10.1021/cg4012923.
[8] MARTINI S, SUZUKI A H, HARTEL R W. Effect of high intensity ultrasound on crystallization behavior of anhydrous milk fat[J].Journal of the American Oil Chemists’ Society, 2008, 85(7): 621-628.DOI:10.1007/s11746-008-1247-5.
[9] UENO S, RISTIC R I, HIGAKI K, et al. In situ studies of ultrasoundstimulated fat crystallization using synchrotron radiation[J]. The Journal of Physical Chemistry B, 2003, 107(21): 4927-4935.DOI:10.1021/jp027840f.
[10] 崔艳华, 张兰威. 谷氨酰胺转氨酶研究进展[J]. 生物技术通报,2009(1): 31-36.
[11] 邵虎, 陶红军, 黄亚东, 等. 谷氨酰胺转氨酶的研究进展[J]. 中国酿造, 2010, 29(6): 9-12.
[12] WANG Qingling, JIANG Jiang, LI Jinwei, et al. High quality lard with low cholesterol content produced by aqueous enzymatic extraction and β-cyclodextrin treatment[J]. European Journal of Lipid Science and Technology, 2016, 118(4): 1-9.
[13] MINEKUS M, ALMINGER M, ALVITO P, et al. A standardised static in vitro digestion method suitable for food-an international consensus[J]. Food & Function, 2014, 5(6): 1113-1124. DOI:10.1039/c3fo60702j.
[14] HUNT J A, DALGLEISH D G. Adsorption behaviour of whey protein isolate and caseinate in soya oil-in-water emulsions[J].Food Hydrocolloids, 1994, 8(2): 175-187. DOI:10.1016/S0268-005X(09)80042-8.
[15] BONNAIRE L, SANDRA S, HELGASON T, et al. Influence of lipid physical state on the in vitro digestibility of emulsif i ed lipids[J].Journal of Agricultural and Food Chemistry, 2008, 56(10): 3791-3797.DOI:10.1021/jf800159e.
[16] HUR S J, DECKER E A, MCCLEMENTS D J. Influence of initial emulsifier type on microstructural changes occurring in emulsified lipids during in vitro digestion[J]. Food Chemistry, 2009, 114(1):253-262. DOI:10.1016/j.foodchem.2008.09.069.
[17] DECKER E A, HULTIN H O. Factors inf l uencing catalysis of lipid oxidation by the soluble fraction of mackerel muscle[J]. Journal of Food Science, 1990, 55(4): 947-950. DOI:10.1111/j.1365-2621.1990.tb01571.x.
[18] MOREL M H, DELHON P, AUTRAN J C, et al. Effects of temperature, sonication time and power settings on size distribution and extractability of total wheat flour proteins as determined by size-exclusion high-performance liquid chromatography[J].Cereal Chemistry, 2000, 77(5): 685-691. DOI:10.1094/CCHEM.2000.77.5.685.
[19] 胡慧玲. 乳清蛋白TGase酶法改性后的流变学特性及热变性研究[D].成都: 成都理工大学, 2010: 1-4.
[20] MCCLEMENTS D J, DECKER E A, PARK Y. Controlling lipid bioavailability through physicochemical and structural approaches[J].Critical Reviews in Food Science and Nutrition, 2008, 49(1): 48-67.DOI:10.1080/10408390701764245.
[21] 林传舟. 亚麻籽油多层乳液及其微胶囊的制备研究[D]. 无锡: 江南大学, 2015: 27-28.
[22] BAUER E, JAKOB S, MOSENTHIN R. Principles of physiology of lipid digestion[J]. Asian-Australasian Journal of Animal Sciences,2005, 18(2): 282-295.
[23] FAVÉ G, COSTE T C, ARMAND M. Physicochemical properties of lipids: new strategies to manage fatty acid bioavailability[J]. Cellular and Molecular Biology, 2004, 50(7): 815-831.
[24] HUR S J, DECKER E A, MCCLEMENTS D J. Influence of initial emulsifier type on microstructural changes occurring in emulsified lipids during in vitro digestion[J]. Food Chemistry, 2009, 114(1): 253-262. DOI:10.1016/j.foodchem.2008.09.069.
[25] GUZEY D, MCCLEMENTS D J. Impact of electrostatic interactions on formation and stability of emulsions containing oil droplets coated by β-lactoglobulin-pectin complexes[J]. Journal of Agricultural and Food Chemistry, 2007, 55(2): 475-485. DOI:10.1021/jf062342f.
[26] SURH J, DECKER E A, MCCLEMENTS D J. Inf l uence of pH and pectin type on properties and stability of sodium-caseinate stabilized oil-in-water emulsions[J]. Food Hydrocolloids, 2006, 20(5): 607-618.DOI:10.1016/j.foodhyd.2005.07.004.
[27] BURNETT G R, WICKHAM M, FILLERY-TRAVIS A, et al.Interaction between protein allergens and model gastric emulsions[J].Biochemical Society Transactions, 2002, 30(6): 916-918.DOI:10.1042/bst0300916.
[28] SAKAI K, YOSHINO K, SATTER M A, et al. Effects of pH variation and NaCl on in vitro digestibility of cow’s milk proteins in commercially available infant formulas[J]. Journal of Nutritional Science and Vitaminology, 2000, 46(6): 325-328.
[29] SARKAR A, GOH K K T, SINGH R P, et al. Behaviour of an oilin-water emulsion stabilized by β-lactoglobulin in an in vitro gastric model[J]. Food Hydrocolloids, 2009, 23(6): 1563-1569. DOI:10.1016/j.foodhyd.2008.10.014.
Effect of Ultrasound and Glutamine Transaminase Treatments on the in Vitro Digestibility of Emulsif i ed Lard
XU Xiaonan, LIU Yuanfa, LI Jinwei, JIANG Jiang*
(School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
The purpose of this study was to determine the impact of ultrasound-induced lipid crystal rearrangement and whey protein concentrate (WPC) cross-linked with glutamine transaminase (TG) as emulsif i er on the in vitro digestibility of emulsif i ed lard and to investigate the change in unadsorbed protein concentration among different formulations of emulsif i ed lard. Particle size, zeta-potential, free fatty acid prof i le and microstructure of emulsif i ed lard were investigated to evaluate its in vitro digestibility. The results showed that ultrasound and TG treatments had different impacts on emulsif i ed lard.Ultrasound treatment decreased the unadsorbed protein concentration and stability of the emulsion compared with the nontreated control, while TG treatment rendered the emulsion more sable. Moreover, the ultrasound-treated sample exhibited signif i cantly larger average droplet size and increased release of free fatty acids (P < 0.05), and its zeta-potential was also much lower than the control. In the presence of TG cross-liked WPC, the droplet size of the emulsion became smaller and signif i cantly less free fatty acids were released during digestion when compared with the ultrasound-treated sample(P < 0.05). Overall, ultrasound treatment rendered emulsif i ed lard more digestible, while TG treatment slowed down the digestion of emulsif i ed lard.
emulsif i ed lard; ultrasound; transglutaminase; in vitro digestion
10.7506/spkx1002-6630-201801017
TS229
A
1002-6630(2018)01-0111-07
许笑男, 刘元法, 李进伟, 等. 超声和酶处理对乳化猪油体外消化特性的影响[J]. 食品科学, 2018, 39(1): 111-117.
DOI:10.7506/spkx1002-6630-201801017. http://www.spkx.net.cn
XU Xiaonan, LIU Yuanfa, LI Jinwei, et al. Effect of ultrasound and glutamine transaminase treatments on the in vitro digestibility of emulsif i ed lard[J]. Food Science, 2018, 39(1): 111-117. (in Chinese with English abstract)
10.7506/spkx1002-6630-201801017. http://www.spkx.net.cn
2016-10-11
国家高技术研究发展计划(863计划)项目(2013AA102103-1)
许笑男(1990-),女,硕士研究生,研究方向为油脂与植物蛋白。E-mail:sirenxxn@163.com
*通信作者简介:蒋将(1982-),女,副教授,博士,研究方向为蛋白质化学以及乳液机理。E-mail:jiangjiang0909@gmail.com

