基于微卫星标记的胎生蜥蜴母本与子代的遗传多样性研究*
赵 丹,刘玉芬,赵文阁,刘 鹏
(哈尔滨师范大学)
基于微卫星标记的胎生蜥蜴母本与子代的遗传多样性研究*
赵 丹,刘玉芬,赵文阁,刘 鹏**
(哈尔滨师范大学)
采用微卫星标记技术,对我国胎生蜥蜴(Zootoca vivipara)3个种群共18只母本和67只子代进行遗传多样性分析.结果表明,11对微卫星引物在额尔古纳、库都尔和布尔津种群检测到的等位基因数分别为70、64和68个,YW16和YW18位点的等位基因数最多,额尔古纳和库都尔种群子代的遗传多样性高于母本,而布尔津种群子代的遗传多样性与母本无显著差异,这可能与该种群的多父权比例低、窝仔数少有关,建议加大对该种群的研究和保护力度.
胎生蜥蜴;微卫星;等位基因
0 引言
在动物的有性生殖过程中,父本遗传信息的加入以及染色体分离和重组增强了子代的基因多样化和亲本的遗传互补,使子代产生更大的变异和新的性状,比母本具有更多的遗传多样性,从而有利于种族的繁衍和对环境的适应[1-3].目前,应用于种群遗传多样性检测、婚配制度及亲子关系分析、个体识别和物种保护等方面的分子标记较多.其中,微卫星标记技术因为具有高度的个体特异性、多态性和杂合性而被广泛使用[4,5].
胎生蜥蜴(Zootoca vivipara)隶属于爬行纲有鳞目蜥蜴科,具有卵生-卵胎生双重繁殖方式,我国分布的种群均为卵胎生[6].胎生蜥蜴不同地理种群在形态大小、生活史特征及遗传结构等方面存在显著变化[7-9].因此,该文采用微卫星标记技术对我国胎生蜥蜴不同种群母本与子代之间的遗传多样性进行分析和比较,为该物种的保护和管理提供分子生物学方面的基础资料.
1 材料与方法
1.1 实验动物的采集和饲养
在2012~2014年的4~5月份,采用徒手法捕捉的方式从新疆布尔津、内蒙古额尔古纳和库都尔等地采集已经交配后的雌性胎生蜥蜴,剪指标记后带回哈尔滨师范大学实验室内室温条件下( 20~25℃)饲养[10,11].当怀孕的雌性胎生蜥蜴腹部明显膨大时,将其单独饲养,直至产下幼体.繁殖结束后,额尔古纳种群6只雌体共产仔蜥25只,库都尔种群6只雌体共产仔蜥24只,布尔津种群6只雌体共产仔蜥18只,总计85只个体.
1.2 DNA提取和PCR扩增
取胎生蜥蜴的尾部肌肉放入无水乙醇中保存并做好标记,确保母本和子代之间能够相互对应.使用上海生工生物工程有限公司SanPrep柱式动物基因组DNA抽提试剂盒提取DNA,将稀释的DNA模板放在-20℃保存.在Genbank上选取11对多态性较好的微卫星引物(见表1)[12-14],由哈尔滨博仕生物公司合成后进行PCR扩增.PCR反应体系为模板DNA1.0 μL,上下游引物各0.8 μL,10×PCR Buffer2 μL,dNTP1.6 μL,Taq酶0.2 μL,ddH2O13.6 μL.反应条件为94 ℃预变性5 min,94 ℃变性30 s,最适退火温度30 s,72℃延伸30 s,共30个循环,再72 ℃延伸10 min,4 ℃保温.

表1 卫星引物反应条件及Genbank登录号
1.3 PCR产物检测和染色
使用10%的非变性聚丙烯酰胺凝胶电泳(30%聚丙烯酰胺17 mL,5×TBE 10 mL,10%APS 500 μL,TEMED 50 μL,去离子水定容至50 mL)检测PCR产物.每个产物上样7 μL(含1.5 μL Buffer),在100 V电压下进行电泳.在电泳结束后,用银染法进行染色.首先放入固定液中固定15 min,然后在双蒸水中浸泡3 min,重复3次后放入0.1% AgNO3溶液15 min,再用dd H2O洗脱3次,最后放入显色液中静置,当有条带出现后快速拿出,在蒸馏水中清洗后放入固定液中保存.
1.4 数据处理和分析
使用SONY单反照相机DSC-F828对电泳结果拍照记录,电泳图片用Gel-pro analyzer 4.5软件分析,扩增片段的大小与天根生化科技有限公司的DNA Marker pBR322进行比较,将相同迁移距离的条带看作同一位点,标记为1,没有出现条带则标记为0,使用Quantity One软件分析母本和子代的基因型[15],并统计等位基因数.应用 Popgene 1.32 软件计算观察等位基因数、有效等位基因数、Nei’s多样性指数和Shannon’s指数,利用Gervus 3.0软件计算多态信息含量.
2 结果
2.1 胎生蜥蜴母本和子代之间等位基因数的比较
在11个微卫星位点中,额尔古纳种群中共检测到70个等位基因,其中母本有53个等位基因,子代有66个等位基因,新增17个等位基因,YW16位点的等位基因最多,母本有8个等位基因,子代有9个等位基因,总体有11个等位基因;库都尔种群中共检测到64个等位基因,其中母本有50个等位基因,子代有63个等位基因,新增14个等位基因,YW18位点的等位基因最多,母本有8个等位基因,子代有8个等位基因,总体有9个等位基因;布尔津种群中共检测到68个等位基因,其中母本有55个等位基因,子代有66个等位基因,新增13个等位基因,YW16位点的等位基因最多,母本有8个等位基因,子代有9个等位基因,总体有9个等位基因(见表2).
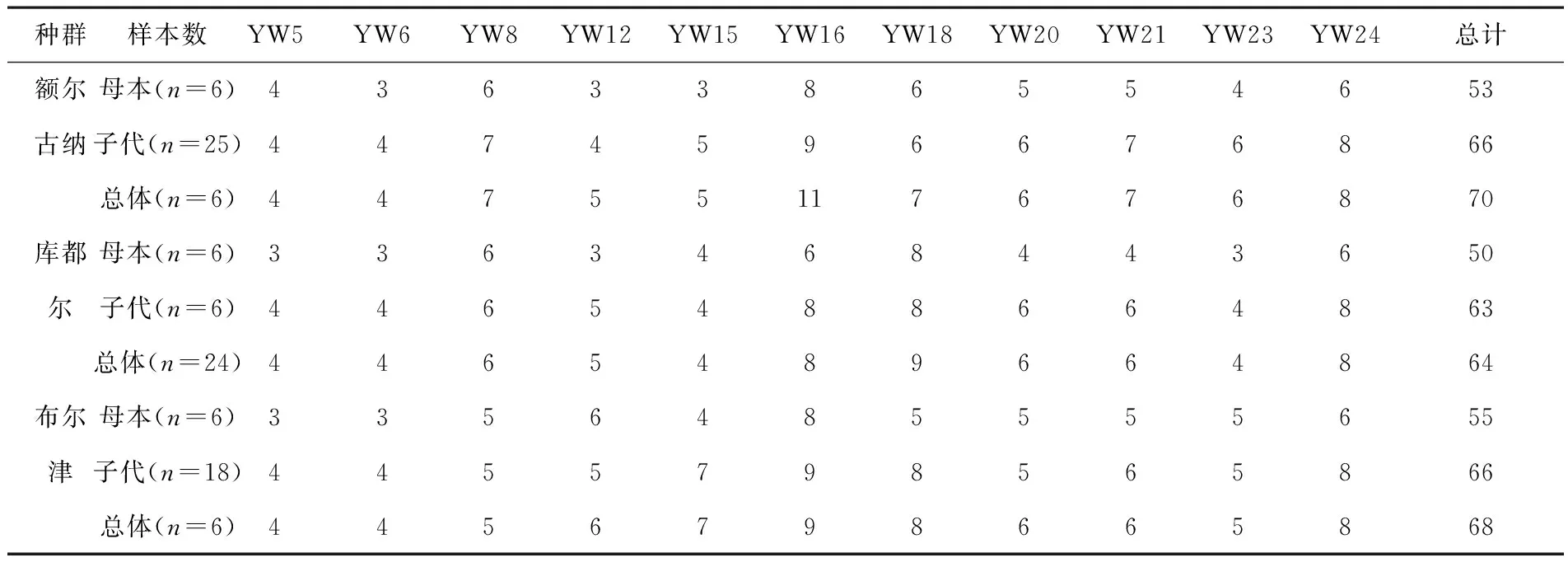
表2 胎生蜥蜴不同种群母本与子代的等位基因数
2.2 胎生蜥蜴母本与子代之间遗传多样性的比较
额尔古纳、库都尔和布尔津3个胎生蜥蜴种群子代11个微卫星位点的观察等位基因数和Shannon’s指数的平均值均显著高于母本,额尔古纳和库都尔2个种群子代的有效等位基因数、多态信息含量和Nei’s多样性指数的平均值均显著高于母本,而布尔津种群子代的有效等位基因数、多态信息含量和Nei’s多样性指数的平均值和母本之间无显著差异(见表3).
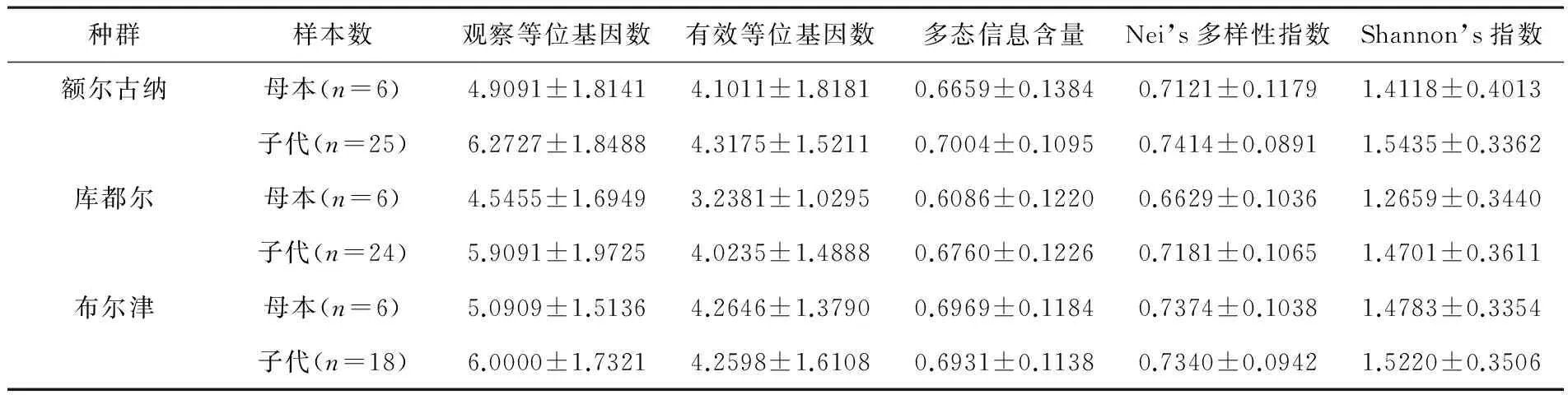
表3 胎生蜥蜴不同种群母本与子代遗传多样性分析
3 讨论
以往的研究表明,胎生蜥蜴雌性具有多次交配的行为,繁殖期在腹面形成多个交配痕[11,16],并在子代中表现出多父权现象[17].雌性选择与多个雄性交配的婚配制度可以使雌性获得更多高质量的配偶,从而提高后代的适合度,使得子代比母本具有更多的遗传多样性[2].在本研究中,布尔津种群的平均窝仔数为3.00±0.89只,额尔古纳种群的平均窝仔数为4.17±1.33只,库都尔种群的平均窝仔数为4.00±1.27只,布尔津种群的平均窝仔数显著低于其他两个种群.由此推测,与额尔古纳和库都尔种群相比,布尔津种群子代新增的等位基因数少,遗传多样性也没有显著增加,可能与该种群的多父权比例低、窝仔数少有关.
胎生蜥蜴是所有蜥蜴中分布最广泛的种类,从西班牙西北部向东横跨整个欧洲,一直延伸到库页岛,向北可达北纬73°,向南可达北纬41°.我国是胎生蜥蜴分布的南部边界,主要分布在新疆、内蒙古和黑龙江等地区.作为胎生蜥蜴的边缘种群,布尔津种群的数量少、分布范围小、遗传多样性水平低[6,18],因此,应加大对该种群的研究和保护力度,探讨不同种群之间的系统发育和起源演化关系.
[1] 张宪德. 灰文鸟配偶选择及分子机制研究[D]. 辽宁大学, 2016.
[2] 管昊. 基于微卫星技术的白鹭种群遗传多样性初步研究[D]. 厦门大学, 2012.
[3] 张秀梅, 张东雪, 王亮. 水生动物多次交配繁殖策略与多重父权研究进展[J]. 中国海洋大学学报:自然科学版, 2016, 46(11): 22-31.
[4] 赵丹, 赵文阁, 刘鹏. 我国蜥蜴微卫星标记的开发及其应用[J]. 哈尔滨师范大学自然科学学报, 2016, 32(3): 83-86.
[5] 罗丹. 基于微卫星标记的罗坑自然保护区饲养鳄蜥种群的父权关系和遗传多样性分析[D]. 广西师范大学, 2014.
[6] 赵文阁, 刘鹏, 陈辉. 黑龙江省两栖动物志[M]. 北京: 科学出版社, 2008.
[7] Bauwens D, Verheyen R F. Variation of reproductive traits in a population of the lizard Lacerta vivipara[J]. Holarctic Ecology, 1987, 10: 120-127.
[8] Guillaume Cl P, Heulin B, Pavlinov IY, et al. Morphological variations in the common lizard, Lacerta (Zootoca) vivipara[J]. Russian Journal of Herpetology, 2006, 13:1-10.
[9] Takeuchi H, Takeuchi M, Hikida T. Extremely low genetic diversity in the Japanese population of Zootoca vivipara (Squamata: Lacertidae) revealed by Mitochondrial DNA[J]. Current Herpetology, 2013, 32:66-70.
[10] 宋乔蕊, 扬成, 刘鹏, 等. 人工饲养条件下胎生蜥蜴蜕皮行为的观察[J].动物学杂志, 2015, 50(3): 366-371.
[11] 范玉玲, 扬成, 刘鹏, 等. 胎生蜥蜴雌性腹部交配痕的初步观察[J]. 哈尔滨师范大学自然科学学报, 2015, 31(3): 104-106.
[12] Boudjemadi K, Martin O, Simon J C, et al. Development and cross-species comparison of microsatellite markers in two lizard species, Lacerta vivipara and Podarcis muralis[J]. Molecular Ecology, 1999, 8(3): 518-520.
[13] Virginie M S, Murielle R, Colin B, et al. Twelve new polymorphic microsatellite loci for the common lizard, Zootoca vivipara[J]. Molecular Ecology Resources, 2011, 11: 586-589.
[14] Schwartz T S, Olsson M. Microsatellite markers developed for a Swedish population of sand lizard (Lacerta agilis)[J]. Conservation Genetics, 2008, 9(3): 715-717.
[15] 陈友明, 陈校辉, 潘莹, 等. 江黄颡(♀)和乌苏里拟鲿(♂)及其杂交子代遗传变异的RAPD分析[J]. 上海海洋大学学报, 2010, 19(1): 12-18.
[16] 李殿伟, 刘鹏, 赵文阁. 模拟生境中胎生蜥蜴的交配行为及其与环境因子的关系[J]. 动物学杂志, 2011, 46(5): 41-47.
[17] Laloi D, Richard M, Lecomte J, et al. Multiple paternity in clutches of common lizard Lacerta vivipara: data from microsatellite markers[J]. Molecular Ecology, 2004, 13(3): 719-723.
[18] 刘欢. 胎生蜥蜴遗传多样性研究[D]. 哈尔滨师范大学, 2016.
GeneticDiversityofFemalesandOffspringsBasedonMicrosatelliteMarkinginDifferentPopulationsofZootocaVivipara
Zhao Dan, Liu Yufen, Zhao Wenge, Liu Peng
(Harbin Normal University)
Using microsatellite marking technology, the genetic diversity of 18 females and 67 offsprings in 3 populations of Zootoca vivipara in China were analyzed. The results showed that the number of alleles in Eerguna, Kutul and Buerjin population respectively were 70, 64 and 68. There were most alleles on YW16 and YW18 in the 11 pairs of microsatellite primers. The genetic diversity of offsprings was higher than their female parents in both Eerguna population and Kutul population, while it was not significantly different in Buerjin population. It may be associated with the lower proportion of multiple fatherhood and less litter sizes in Buerjin population, so more researches and protections should be given to the population in the future.
Zootoca vivipara; Microsatellite; Alleles
于达)
Q347
A
1000-5617(2017)04-0050-04
2017-04-22
*黑龙江省自然科学基金项目(C2016035)
**通讯作者:liupeng111111@163.com

