重庆地区猪流行性腹泻病毒M基因的序列分析
祁寒松,吴 鹏,赵光伟,杨晓伟
(西南大学荣昌校区动物疾病快速诊断中心,重庆 荣昌 402460)
重庆地区猪流行性腹泻病毒M基因的序列分析
祁寒松,吴 鹏,赵光伟,杨晓伟*
(西南大学荣昌校区动物疾病快速诊断中心,重庆 荣昌 402460)
【目的】本文研究了重庆地区猪流行性腹泻病毒(Porcine Epidemic Diarrhea Virus, PEDV)M基因序列的特征。【方法】2015年期间采集了来自重庆地区3家规模猪场的病料,采用RT-PCR的方法对PEDV的M基因进行了扩增,测序后进行了分析,并与中国其他省份、美国、韩国的PEDV毒株进行同源性比较,完成了进化树的构建。【结果】3份病料中M基因片段长为426 bp,编码142个氨基酸。测序表明,3份毒株M基因同源性为98.7 %~99.8 %。与经典毒株CV777相比,核酸序列同源性为97.1 %~98.2 %。【结论】说明PDEV病毒M基因相对保守,可以作为临床检测的靶标。
猪流行性腹泻病毒;M基因;序列分析
【研究意义】猪流行性腹泻(Porcine Epidemic Diarrhea, PED)是由猪流行性腹泻病毒(Porcine Epidemic Diarrhea Virus,PEDV)所引起的一种接触性肠道传染病,发病的猪会出现呕吐、腹泻和脱水的症状[1]。 PEDV属于尼多病毒目(Nidovirales)冠状病毒科(Corona-viridae)冠状病毒属(Coronavirus)抗原I群成员,是有囊膜不分节段的单链正股RNA病毒[2]。被感染的病猪小肠上皮细胞变性,上皮细胞间的紧密连接消失,绒毛变短,并且感染和复制的过程较慢,所以其潜伏期较长,断奶和育肥猪发病率较高[3-4]。不同生长阶段和品系的猪均易感,其中对于哺乳仔猪的危害尤为严重,1 周龄以内的哺乳仔猪常在发病后 2~4 d 死亡,致死率可高达90.0 % 以上,给当前我国的养猪业造成了巨大经济损失[5-6]。【前人研究进展】1971年,PED首次在欧洲被发现,其各项临床症状与传染性胃肠炎十分相似,发病率较高,死亡率较低。在1977年被证实流行于比利时以及英国的传染病为PED,并在比利时分离得到该病毒[7]。之后,该病迅速传播到亚洲多个国家。我国自20世纪80年代以来陆续有关于该病的报道,并且随后全国26个省市自治区均有该病发生。从2010年年底开始,该病在我国的流行区域面积和流行强度上有不断扩大和增强的趋势,给我国养猪业予以重创[8]。猪流行性腹泻和猪传染性胃肠炎(Transmissible gastroenteritis virus,TGEV)两者均是引起猪腹泻的常见肠道病毒,二者所引起腹泻性疾病具有高度接触传染性且临床症状、病理变化以及流行病学特征极为相似,故在组织病理学和临床上很难将两者进行区分开来[9]。由于PEDV、TGEV这2种病毒临床上所呈现出的相似症状,经常会发生混合感染,但是它们没有共同的抗原性,因此不能交互免疫[10]。近年来,国内外学者所克隆的几株PEDV的M基因,经比较分析发现,M基因极为保守。所以测序和分析当前PEDV流行毒株M基因的序列特征可为PEDV诊断检测方法的建立奠定基础。【本研究切入点】近年来腹泻病非常严重,而流行性腹泻病毒是造成腹泻的重要病原之一,但由于临床中腹泻病的症状极为相似,不易与其他病原进行区分,必须借助实验室诊断方可确诊,因此本研究针对流行性腹泻病毒中较为保守的M基因进行分析,为建立基于该基因的检测或治疗方法做铺垫。【拟解决的关键问题】对重庆地区流行性腹泻病毒毒株中M基因进行序列分析,与国内外流行的毒株比较,分析其同源性和变异性,为进一步探究针对M基因建立诊断和治疗方法奠定基础。
1 材料与方法
1.1 病料
本研究测序的PEDV阳性病料样品由重庆地区发生腹泻的猪场送检,由西南大学荣昌校区动物疾病快速诊断及防治中心保存。
1.2 试剂
反转录试剂盒(Prime Script 1st Strand cDNA Synthesis Kit)购自宝生物工程(大连)有限公司;DL2000 Marker、pMD19-T Vector、RNase-free水、dNTP等均购自宝生物工程(大连)有限公司;琼脂糖凝胶购自上海生工生物工程有限公司;胶回收试剂盒(TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver.3.0)购自宝生物工程(大连)有限公司。
1.3 引物设计与合成
本研究所使用的引物,是参考文献中根据GenBank登录的PEDV M基因保守区所设计[10],由宝生物工程(大连)有限公司合成,引物序列如下:PEDV-M1:5′-GTCTAACGGTTCTATTCCC-3′;PED V-M2:5′-TTATAGCCCTCTACAAGC-3′。
1.4 样品处理
取固体组织0.5 g,剪碎,加入1.5 mL生理盐水,充分研磨,转入1.5 mL离心管中,10 000 r/min离心2 min,取上清100 μl,用于RNA提取。
1.5 总RNA的提取以及反转录合成cDNA
取1.4中处理好的100 μl样品上清液按照TaKaRa RNA提取试剂盒说明书提取PEDV总RNA后,用宝生物工程(大连)有限公司的反转录试剂盒(Prime Script 1st Strand cDNA Synthesis Kit)进行反转录合成cDNA。反应体系如下:5×Prime Script Buffer 2 μl,Prime Script RT Enzyme Mix 0.5 μl,Oligo dT Primer 0.5 μl,Random 6 mers 0.5 μl,Total RNA 4 μl,RNase Free dH2O 2.5 μl。反转录反应条件为:37 ℃ 15 min,85 ℃ 5s,4 ℃保存。
1.6 M基因片段扩增、克隆及测序
反应体系如下:PremixTaq(TaKaRaTaqVersion) 12.5 μl,cDNA模板 1 μl,上、下游引物各 1 μl,RNase Free ddH2O 10.5 μl。扩增反应条件为:94 ℃预变性5 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,共循环30次;72 ℃延伸10 min;4 ℃保存。取5 μl PCR产物进行电泳检测,琼脂糖凝胶浓度为1 %,在凝胶成像系统下观察并拍照。回收目的片段并连接至pMD19-T Vector,转化至DH-5α感受态细胞,对重组质粒进行PCR鉴定和双酶切鉴定,将阳性菌株送至上海生工公司进行测序。获得序列利用DNAStar软件包进行分析,并且与NCBI上公布的序列进行比较分析。
2 结果与分析
2.1 M基因的扩增
12份送检样中有3份阳性样品,依次命名为1~3号。经过PCR扩增得到了相应的基因片段,各扩增片段大小与预期相当(图1)。
2.2 M基因序列变化
对3个被检样本的M基因片段序列与GenBank中登录的部分M基因进行对比分析(本实验扩增得到M基因片段长为450 bp,编码150个氨基酸)。1~3号送检序列与经典毒株CV777(GenBank登录号:AF353511)相比共同变位点有8处(5:T→C;60:G→A;78:C→T;93:C→T;102:C→T;114:C→T;172:T→C;228:T→A),此外,3号与CV777还有1处变位点(265:G→A),1号与CV777还有5处变位点(1:T→A;11:T→G;29:C→T;440:T→C;441:C→A)。1~3号送检序列与四川流行毒株CH-SC2-2012相比,1、2号共同变位点有1处(265:A→G),此外,1号与CH-SC2-2012还有5处变位点(1:T→A;11:T→G;29:C→T;440:T→C;441:C→A),3号与其无核酸突变变位点。另外,送检序列与经典毒株CV777相比共同氨基酸突变位点1处(2:V→A),除此之外,1号与CV777还有4处氨基酸突变位点(1:S→T;4:L→W;10:A→V;147:V→A),3号与CV777还有1处氨基酸突变位点(89:V→I)。送检序列与四川流行毒株CH-SC2-2012(GenBank登录号:JX869044)相比,1、2号共同氨基酸突变位点1处(89:I→V),除此之外,1号与CH-SC2-2012还有4处氨基酸突变位点(1:S→T;4:L→W;10:A→V;147:V→A),3号与其无氨基酸突变位点。通过序列同源性比较,所测定的3个毒株M基因序列同源性为98.7 %~99.8 %。与CV777相比,核苷酸同源性为97.1 %~98.2 %。1号与其余28组序列同源性为96 %~98.9 %,2号与其余28组序列同源性为97.1 %~100 %,3号与其余28组序列同源性为96.9 %~100 %,其中2号与加拿大的CAN/Quebec334、哥伦比亚的COL/Cundinamarca、美国的Hawaii/39249和PC177以及中国河南的CH/HNLH、CH/HBXX2的核苷酸同源性为100 %,3号与中国四川的CH-SC2的核苷酸同源性为100 %(图2)。
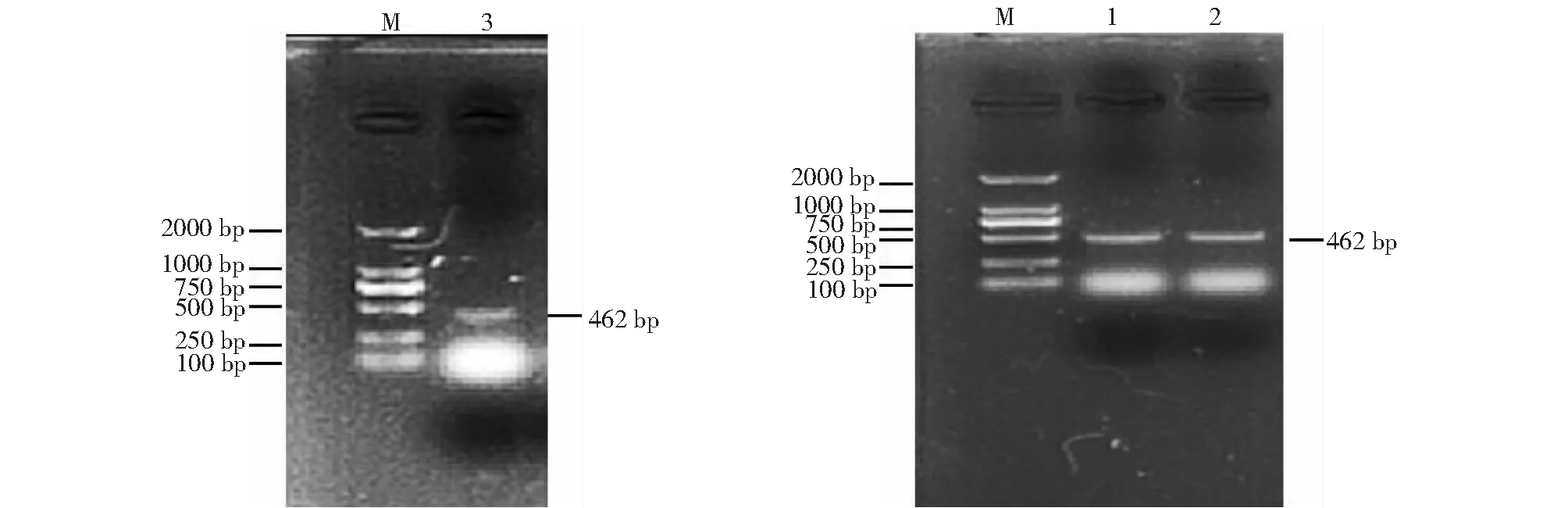
M为2000 DNA marker;1~3为扩增片段M: DL 2000 marker; 1-3: Fragments of PCR products图1 M基因的扩增Fig.1 Amplification of M gene
3 讨 论
近年来猪流行性腹泻病毒(PEDV)作为引起仔猪腹泻的主要病原之一,感染此病毒的仔猪主要表现出呕吐、水样腹泻、迅速脱水等症状,最后机体脱水死亡;即使痊愈的仔猪生长也极为缓慢,成为僵猪。哺乳仔猪、育肥猪的发病率可以高达100 %,该病对哺乳仔猪的危害表现得最为严重。

图2 29个毒株M基因核苷酸序列的同源性比较Fig.2 Homology comparison of M gene nucleotide sequences of 29 PEDV strains
1971年英国最先报道了猪流行性腹泻(PED)[11],随即此病就在欧洲迅速传播[12],21世纪在亚洲各个地区流行尤其是在中国、泰国和韩国。在我国,此病造成哺乳仔猪死亡率极高,2015年,某规模化猪场中有50多头母猪同时出现腹泻症状,超过600头哺乳仔猪相继死亡,其中1周龄以内发病的仔猪死亡率高达95 %。主要临床表现是消瘦、呕吐及水样腹泻。现场调查,该场1个月前母猪普免了猪传染性胃肠炎-流行性腹泻-轮状病毒三联弱毒疫苗[13]。因此,对于PEDV流行毒株主要抗原基因的分子流行动态进行监测,对于预防和控制PED是有重要意义的。
4 小 结
本研究通过对PEDV M基因片段的序列分析,发现其在国内外的流行毒株中具有高度保守性(96 %~100 %),3号被检毒株可能与四川流行毒株CH-SC2-2012同源。1号毒株可能为变异毒株,但需进一步相关检测。3株被检毒株之间的同源性也较高(98.7 %~99.8 %),这种保守性将有利于我们针对该基因建立PCR诊断方法和研制针对M蛋白的单克隆抗体,以用于临床上PEDV感染的诊断。PEDV M蛋白是刺激机体产生免疫保护的重要的抗原蛋白之一[14],而且其氨基酸序列具有高度保守性,对其进行序列保守性的分析可为PEDV的诊断和治疗试剂研发提供有力的依据。
[1]王佳伟. 猪流行性腹泻的特点与防控[J]. 农民致富之友,2016(4):238.
[2]斯特劳 B E. 猪病学[M].8版,赵德明,张仲秋,沈建忠,译. 北京:中国农业大学出版社,2000:181-187.
[3]安丽蓉.猪腹泻病的原因及防治措施[J].农业技术与装备,2009(15):27.
[4]徐国栋,李 峰,张广峰.国内猪流行性腹泻防治概况[J].畜牧与兽医,2011,43(12):88-93.
[5]Pritchard G C, Paton D J, Wibberley G, et al. Transmissible gastroenteritis and porcine epidemic diarrhea in Britain[J]. Vet Rec, 1999, 144(22): 616-618.
[6]Kweon C, Kwon B, Woo S, et al. Immunoprophy lactic effect of chicken egg yolk immunoglobulin (IgY) against porcine epidemic diarrhea in piglets[J]. J Vet Med Sci, 2000, 62(9): 961-964.
[7]Pensaert M, P. De Bouck. A new coronavims-like particle associated withdiarrhea in swine[J]. Arch Virol, 1978, 58: 243-247.
[8]孙东波,冯 力,时洪艳,等.猪流行性腹泻病毒分子生物学研究进展[J]. 动物医学进展,2006, 27(10):11-14.
[9]Chaec, Kimo, Choc, et al. Prevalence of porcine epidemic diarrhoea virus and transmissible gastroenteritis virus in Korea pigs[J]. J Vet Res, 2000, 147: 606-608.
[10]焦 洋,姜 焱,王凯民,等. 猪传染性胃肠炎病毒,猪流行性腹泻病毒和猪博卡病毒多重PCR检测方法的建立[J]. 动物医学进展,2013,34(8):71-75.
[11]Oldhamj. Lettertotheeditor[J]. Pig Farming, 1972, 10(Supp1): 72-73.
[12]Song D, Park B. Porcine epidemic diarrhoea virus:a comprehensive review of molecular epidemiology,diagnosis and vaccines[J]. Virus Genes, 2012, 44(2): 167-175.
[13]吴美洲,陈芳洲,周春陵,等.新型猪流行性腹泻的诊断控制及其病原分子特征[J].中国兽医科学,2016,46(2):149-156.
[14]Utiger A, K. Tobler. Identification of proteins specified by porcine epidemic diarrhea virus[J]. Advances in Experimental Medicine and Biology, 1995b, 380: 287.
SequenceAnalysisofMGeneofPorcineEpidemicDiarrheaVirusesinChongqingMunicipality
QI Han-song, WU Peng, ZHAO Guang-wei, YANG Xiao-wei*
(Animal Diseases Rapid Diagnosis Center, Southwest University, Rongchang Campus, Chongqing 402460, China)
【Objective】In this paper, the sequence features ofMgene of porcine epidemic diarrhea virus (PEDV) in Chongqing municipality were studied. 【Method】Three samples from different pig farms in Chongqing during 2014-2015 were collected. RT-PCR method was used for gene amplification,Mgenes of three positive samples were sequenced, their nucleotide sequences by DNA star software were analyzed and compared with strains from other areas, and finally their phylogenetic tree were constructed. 【Result】Mgene in the nucleotide sequences of three positive samples were 426 bp, encoding 142 amino acids. It was found that the nucleotide homology ofMgenes among the three samples was 98.7 %-99.8 %, and compared with classic stain CV777, the homology was between 97.1 % and 98.2 %.【Conclusion】These findings indicated that theMgene is relatively conservative and could be a target of clinical diagnosis.
Porcine epidemic diarrhea virus;Mgene; Sequence analysis
1001-4829(2017)12-2829-04
10.16213/j.cnki.scjas.2017.12.036
2017-01-10
西南大学教育教学改革项目(2016JY097,2016JY10 0);西南大学中央高校基金基本科研业务项目(XDJK2013C057,XDJK2012C100);西南大学博士启动基金(2013Bsr09)
祁寒松(1995-),男,四川眉山人,主要从事兽医微生物研究;*为通讯作者,杨晓伟,硕士,讲师,从事兽医微生物与免疫学教学科研工作,yangxiaowei396@163.com。
S828
A
(责任编辑陈 虹)

