微小RNA-1表达水平与高血压左心室肥厚的关系
司煜安
(江苏省江阴市人民医院检验科,江苏江阴214400)
微小RNA-1表达水平与高血压左心室肥厚的关系
司煜安
(江苏省江阴市人民医院检验科,江苏江阴214400)
目的探讨微小RNA(microRNA,miRNA)与高血压左心室肥厚的相关性。方法选取50例高血压患者及50例高血压左心室肥厚患者,采用反转录聚合酶链反应(RT-PCR)法检测血浆中miRNA-1表达水平,分析miRNA-1表达水平与左心室相关指标的相关性,应用受试者工作特征(receiver operating characteristic,ROC)曲线评价miRNA-1对高血压左心室肥厚的预测价值。结果高血压左心室心肥厚组室间隔厚度、左心室壁厚度、左心室舒张末期内径、左心室质量指数及miRNA-1表达水平均显著高于高血压组,差异有统计学意义(P<0.05)。miRNA-1表达水平与室间隔厚度(r=0.382,P=0.002)、左心室壁厚度(r=0.411,P=0.001)、左心室舒张末期内径(r=0.285,P=0.023)、左心室质量指数(r=0.492,P=0.000)呈正相关。miRNA-1预测高血压左心室肥厚的ROC曲线下面积为0.937(95%CI:0.875~0.962,P<0.05)。结论miRNA-1表达与高血压左心室肥厚发生、发展密切相关,miRNA-1可能是高血压左心室肥厚特异性诊断的潜在标志物。
高血压;微小RNA-1;左心室肥厚
左心室肥厚是高血压常见靶器官损害之一,其发生率约为10%~40%。高血压左心室肥厚可进展为心力衰竭甚至猝死,严重威胁患者生命安全[1]。因此,开展高血压左心室肥厚早期诊疗对于改善患者的临床预后具有十分重要的意义。微小RNA(microRNA,miRNA)是一类长约22个核苷酸的内源性非编码小分子RNA,其可通过与下游靶基因的 3′-非翻译区(untranslated region,UTR)相结合,在转录水平对靶基因产生调控作用,从而参与一系列病理生理过程[2]。研究证实,miRNA的表达失调或功能异常在高血压左心室肥厚的发生、发展中发挥重要作用[3]。miRNA-1是心肌特异性miRNA,其表达与心脏发育密切相关[4]。但miRNA-1与高血压左心室肥厚的相关性研究鲜见报道。本研究旨在探讨miRNA-1对高血压左心室肥厚的预测价值,以期为高血压左心室肥厚的临床诊疗提供依据。
1 资料和方法
1.1 一般资料
选取2015年10月至2016年10月江阴市人民医院收治的高血压患者为研究对象,按超声心动图检查结果分为高血压左心室肥厚组和高血压组:左心室肥厚组50例,男24例,女26例,年龄(69.9±10.2)岁;高血压组50例,男22例,女28例,年龄(72.3±13.5)岁。两组性别、年龄比较,差异无统计学意义(χ2=0.161,P=0.688;t=0.202,P=0.850)。高血压诊断标准[5]:收缩压(systolic blood pressure,SBP)≥140 mmHg(1 mmHg=0.133 kPa)或舒张压(diastolic blood pressure,DBP)≥90 mmHg。左心室肥厚诊断标准:左心室质量指数(left ventricular mass index,LVMI)>125 g/m2(男)和>110 g/m2(女)。
1.2 血样采集与检测
抽取患者清晨空腹肘静脉血5 mL,采用日立全自动生化分析仪7600检测总胆固醇(total cholesterol,TC)、三酰甘油(triacylglycerol,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、血肌酐(creatinine,Cr)、尿酸(uric acid,UA)。
1.3 超声心动图检查方法
采用飞利浦IE33型彩色超声仪,探头频率设置为2.5~3.5 MHz,由同一超声科医师测量室间隔厚度、左心室壁厚度、左心室舒张末期内径,左心室质量=0.8×1.04×[(室间隔厚度+左心室壁厚度+左心室舒张末期内径)3-左心室舒张末期内径3]+0.6,LVMI=左心室质量/体表面积。
1.4 反转录聚合酶链反应检测miRNA- 1方法
取适量血浆样本,按TRIzol试剂盒说明书提取总RNA,DEPC水溶解,取1 μLRNA经1%琼脂糖凝胶电泳检测RNA完整性,采用Bio-Rad检测RNA纯度及浓度。按照逆转录试剂盒操作说明书进行逆转录反应,反应体系为20 μL,冰上依次加入以下试剂:1 μmol/L逆转录特异性引物3 μL、10×RT buffer 1.5 μL、100 mmol/L dNTPs 0.15 μL、50 U/μL MultiScribeTMReverse Transcriptase 1.0 μL、20 U/μL RNA 酶抑制剂 0.19 μL、总 RNA 1 μL,加DEPC水补至20 μL。反应条件:16℃反应30 min,42℃反应30 min,85℃反应5 s,产物-20℃保存备用。MiRNA-1逆转录引物序列:5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACATACAC-3′;U6逆转录引物序列:5′-CGCTTC ACGAATTTGCGTGTCAT-3′。按照聚合酶链反应(polymerase chain reaction,PCR)试剂盒操作说明书进行PCR扩增。反应体系为20 μL,冰上依次加入以下试剂:逆转录产物cDNA 1 μL、引物1 μL、TaqMan GEx MASTER Mix 10 μL,加双蒸水补至20 μL。反应条件:95℃反应10 min,92℃反应15 s,60℃反应1 min,共40个循环。以U6为内参,ΔCt值=miR-320Ct值-U6Ct值。MiRNA-1引物序列:正向 5′-CGGCGGTGGAATGTAAAGAAGT-3′,反向5′-GTGCAGGGTCCGAGGT-3′;U6引物序列:正向5′-CTCGCTTCGGCAGCACA-3′,反向5′-AACGCTTCACGAATTTGCGT-3′。
1.5 统计学分析
采用SPSS 20.0软件进行数据分析,计量资料用()表示,组间比较用t检验。计数资料用[n(%)]表示,组间比较用χ2检验。应用Spearman相关分析来分析miRNA-1与高血压左心室肥厚的相关性,以受试者工作特征(receiver operating characteristic,ROC)曲线评价miRNA-1对高血压左心室肥厚的预测价值。以P<0.05为差异具有统计学意义。
2 结果
2.1 两组基线资料比较
两组性别、年龄、SBP、DBP、TC、TG、HDL-C、LDL-C、Cr、UA、空腹血糖比较,差异均无统计学意义(P>0.05),详见表1。
表1 两组基线资料比较 [n=50,±s]
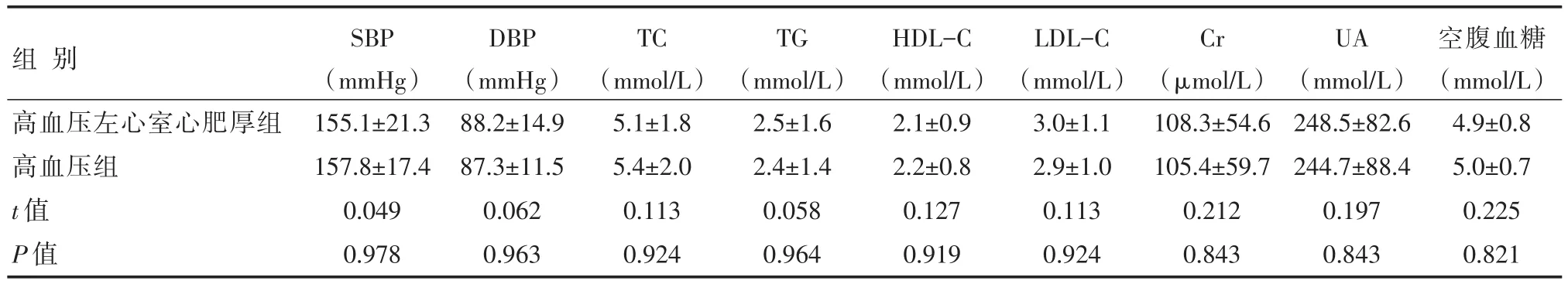
表1 两组基线资料比较 [n=50,±s]
组别高血压左心室心肥厚组高血压组t值P值SBP(mmHg)155.1±21.3 157.8±17.4 0.049 0.978 DBP(mmHg)88.2±14.9 87.3±11.5 0.062 0.963 TC(mmol/L)5.1±1.8 5.4±2.0 0.113 0.924 TG(mmol/L)2.5±1.6 2.4±1.4 0.058 0.964 HDL-C(mmol/L)2.1±0.9 2.2±0.8 0.127 0.919 LDL-C(mmol/L)3.0±1.1 2.9±1.0 0.113 0.924 Cr(μmol/L)108.3±54.6 105.4±59.7 0.212 0.843 UA(mmol/L)248.5±82.6 244.7±88.4 0.197 0.843空腹血糖(mmol/L)4.9±0.8 5.0±0.7 0.225 0.821
2.2 两组左心室相关指标及miRNA- 1表达水平比较
高血压左心室肥厚组室间隔厚度、左心室壁厚度、左心室舒张末期内径、LVMI及miRNA-1表达水平均显著高于高血压组,差异有统计学意义(P<0.05),详见表2。
表2 两组左心室相关指标及miRNA-1表达水平比较 [n=50,±s]
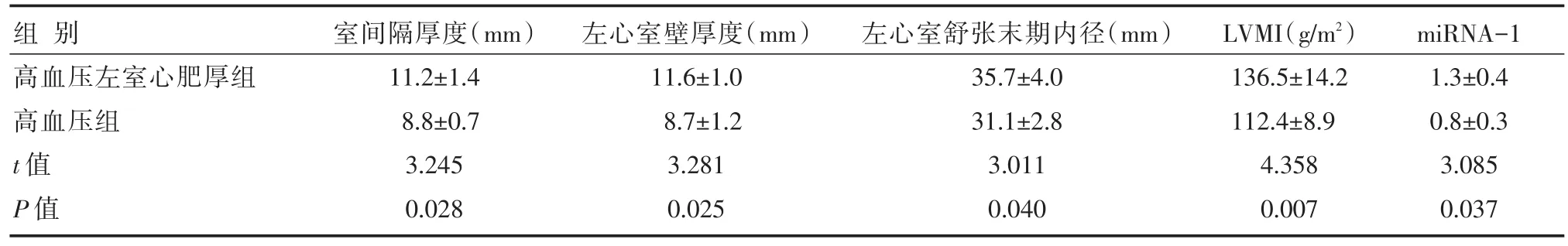
表2 两组左心室相关指标及miRNA-1表达水平比较 [n=50,±s]
组别高血压左室心肥厚组高血压组t值P值室间隔厚度(mm)11.2±1.4 8.8±0.7 3.245 0.028左心室壁厚度(mm)11.6±1.0 8.7±1.2 3.281 0.025左心室舒张末期内径(mm)35.7±4.0 31.1±2.8 3.011 0.040 LVMI(g/m2)136.5±14.2 112.4±8.9 4.358 0.007 miRNA-1 1.3±0.4 0.8±0.3 3.085 0.037
2.3 miRNA- 1表达水平与左心室相关指标的相关性分析结果
Spearman相关分析结果显示,miRNA-1表达水平与室间隔厚度、左心室壁厚度、左心室舒张末期内径、LVMI呈正相关(P<0.05),详见表3。
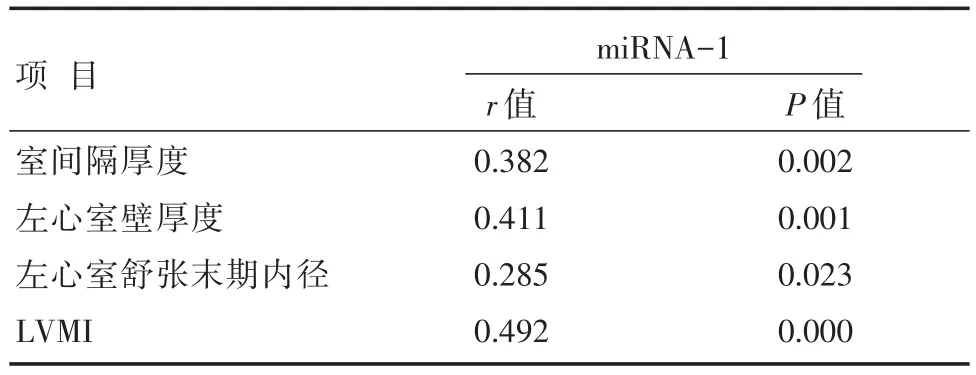
表3 miRNA-1表达水平与左心室相关指标的相关性分析结果
2.4 miRNA- 1对高血压左心室肥厚的预测价值
建立ROC曲线,以miRNA-1为检测变量,以是否出现左心室肥厚为状态变量(定义为1),分析miRNA-1对高血压左心室肥厚的预测价值,结果显示曲下面积(AUC)为 0.937(95%CI:0.875~0.962,P<0.05)。
3 讨论
随着高血压病程的持续,心肌细胞在血压波动的长期刺激下可诱发肥厚性生长应答,主要表现为心肌细胞肥大、心肌纤维化及胞质蛋白合成增强等,从而导致左心室心肌肥厚,造成心肌供血、供氧不足,影响心脏收缩及舒张,并最终发展为心力衰竭甚至死亡[7]。开展高血压左心室肥厚的早期鉴别诊断是逆转病变的有利措施。
本研究结果显示,高血压左心室肥厚患者室间隔厚度、左心室壁厚度、左心室舒张末期内径、LVMI及miRNA-1表达水平均显著高于高血压患者(P<0.05)。进一步分析证实,miRNA-1表达水平与室间隔厚度、左心室壁厚度、左心室舒张末期内径、LVMI呈正相关(P<0.05)。提示miRNA-1参与高血压左心室肥厚的发生与发展。大量研究证实,miRNA在心脏发育及心肌细胞分化过程中发挥至关重要的调控作用[8-9]。因此,深入探究miRNA与心血管疾病的相关性,对于心血管疾病的临床诊疗具有重要的指导意义。miRNA-1属于心肌特异性miRNA,其在心肌发育过程中持续表达,直至心脏发育成熟,并维持高度表达,广泛参与了心脏相关病理生理过程[10-11]。邓海燕等[12]通过体外实验证实,慢病毒转染miRNA-1可促使大鼠骨髓间充质干细胞(mesenchymal stem cells,MSCs)向心肌样细胞分化,而调控Notch信号通路是其可能的作用机制。黄颖等[13]研究表明,利用脂质体瞬时转染技术沉默miRNA-1,可显著降低自发性高血压大鼠左心室肥厚心肌组织中miRNA-1表达水平,并提高自发性高血压大鼠左心室肥厚心肌组织中内向整流钾通道2.1(inward rectifier K channel,Kir2.1)蛋白表达,提示miRNA-1可通过靶向Kir2.1调控静息膜电位,从而诱导心肌细胞电重构。上述研究证实,miRNA-1与心肌细胞分化及心肌细胞电重构密切相关,而这也可能是其参与高血压左心室肥厚的主要机制。本研究ROC曲线分析结果显示,miRNA-1预测高血压左心室肥厚的曲线下面积为0.937(95%CI:0.875~0.962,P<0.05),提示miRNA-1对高血压左心室肥厚具有良好的预测价值,这也为高血压左心室肥厚的早期鉴别诊断提供了新思路。
综上所述,miRNA-1表达与高血压左心室肥厚发生、发展密切相关,miRNA-1可能是高血压左心室肥厚特异性诊断的潜在标志物。但由于本研究纳入样本较少,且未全面排除个体差异影响,故要明确miRNA-1在高血压左心室肥厚中的作用及机制,仍有待开展大样本、多种族、多中心的随机对照研究。
[1]RIPLEY D P,NEGROU K,OLIVER J J,et al.Aortic remodelling following the treatment and regression of hypertensive left ventricular hypertrophy:a cardiovascular magnetic resonance study[J].Clin Experim Hypert,2015,37(4):1-9.
[2]GRAY C,LI M,PATEL R,et al.Let-7 miRNA profiles are associated with the reversal of left ventricular hypertrophy and hypertension in adult male off spring from mothers under nourished uring pregnancy after preweaning growth hormone treatment[J].Endocrinol,2014,155(12):567-568.
[3]MONKEVICIUTE,AISTE.Analysis of microRNA role in the development of left ventricular hypertrophy in the stroke-prone spontaneously hypertensive rat[J].World Health Organiz Aids Techn Bull,2014,2(11):106-107.
[4]CURCIO A,TORELLA D,IACONETTI C,et al.MicroRNA-1 downregulation increases connexin 43 displacement and induces ventricular tachyarrhythmias in rodent hypertrophic hearts[J].Plos One,2013,8(7):70158.
[5]中国高血压防治指南修订委员会.中国高血压防治指南2010[J].中华心血管病杂志,2011,39(7):579-616.
[6]SCHILLACI G,VERDECCHIA P,PORCELLATI C,et al.Continuous relation between left ventricular mass and cardiovascular risk in essential hypertension[J].Hypertension,2000,35(2):580-586.
[7]GABRIELLI L,WINTER J L,GODOY I,et al.Increased rhokinase activity in hypertensive patients with left ventricular hypertrophy[J].Am J Hypert,2014,27(6):838-845.
[8]MA Z,QI J,MENG S,et al.Swimming exercise training-induced left ventricular hypertrophy involves microRNAs and synergistic regulation of the PI3K/AKT/mTOR signaling pathway[J].Eur J Appl Physiol,2013,113(10):2473-2474.
[9]CHUNTAO W U,DONG S,YONGJUN L I.Effects of miRNA-455 on cardiac hypertrophy induced by pressure overload[J].Int J Molec Med,2015,35(4):893-900.
[10] DUAN L,XIONG X,LIU Y,et al.miRNA-1:functional roles and dysregulation in heart disease[J].Molec Bios,2014,10(11):2775-2778.
[11] KURA B,YIN C,FRIMMEL K,et al.Changes of microRNA-1,-15b and-21 levels in irradiated rat hearts after treatment with potentially radioprotective drugs[J].Physiolog Res,2016,65(1):129-137.
[12]邓海燕,曾俊义,魏云峰,等.microRNA-1诱导大鼠骨髓间充质干细胞向心肌样细胞分化过程中Notch信号分子的表达变化[J].基础医学与临床,2014,34(9):1204-1210.
[13]黄颖,伍伟锋.微小RNA-1调控自发性高血压大鼠肥厚左心室心肌组织Kir2.1蛋白的表达[J].中华高血压杂志,2011,19(6):549-552.
Correlation of microRNA-1 expression with hypertensive left ventricular hypertrophy
SI Yu-an
(Jiangyin People′s Hospital of Jiangsu,Jiangyin,Jiangsu 214400,China)
ObjectivesTo evaluate the correlation of microRNA(miRNA-1)expression with hypertensive left ventricular hypertrophy.MethodsThere were 50 hypertensive patients and 50 hypertensive patients with left ventricular hypertrophy selected in this study.MiRNA-1 expression were detected by reverse transcription-polymerase chain reaction(RT-PCR).Correlations of miRNA-1 expression with left ventricular indexes were analyzed.Predictive value of miRNA-1 for hypertensive left ventricular hypertrophy were evaluated by receiver operating characteristic(ROC)curve.ResultsInterventricular septal thickness,left ventricular posterior wall thickness,left ventricular end diastolic dimension,left ventricular mass index and miRNA-1 expression of hypertensive patients with left ventricular hypertrophy were significantly higher than those of hypertensive patients(P<0.05).MiRNA-1 expression positively correlated with interventricular septal thickness(r=0.382,P=0.002),left ventricular posterior wall thickness(r=0.411,P=0.001),left ventricular end diastolic dimension(r=0.285,P=0.023)and left ventricular mass index(r=0.492,P=0.000).Area under ROC curve of miRNA-1 forecasting hypertensive left ventricular hypertrophy was 0.937(95%CI:0.875-0.962,P<0.05).ConclusionsMiRNA-1 expression closely relates to hypertensive left ventricular hypertrophy,and it may be a specific diagnostic marker of left ventricular hypertrophy.
hypertension;microRNA-1;left ventricular hypertrophy
R544.1
A
1007-9688(2017)06-0751-04
10.3969/j.issn.1007-9688.2017.06.27
司煜安(1982-),女,主管技师,研究方向为医学检验。
2017-02-07)

