血清骨桥蛋白水平在急性脑出血患者诊断及预后评价中的价值
向绍通,肖 豪,陈安妮
(广东省人民医院神经内科/广东省医学科学院/广东省老年医学研究所/广东省神经科学研究所,广州 510080)
血清骨桥蛋白水平在急性脑出血患者诊断及预后评价中的价值
向绍通,肖 豪,陈安妮
(广东省人民医院神经内科/广东省医学科学院/广东省老年医学研究所/广东省神经科学研究所,广州 510080)
目的通过分析血清骨桥蛋白(OPN)水平在急性脑出血患者的变化及对预后的影响,探讨OPN在急性脑出血的临床价值。方法选取2014 年1月至2016年12月就诊于该院的急性脑出血患者63例作为急性脑出血组,来该院健康体检者60例作为对照组。收集入组者的相关临床资料,包含吸烟史、血脂、糖尿病、血压、体温、白细胞数、纤维蛋白原等,入院24 h内对脑出血组患者完成脑出血评分,并评定组内患者神经功能缺损严重程度,根据入院时CT影像计算出血量。利用改良Rankin量表(mRS)评分评估脑出血3个月后的预后情况。结果急性脑出血组血清骨桥蛋白[(7.81±4.97)ng/mL]水平明显高于对照组[(5.41±3.25)ng/mL]水平(P=0.008)。 急性脑出血组中预后良好(mRS评分小于4分)37例(58.73%),预后不良(mRS评分大于或等于4分)26例(41.27%)。预后不良组其白细胞数量、出血体积、脑出血评分、脑出血破入脑室比例及OPN水平均明显高于预后良好组(均P<0.05)。通过绘制受试者工作曲线(ROC),得到当OPN的截断点为7.38 ng/mL时,曲线下面积为0.652,敏感度为0.691,特异度为0.627。进行多因素Logistic回归分析显示,血清OPN水平大于7.38 ng/mL(OR=3.916,95%CI:1.023~15.104,P=0.031)及脑出血破入脑室(OR=5.635,95%CI:1.016~26.305,P=0.030)是脑出血预后不良的独立危险因素。结论OPN水平升高,是急性脑出血患者预后不良的独立危险因素,可作为评价脑出血患者预后的参考生物学指标。
骨桥蛋白质;脑出血;mRS评分;预后
脑卒中发病人数逐年增高,并逐渐超过心血管疾病,脑血管疾病现已经成为威胁人类健康的首要疾病,给日益老龄化的社会带来沉重负担[1]。脑卒中即脑血管意外,其包括缺血性脑卒中及出血性脑卒中,与缺血性脑卒中相比,出血性脑卒中的降压治疗更为复杂,并且出血性脑卒中具有更高的病死率[2]。骨桥蛋白(osteopontin,OPN)是一种带负电的非胶原性骨基质糖蛋白,参与骨的代谢,其在骨基质的矿化和吸收过程中有重要作用[3]。近年来研究发现,OPN作为一种多功能蛋白,在心血管尤其是血管重塑过程中起到重要调节作用,其还参与了肿瘤恶化、骨转换、抑制结石形成、伤口愈合、免疫反应、炎性反应等病理、生理过程[4]。OPN属于分泌型细胞外基质蛋白,具有软组织矿化抑制作用,能够阻止血管的异位钙化[5]。虽然已有上述研究,但OPN与急性脑出血的关系及其在急性脑出血中的作用研究很少。本研究通过分析OPN水平在急性脑出血患者的变化及对预后的影响,探讨OPN在急性脑出血中的临床价值。
1 资料与方法
1.1一般资料 选取2014年1月至2016年12月就诊于本院神经内科的急性脑出血患者63例作为急性脑出血组,其中男38例,女25例,平均年龄(70.74±11.82)岁。纳入标准:(1)经颅脑CT检查诊断的患者;(2)每个颅脑CT均经2位资深影像科医师完成诊断且无分歧;(3)年龄50~85岁;(4)首次发病并在24 h内入院;(5)签署知情同意书。排除标准:(1)临床数据不完整的患者;(2)继发性脑出血,如外伤、肿瘤等引起的脑内出血;(3)使用抗血小板或抗凝药物;(4)蛛网膜下腔出血;(5)既往患有脑器质性疾病、肝肾疾病、心脏病、血液系统疾病、自身免疫性疾病、恶性肿瘤。选取2014 年1月 至 2016年 12 月来本院体检健康者60例作为对照组,其中男37例,女23例,平均年龄(68.83±10.34)岁。对照组均签署知情同意书,未使用抗血小板或抗凝药物,且无脑血管疾病、脑器质性疾病、肝肾疾病、心脏病、血液系统疾病、自身免疫性疾病、恶性肿瘤等。急性脑出血组和对照组的性别、年龄差异无统计学意义(P>0.05)。本研究经医院医学伦理委员会批准。
1.2方法
1.2.1临床资料收集 收集入组者的相关临床资料,包含吸烟史、血脂、糖尿病、血压、体温、白细胞数、纤维蛋白原等,并进行进一步诊断学检查,如心电图、血生化、凝血指标、胸片等。入院24 h内对脑出血组患者完成脑出血评分,并评定组内患者神经功能缺损严重程度。依照多田公式根据入院时CT影像计算出血量[出血量(mL)=1/6×π×长(cm)×宽(cm)×高(cm)]。利用改良Rankin量表(mRS)评分评估脑出血3个月后的预后情况,把mRS评分大于或等于4分定义预后不良,把住院期间死亡及3个月后死亡患者也归为预后不良。
1.2.2OPN水平检测 入院24 h内对所有入组者完成肘部静脉血的采集,并把血液样本置于4 ℃的离心机以3 000 r/min离心20 min,收集血清并编码后置于-80 ℃恒温保存,以备检测OPN水平。OPN水平检测采用ELISA法,按照人OPN蛋白试剂盒(北京百奥莱博科技有限公司)说明书进行操作。

2 结 果
2.1对照组和急性脑出血组临床资料和实验室检查结果情况 经比较两组间高血压病、糖尿病的比例差异有统计学意义(均P<0.05)。脑出血组血清OPN水平明显高于对照组(P=0.008),见表1。
2.2不同预后的急性脑出血患者临床资料及实验室检查结果情况 急性脑出血组中预后良好(mRS评分小于4分)37例(58.73%),预后不良(mRS评分大于或等于4分)26例(41.27%)。预后不良组白细胞数、脑出血体积、脑出血评分、脑出血破入脑室比例及OPN水平均明显高于预后良好组(均P<0.05),见表2。
2.3影响急性脑出血预后相关因素的分析 通过绘制ROC,得到OPN的截断点为7.38 ng/mL时,曲线下面积为0.652,敏感度为0.691,特异度为0.627。多因素Logistic回归分析显示,血清OPN>7.38 ng/mL(OR=3.916,95%CI:1.023~15.104,P=0.031)及脑出血破入脑室(OR=5.635,95%CI:1.016~26.305,P=0.030)是脑出血预后不良的独立危险因素,见表3。

表1 急性脑出血组与对照组临床资料和实验室检查结果情况

表2 不同预后的急性脑出血患者临床资料及实验室检查结果情况
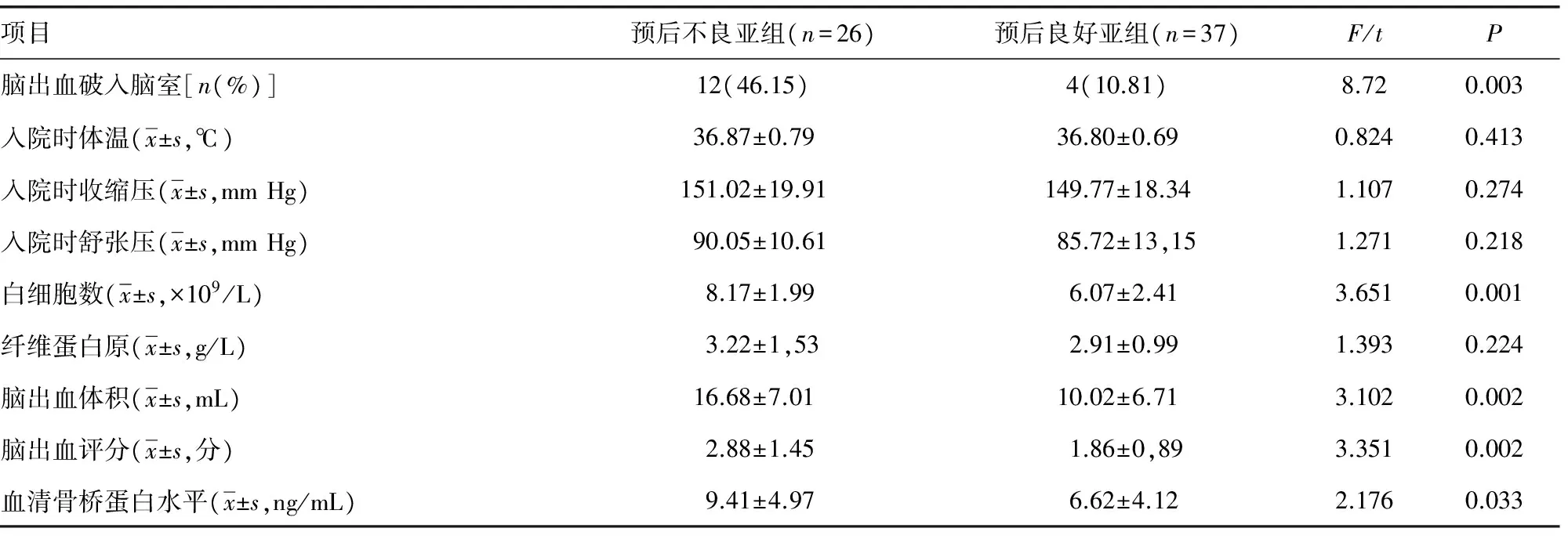
续表2 不同预后的急性脑出血患者临床资料及实验室检查结果情况
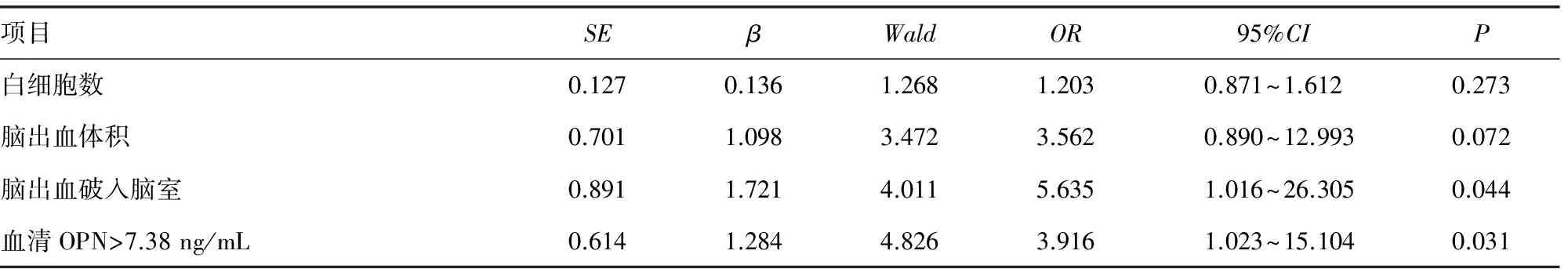
表3 影响急性脑出血预后相关因素Logistic回归分析
3 讨 论
关于血清OPN水平对脑出血预后影响的研究目前国内外鲜有报道。本研究通过检测63例急性脑出血患者及60例健康对照者的血清OPN水平,发现脑出血组血清OPN水平较对照组升高明显,但血清OPN水平与脑出血评分、脑出血体积等危险因素无明显的相关性。预后不良组白细胞数、脑出血体积、脑出血评分、脑出血破入脑室比例及OPN水平也较预后良好组明显升高。Logistic回归分析结果示,血清OPN蛋白大于7.38 ng/mL属于预后不良的独立危险因素。
OPN在机体中有细胞信号分子的作用,其主要由两种机制来完成:(1)通过细胞表面黏附性糖蛋白CD44,以非RGD依赖方式结合;(2)通过分子内RGD与整合蛋白家族分子结合,这两种作用机制介导细胞的黏附、迁移和增殖均通过激活细胞内的特异性信号传导系统[6]。OPN是分泌型细胞外基质中一种重要的功能性蛋白,其能够介导骨组织细胞与骨基质的连接,并且参与骨基质矿化及重吸收的过程[7]。OPN可以阻止血管的异位钙化,其在动脉粥样硬化、动脉钙化及血管成形术后再狭窄发生过程中起到重要作用[8]。OPN也是参与组织重构、炎症的重要因子,在血管生成内皮细胞、巨噬细胞和脉管斑块中平滑肌细胞的表达。有研究发现OPN在大脑局部缺血后可以调节神经母细胞迁移,且能够促进神经的再生。赵佳佳等[9]通过动物实验研究发现OPN可通过减少神经细胞死亡提高神经行为功能、减轻脑水肿,从而降低脑出血的脑损伤。李欣遥等[10]对脑出血患者的临床研究发现,脑出血患者血清OPN水平表达增加,OPN可增强血-脑屏障的稳定性,OPN另一方面可减轻损伤部位神经炎症及细胞死亡,发挥其神经保护功能。
脑出血后,血清OPN水平升高明显并产生保护作用,机制可能是脑出血后炎性介质激活,血中OPN表达上调,阻断了JAK/STAT细胞信号传导通路,抑制诱导型基质金属蛋白酶-9及一氧化氮合酶的表达,从而保护内皮及上皮细胞膜处的紧密连接蛋白,发挥抗炎作用[11]。另外,脑出血后巨噬细胞、小胶质细胞激活,OPN表达增高,OPN可通过诱导神经母细胞增殖、迁移等方式,促进神经再生,利于脑功能的恢复[12]。
Faria等[13]通过制作急性脑出血模型,发现OPN可与整合素β1结合,并通过诱导神经母细胞向受损区域迁移,而促进神经再生,这表明OPN在神经发生及组织修复方面有重要的协调功能,提示OPN可能与脑出血预后相关。Bonestroo等[14]发现重组OPN可以减轻小鼠出血后早期脑损伤。孔令波等[15]也发现,OPN通过抑制诱导性-氧化氮合酶(iNOS)合成可以增强细胞对NO破坏的抵抗力。但本研究发现血清OPN水平升高与脑出血不良预后有关,这看似并不支持OPN具有神经保护功能。然而本研究并不是探究因果关系,也许结果可能是与OPN神经保护作用无效有关。OPN作为一种多功能蛋白,可能在协调积极及消极影响中发挥着重要作用。许多基质金属蛋白酶-s可以切割OPN,这可能与破坏了其中某些结合域,从而限制了OPN的一些有利影响[16]。同样引起相反的细胞反应,可能与被凝血酶切割的OPN暴露了潜在的结合位点相关。有研究报道,在缺血性脑卒中模型中,经凝血酶切割的OPN与完整的OPN比较,有更好地保护神经作用[17]。所以,凝血酶和基质金属蛋白酶-9将OPN切割成不同的片段产生的影响,取决于这些片段的活性及比例。人们曾认为OPN是冠状动脉粥样硬化性心脏病患者的预测指标,但在后来研究中发现,OPN是在接受过冠脉介入手术患者中再次发生心血管事件的独立预测因素。
综上所述,OPN水平升高,是急性脑出血患者预后不良的独立危险因素,OPN水平是评价脑出血患者预后的重要参考生物学指标。本研究由于样本量有限,观察检测时间有限,以及其他不可控因素的影响,需要在以后研究中进一步完善。
[1]孟文婷,李东翔,佟玲.缺血性脑卒中的治疗研究进展[J].中国新药杂志,2016,25(10):1114-1120.
[2]陈庆友,张艳蕉,赵宇,等.复方丹参注射液联合丁苯酞注射液治疗急性缺血性脑卒中的临床研究[J].中国临床药理学杂志,2017,33(2):109-111.
[3]罗伟,张方杰.骨桥蛋白对人膝骨关节炎软骨细胞透明质酸表达的影响[J].中国组织工程研究,2016,20(42):6244-6251.
[4]Chen LY,Liu LB,Li XX,et al.Prognostic significance of osteopontin and carbonic anhydrase 9 in human brain tumors:a Meta-Analysis[J].Mol Neurobiol,2015,52(3):1884.
[5]Gliem M,Krammes K,Liaw L,et al.Macrophage-derived osteopontin induces reactive astrocyte polarization and promotes re-establishment of the blood brain barrier after ischemic stroke[J].Glia,2015,63(12):2198-2207.
[6]范素净,杨秀红.骨桥蛋白在高血压及其靶器官损害中的研究进展[J].生理科学进展,2016,47(2):113-118.
[7]Huerta A,López B,Ravassa S,et al.Association of cystatin C with heart failure with preserved ejection fraction in elderly hypertensive patients:potential role of altered collagen metabolism[J].J Hypertens,2016,34(1):130-138.
[8]李晓涛,夏岳,郭喜朝,等.血浆骨桥蛋白水平与冠状动脉病变狭窄程度的关系研究[J].中国循环杂志,2011,26(4):271-274.
[9]赵佳佳,桂淑玉,王小扁,等.肺动脉粥样硬化兔肺动脉壁骨桥蛋白表达的变化[J].安徽医科大学学报,2012,47(1):5-8.
[10]李欣遥,张良荣,韩冬,等.脑出血患者血清骨桥蛋白水平的变化及其对预后的影响[J].临床神经病学杂志,2015,28(6):413-416.
[11]Francia P,Balla C,Ricotta A,et al.Plasma osteopontin reveals left ventricular reverse remodelling following cardiac resynchronization therapy in heart failure[J].Int J Cardiol,2011,153(3):306-310.
[12]冯昕,曲迅,王东海,等.脑胶质瘤患者血清骨桥蛋白水平的测定及其临床意义[J].中华外科杂志,2011,49(2):174-175.
[13] Faria M,Halquist MS,Yuan M,et al.An extended stable isotope-labeled signature peptide internal standard for tracking immunocapture of human plasma osteopontin for LC-MS/MS quantification[J].BMC,2015,29(11):1780-1782.
[14]Bonestroo HJ,Nijboer CH,Van Velthoven CT,et al.The neonatal brain is not protected by osteopontin peptide treatment after Hypoxia-Ischemia[J].Dev Neurosci,2015,37(2):142-152.
[15]孔今波,任伟光,米红梅,等.小鼠酒精性肝纤维化复合模型的建立及肝组织骨桥蛋白和转化生长因子β1的表达[J].中华肝脏病杂志,2013,21(3):207-212.
[16]曾涛,陈衔城,宫晔,等.骨桥蛋白在脑动静脉畸形栓塞治疗中的意义[J].中华外科杂志,2007,45(12):849-851.
[17]李欣遥,张良荣,张硕,等.急性脑梗死患者血清骨桥蛋白水平的改变及其对预后的影响[J].中风与神经疾病杂志,2016,33(3):211-214.
向绍通(1980-),主治医师,硕士,主要从事神经系统变性疾病及脑血管病研究。
10.3969/j.issn.1671-8348.2017.34.029
R816.1
B
1671-8348(2017)34-4838-04
2017-08-11
2017-09-12)

