11β-HSD1和11β-HSD2在妊娠期糖尿病患者胎盘组织中的差异表达及临床意义
马 蓉,刘 建,肖晓秋
(1.新疆医科大学第一附属医院妇产科,乌鲁木齐 830000;2.重庆医科大学附属第二医院妇产科 400010;3.重庆医科大学脂糖代谢实验室 400016)
论著·临床研究
11β-HSD1和11β-HSD2在妊娠期糖尿病患者胎盘组织中的差异表达及临床意义
马 蓉1,刘 建2△,肖晓秋2
(1.新疆医科大学第一附属医院妇产科,乌鲁木齐 830000;2.重庆医科大学附属第二医院妇产科 400010;3.重庆医科大学脂糖代谢实验室 400016)
目的研究妊娠糖尿病患者胎盘组织中11β-羟类固醇脱氢酶(11β-HSD1)和11β-HSD2基因和蛋白表达的变化及意义。方法选择妊娠期糖尿病(GDM)和糖耐量正常孕妇(NGT)各30例,化学发光法测定皮质醇、胰岛素的水平,免疫组织化学法检测11β-HSD1和11β-HSD2在胎盘的表达部位,分别运用荧光定量PCR(real time PCR)和Western blot法测试11β-HSD1和11β-HSD2基因和蛋白水平的差异表达。结果与NGT组相比,GDM组空腹胰岛素、HOMA-IR、胰岛素分泌指数、母血皮质醇水平明显增高(P<0.05),而空腹血糖、胎儿脐血皮质醇则差异无统计学意义(P>0.05)。1β -HSD1和11β-HSD2均在胎盘中有表达,表达部位及水平不同。real time-PCR和Western blot检测结果提示GDM组胎盘11β -HSD1 mRNA和蛋白的表达明显低于NGT组(P<0.05),11β -HSD2 mRNA明显高于NGT组(P<0.05),而蛋白水平差异无统计学意义(P>0.05)。结论妊娠期糖尿病胎盘组织11β-HSD1和11β-HSD2差异表达调整免除母体不佳的妊娠环境将会给胎儿造成的长远伤害。
糖尿病,妊娠;11β-HSDs;氢化可的松;胰岛素抗药性
妊娠期糖尿病(GDM)是指在妊娠期间首次发现的糖耐量异常。GDM会引起多种母婴并发症,尤其是对胎儿产生负面影响。它属于成人疾病胎儿发病的关键致病因素之一。GDM母亲所孕育的孩子在进入成年易出现肥胖、糖耐量异常等各种疾病。明确GDM所造成的危险及相应预防措施,抑制孕期出现糖代谢紊乱并有效限制GDM发病率的上升是极为重要的。其中,糖皮质激素不仅会对孕后期的胎儿发育造成影响,而且会推动孕妇分娩发动[1]。然而胎儿假如置于糖皮质激素水平过高的环境之内,极易出现病理妊娠,如胎儿发育缓慢、增大早产概率、出现先兆子痫症状等。在妊娠期间,母体所含皮质醇的水平极高,和脐静脉血相比,它要多出5倍以上[2],这意味着胎盘组织之内有着调整糖皮激素的有效阻隔,是一个生理屏障。当前针对这一胎盘屏障所具备的分子特性依然很少人知道。在人体之内,11β-羟类固醇脱氢酶(11β-HSDs)能够让活性的皮质醇和无活性的皮质酮不断向对方转变,进而调整部分靶器官糖皮质激素相应的活性,11β-HSD主要包含两种类型:11β-HSD1和11β-HSD2。在妊娠过程中,胎盘滋养细胞能够表达11β-HSDs[3]。本文旨在探讨GDM患者血清及胎脐血皮质醇变化,通过母体-胎盘-胎儿循环来分析GDM胎盘组织中调节皮质醇代谢的11β-HSD1和11β-HSD2基因及蛋白出现相应的表达转变情况,现报道如下。
1 资料与方法
1.1一般资料 挑选2010年12月至2013年1月在重庆医科大学附属第二医院产科就诊的30例实施剖宫产的GDM孕妇为研究对象,将之确定为GDM组,平均年龄(29.40±1.00)岁,平均孕前BMI(21.61±0.81)kg/m2,平均孕周(38.90±0.60)周,经过诊断,查出妊娠期糖尿病的周期多在妊娠24~28 周,这一类型的孕妇可以借助饮食和运动来调控血糖,效果大致符合预期。选取同期糖代谢正常的孕妇30例作为对照组(NGT组),平均年龄(30.90±0.50)岁,平均孕前BMI(22.23±0.51)kg/m2,平均孕周(38.30±0.70)周,GDM诊断标准参照妇产科学第8版教材[4]。两组孕妇都没有高血压及肝肾功能异常的病症,也没有表现出多囊卵巢综合征的症状,它们在年龄、孕周等指标方面的差异无统计学意义(P>0.05)。在患者认可之后签订知情同意书收集患者血液,以及各自的胎盘组织样本。新生儿体质量经清理呼吸道后使用电子秤称取。
1.2方法
1.2.1标本收集 (1)手术当天抽取两组孕妇空腹肘静脉血,母血之内各个生化指数监测运用全自动生化分析仪对之进行解析。在胎盘娩出之后,即刻收集脐带血,将血清分离之后放于-20 ℃冰箱进行保存待检测;(2)在胎盘完全分娩之后,保证无菌环境,从脐带根部胎盘母面中部提取检测对象,尺寸为1.5 cm×1.5 cm,不能挑选机化或者钙化的部分,运用磷酸盐缓冲液(PBS)前后冲洗3次,将组织分割为3份,其中1份置于4%多聚甲醛之内,将之固定24 h之后实施脱水,使用蜡块进行封存固定,另一份置于-80 ℃冰箱待用。
1.2.2临床指标监测 葡萄糖氧化酶法测验血糖,化学发光法监测空腹胰岛素,运用全自动生化分析仪对其相应的生化指标进行监测,运用稳态模型评估法(HOMA)求解胰岛素抵抗指数(HOMA-IR)。母亲静脉血皮质醇、新生儿脐血皮质醇水平测定采用化学发光法。
1.2.3胎盘组织中11β-HSD1和11β-HSD2 蛋白表达测定 (1)一抗蛋白孵育:把稳定好的胎盘组织封存为蜡块,对之进行切片,去除玻片上的蜡块,使用梯度乙醇进行脱水,运用PBS冲洗2~3次,每次5 min后,枸橼酸盐缓冲液进行热修复,PBS冲洗3次,每次5 min。在玻片之上滴入3%H2O2,室温静置10 min,PBS洗3次,每次3 min。11β-HSD1蛋白检测运用免疫组织化学(SP)法。而11β-HSD2蛋白检测加入一般山羊血清对之进行封闭,保持37 ℃,20 min后添加10 μL一抗,保持37 ℃恒温2 h,按照说明书准则,一抗稀释比例1∶100,PBS 洗3次,每次3 min。(2)二抗IgG标记:11β-HSD1蛋白加入Polymer Helper,测试环境37 ℃,PBS冲洗3次之后,添加poly-HRP anti -Goat IgG,其测试环境和相关操作程序如上。11β-HSD2蛋白直接加入HRP,对山羊抗兔IgG进行标记,依然保持37 ℃恒温,孵育20 min,PBS 洗3次,每次3 min。(3)显色及封片:DAB显色5~10 min,通过显微镜把握染色程度。使用PBS或自来水进行冲洗,维持10 min,运用苏木精进行复染,维持4 min,运用碳酸锂对颜色进行固定,保持30 s,之后再运用盐酸乙醇对之进行分化,保持2 s,通过自来水进行冲洗,保持10~15 min,通过梯度乙醇进行脱水,通过中性树胶进行封片,给予镜检:棕黄色着色为阳性。
1.2.4实时荧光定量PCR(real time-PCR)法检测胎盘组织中11β-HSD1和11β-HSD2水平 (1)引物合成:由上海鼎安生物科技有限公司负责合成,11β-HSD1引物序列(正向:5′-AAG TTG CAG TGA GCC GAG ATC-3′;反向:5′-TTC CGA GGC AGA GTC TTG CT-3′,AY044083)。11β-HSD2引物序列(正向:5′-GGC CAA GGT TTC CCA GTG A-3′;反向:5′-GAG GGT GTT TGG GCT CAT GA-3′,NM_000196);(2)组织总RNA的提取:取100 mg胎盘组织,加入Trizol 1 mL,抽取胎盘总RNA,操作以说明书为准。取2 μg RNA进行反转录反应,所用反转录试剂盒来自于大连TaKaRa公司。(3)real time-PCR监测基因表达:对cDNA进行稀释,保持原含量的1/10,取2 μL与SYBR premix Ex Taq Ⅱ(TaKaRa)及引物开展PCR反应,将原体系扩增至10 μL,反应条件:95 ℃ 3 min;95 ℃ 变性10 s,退火 60 ℃ 30 s,65 ℃ 5 s,39个循环,溶解曲线保持在65~95 ℃,β-actin做内参,所生成的物品的特异性运用溶解曲线给予评定,最终定量结果用2-△△Ct给予计算。
1.2.511β-HSD1和11β-HSD2蛋白表达的测定 取胎盘组织80 mg,通过裂解液及电动匀浆器对之进行匀浆处理,保持4 ℃低温离心15 min,提取上清液蛋白。(2)通过BCA蛋白定量试剂进行(厂家:自碧云天生物公司)定量,提取80 μg蛋白加入5×上样缓冲液100 ℃煮沸10 min。12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),操作完成后,将之转移到聚偏氟乙烯(PVDF)膜上,5%牛奶,室温下封闭1 h,11β-HSD1、11β-HSD2一抗(1∶1 000,Santa Cruze公司),室温环境下加一抗孵育1 h,4 ℃过夜;TBST漂洗;室温状态下二抗(1∶3 000)孵育1 h。(3)ECL显影成像。Quantity One软件解析两组灰度比值确定蛋白11β-HSD1和11β-HSD2相对表达量。
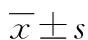
2 结 果
2.1临床资料分析 与NGT组比较,GDM组患者经过内分泌科严格饮食控制和适量运动,手术当天空腹血糖[(4.60±0.20)mmol/Lvs.(4.60±0.10)mmol/L],差异无统计学意义(P>0.05);与NGT组比较手术当天GDM组空腹胰岛素[(12.93±1.50)mU/Lvs. (19.95±1.05)mU/L]、HOMA-IR(2.87±0.4vs. 4.54±0.67)、胰岛素分泌指数(53.15±5.58vs. 80.55±6.18)明显升高,差异有统计学意义(P<0.05),见表1。
2.2皮质醇变化及相关性分析 与NGT组的母血皮质醇水平[(934.10±45.92)nmol/L]比较,GDM组[(1 110.0±40.9)nmol/L]明显升高,差异有统计学意义(P<0.05),见图1A。而两组之间的脐血皮质醇及新生儿体质量差异无统计学意义(P>0.05),见图1B、C。将两组胎儿皮质醇的监测结果进行对比,新生儿的体质量与其母血及胎儿脐血皮质醇水平不相关(图1D),而与胎儿脐血皮质醇水平呈现负相关关系(r=-0.31,P=0.01),见图1E。
2.3免疫组织化学结果 11β-HSD1蛋白广泛遍布于绒毛及干绒毛的合体滋养层外层、绒毛间质;11-β-HSD2表达集中分布于绒毛合体滋养层细胞外层,见图2。
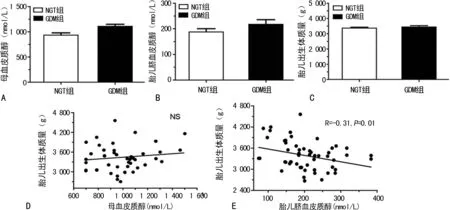
A:母血皮质醇;B:胎儿脐血皮质醇;C:胎生出生体质量;D:母血皮质醇与胎儿出生体质量的关系;E:胎儿脐血皮质醇与胎儿出生体质量的关系
图1母血、脐血皮质醇变化及与胎儿体质量变化及相关性分析

A:绒毛合体滋养层外层(11β-HSD1);B:干绒毛的合体滋养层;C:绒毛间质(11β-HSD1);D:绒毛合体滋养层(11β-HSD2)
图2 11β-HSD1蛋白和11β-HSD2蛋白在胎盘中的表达部位

a:P<0.05
图3 real time-PCR结果

图4 Western blot结果
2.411β-HSD1、11β-HSD2基因及蛋白水平表达 real time-PCR结果提示GDM组胎盘11β-HSD1 mRNA的表达明显低于NGT组(0.56±0.09vs. 1.36±0.36,P<0.05)。11β-HSD2 mRNA明显高于NGT组(5.17±1.02vs. 1.21±0.34,P<0.05)。Western blot法结果提示GDM组胎盘11β-HSD1 蛋白水平的表达明显低于NGT组(0.27±0.07vs.1.00±0.19,P<0.05),而11β-HSD2蛋白水平差异无统计学意义(1.30±0.19vs.1.00±0.14,P>0.05)。见图3、4。
3 讨 论
当前,针对GDM的探究大多认与胰岛素抵抗有关,GDM患者多数出现胰岛素敏感性下降,其抵抗情况加剧,脂代谢出现异常[5]。当前的研究大多围绕与胰岛素抵抗有关的因子进行,例如瘦素、脂联塑等。出现脂肪代谢异常及体型肥胖的患者一般均会出现血清瘦素、脂联素水平下降,抵抗素增加。且胰岛素抵抗及Ⅱ型糖尿病的发病率更高[6-7]。胎盘是连接母体及胎儿的主要器官,能够生成激素和酶。对于妊娠期孕妇而言,糖皮质激素能够对胰岛素产生一定对抗。它可以通过葡萄糖所进行的跨膜运转,改变胰岛素的受体来改变胰岛素相应的敏感性。同时,它还可以直接干扰胰岛素抵抗的生成,而胰岛素β细胞也许是它引起糖尿病的主要靶点[8]。在孕妇体内,糖皮质激素通过皮质醇的方式发生作用。它可影响胎儿发育,胎儿长时间处于高皮质醇环境之内,会导致低体质量儿的发病率提升。
本研究选择的对象为妊娠期糖尿病患者,通过调整饮食和血糖,手术当日GDM组空腹血糖水平保持正常,然而仍然有胰岛素抵抗特征。经过监测,和GDM组胰岛素抵抗相对的,GDM组母血皮质醇水平也有明显提高,但是胎儿脐血皮质醇水平及胎儿的体质量都未出现显著改变。因此,新生儿的体质量,不受到母血皮质醇的影响,而胎儿脐血皮质醇水平与之存在负相关关系。在母体血液-胎盘-脐血的血流运行过程中,母体出现高皮质醇血病的占比增长,而胎儿脐血皮质醇变动不大。母体循环及脐血皮质醇中间的差别也许是胎盘部分调整糖皮质激素的因子具有屏障效用。而在胎盘之内,具有此种效用的分子为11β-HSDs,它们能够催化活性的皮质醇和无活性的皮质酮之间的相互转化,从而调节局部糖皮质激素的活性。11β-HSD1属于同时兼具氧化和还原双重效用的酶,在体内主要发挥还原酶的效用,将会让糖皮质激素增加。而氧化反应则要求有NADP+/NADPH参加。11β-HSD2只发挥氧化酶的效用,使皮质醇转变为皮质酮,可以削减糖皮质激素的影响,而发生还原反应则要有NAD+的参加[9]。
对于妊娠期患者而言,胎盘是其内分泌器官的一部分,不仅能够生成蛋白类激素,而且还具有类固醇激素的效用[10,11]。妊娠期患者,能够检查到11β-HSDs的表达。11β-HSD1则遍布于绒毛单位间质等部位,11β-HSD2大多位于绒毛合体滋养层,这意味着在胎盘绒毛组织之内,调整糖皮质激素代谢过程的屏障因子有一定的位置。real time-PCR显示:GDM组胎盘11β-HSD1 mRNA的表达更为明显,而NGT组之内11β-HSD2的表达更为突出。Western blot法的检查结果显示,GDM之内的11β-HSD1水平较低,而11β-HSD2水平增长无统计学意义。在GDM组出现病理妊娠的时候,其对糖皮质激素的影响削弱。有资料证明,低体质量儿体内的脐血皮质醇显著增长,而其胎盘组织之内的11β-HSD2的影响下降[12-13],原因大概是这一物质的屏障效应失活导致的脐血皮质醇水平紊乱,皮质醇借助胎盘导致胎儿部分受损[14]。目前普遍接受的观点认为妊娠状态下,无论是胎盘11β-HSD2的表达,还是糖皮质激素的分泌,都被各类病理要素干扰。近年,11β-HSD2的代谢调整成为研究热门。它是胎盘糖皮质激素能够发挥屏障作用主要物质,可造成母体流入大量皮质醇,导致胎儿发育受损。本实验通过饮食调整的GDM患者,在其胎盘之内,11β-HSD1表达的下降而11β-HSD2表达的升高对胎儿脐血皮质醇水平的平稳有一定影响,前者的下降也许影响了转录和翻译进程,而后者的升高仅影响转录。此种保护机制调整的缘由有待于进一步探讨研究。11β-HSD1和11β-HSD2基因可作为新的研究基因靶点,用来研究中国人群的11β-HSD1和11β-HSD2基因的微卫星多态性与胎儿发育、孕晚期胎儿器官发育及妊娠之间的关系。
[1]Mericq V,Medina P,Kakarieka E,et al.Differences in expression and activity of 11beta-hydroxysteroid dehydrogenase type 1 and 2 in human placentas of term pregnancies according to birth weight and gender[J].Eur J Endocrinol,2009,161(3):419-425.
[2]Clarke KA,Ward JW,Forhead AJ,et al.Regulation of 11 beta-hydroxysteroid dehydrogenase type 2 activity in ovine placenta by fetal cortisol[J].J Endocrinol,2002,172(3):527-534.
[3]Sun K ,Yang K ,Challis JR.Differential expression of 11 beta-hydroxysteroid dehydrogenase types 1 and 2 in human placenta and fetal membranes[J].J Clin Endocrinol Metab,1997,82(1):300-305.
[4]谢幸,苟文丽.妇产科学[M].8版.北京:人民卫生出版社,2013:75-79.
[5]Yang H,Wei Y,Gao X,et al.Risk factors for gestational diabetes mellitus in Chinese women:a prospective study of 16 286 pregnant women in China[J].Diabet Med,2009,26(11):1099-1104.
[6]Seckl JR,Holmes MC.Mechanisms of disease:glucocorticoids,their placental metabolism and fetal ′programming′ of adult pathophysiology[J].Nat Clin Pract Endocrinol Metab,2007,3(6):479-488.
[7]Clausen TD,Mathiesen ER,Hansen T,et al.High prevalence of type 2 diabetes and pre-diabetes in adult offspring of women with gestational diabetes mellitus or type 1 diabetes:the role of intrauterine hyperglycemia[J].Diabetes Care,2008,31(2):340-346.
[8]Chapman K,Holmes M,Seckl J.11β-hydroxysteroid dehydrogenases:intracellular gate-keepers of tissue glucocorticoid action[J].Physiol Rev,2013,93(3):1139-1206.
[9]Gathercole LL,Bujalska IJ,Morgan SA,et al.Glucocorticoid and insulin regulation of lipogenesis in human adipose tissue[J].Endocr J,2010,57(2):S408.
[10]Johnstone JF,Bocking AD,Unlugedik E,et al.The effects of chorioamnionitis and betamethasone on 11beta hydroxysteroid dehydrogenase types 1 and 2 and the glucocorticoid receptor in preterm human placenta[J].J Soc Gynecol Investig,2005,12(4):238-245.
[11]Julan L,Guan H,Van Beek JP,et al.Peroxisome proliferator-activated receptor delta suppresses 11beta-hydroxysteroid dehydrogenase type 2 gene expression in human placental trophoblast cells[J].Endocrinology,2005,146(3):1482-1490.
[12]Clarke KA,Ward JW,Forhead AJ,et al.Regulation of 11 beta-hydroxysteroid dehydrogenase type 2 activity in ovine placenta by fetal cortisol[J].J Endocrinol,2002,172(3):527-534.
[13]Bertram C,Trowern AR,Copin N,et al.The maternal diet during pregnancy programs altered expression of the glucocorticoid receptor and type 2 11beta-hydroxysteroid dehydrogenase:potential molecular mechanisms underlying the programming of hypertension in utero[J].Endocrinology,2001,142(7):2841-2853.
[14]Tzschoppe A,Struwe E,Blessing H,et al.Placental 11beta-HSD2 gene expression at birth is inversely correlated with growth velocity in the first year of Life after intrauterine growth restriction[J].Pediatr Res,2009,65(6):647-653.
Differentialexpressionofplacentaltissue11β-HSD1and11β-HSD2inpatientswithgestationaldiabetesmellitus
MaRong1,LiuJian2△,XiaoXiaoqiu3
(1.DepartmentofGynecologyandObstetrics,theFirstAffiliatedHospitalofXinjiangMedicalUniversity,Xinjiang,Urumqi830000,China;2.DepartmentofGynecologyandObstetrics,theSecondAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400016,China;3.LipidSugarMetabolismLaboratory,theFirstAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400016,China)
ObjectiveTo study the changes and significance of 11β-HSD1 and 11β-HSD2 gene and protein expression in placenta of patients with gestational diabetes mellitus.MethodsThirty pregnant women with gestational diabetes mellitus (GDM) and normal glucose tolerance (NGT) were selected.Chemiluminescence was used to determine the serum cortisol,neonatal cord blood cortisol and fasting insulin ect.Immunohistochemistry was used to detect the expression location of 11β-HSD1 and 11β-HSD2 in the placenta.The differential expression of 11β-HSD1 and 11β-HSD2 genes and proteins were detected by real-time PCR and Western blot.ResultsCompared with NGT group,fasting insulin,HOMA-IR,insulin secretion index and maternal serum cortisol level were significantly increased in GDM group [(19.95±1.05) mU/Lvs. (12.93±1.50) mU/L,4.54±0.67vs. 2.87±0.43,80.55±6.18vs. 53.15±5.58,(1 110.00±40.91) nmol/Lvs. (934.1±45.92) nmol/L,P<0.05)],but there were no significant differences were found in fasting blood glucose and cord blood cortisol(P>0.05).The distribution of 11β-HSD1 in the placenta was distributed in the outer layer of villous syncytiotrophoblast,villous interstitial and dry villi.The expression of 11β-HSD2 was concentrated in the outer layer of villous syncytiotrophoblast.Real time-PCR and Western blot results showed that the expression of 11β-HSD1 mRNA and protein in placenta of GDM group was significantly lower than that of NGT group (0.56±0.09vs. 1.36±0.36,0.27±0.07vs. 1.00±0.01,P<0.05 ),11β-HSD2 mRNA was significantly higher than NGT group (5.17±1.02 and 1.21±0.34 respectively,P<0.05),but no significant difference was found in protein level (P>0.05).ConclusionThe differential expression of 11β-HSD1 and 11β-HSD2 in placenta of gestational diabetes mellitus can avoid the maternal poor pregnancy environment,but will cause long-term harm to the fetus.
] diabetes,gestational;11β-HSDs;hydrocortisone;insulin resistance
马蓉(1984-),主治医师,硕士,主要从事妇产科代谢疾病研究。△
,E-mail:Liu6898@sina.com。
10.3969/j.issn.1671-8348.2017.36.029
R714.256;R587.1;R363
A
1671-8348(2017)36-5126-04
2017-08-10
2017-09-26)

