Wnt3a通过整合素连接激酶调节血管平滑肌细胞迁移和黏附*
吴校林,朱 锐,李 彬,刘文卫,周 青,赵玉勤
(湖北文理学院附属襄阳市中心医院心血管内科,湖北襄阳 441000)
论著·基础研究
Wnt3a通过整合素连接激酶调节血管平滑肌细胞迁移和黏附*
吴校林,朱 锐△,李 彬,刘文卫,周 青,赵玉勤
(湖北文理学院附属襄阳市中心医院心血管内科,湖北襄阳 441000)
目的探讨重组Wnt3a蛋白对大鼠血管平滑肌细胞(VSMCs)迁移和黏附的影响及相关机制。方法原代培养大鼠VSMCs,实验分为Wnt3a组和对照组,通过Transwell实验检测VSMCs的迁移能力,细胞基质黏附实验检测VSMCs黏附细胞外基质的能力,Western blot检测VSMCs中β-连环蛋白(β-catenin)、磷酸化β-catenin(Ser675)、糖原合成激酶3β(GSK-3β),磷酸化GSK-3β(Ser9)、整合素连接激酶(ILK)的蛋白表达水平。结果Wnt3a组中VSMCs迁移的数量明显高于对照组(P<0.05)。与对照组相比,Wnt3a组中VSMCs黏附于胶原Ⅰ的数量和光密度值均显著增加(P<0.05),且Wnt3a组中磷酸化β-catenin(Ser675)、磷酸化GSK-3β(Ser9)和ILK蛋白的表达水平均显著上调(P<0.05)。结论Wnt3a可以通过ILK调节VSMCs迁移和黏附。
Wnt蛋白质类;肌,平滑,血管;细胞运动;细胞黏附;蛋白质丝氨酸苏氨酸激酶
Wnt蛋白通过分泌作用与位于细胞膜上的受体相结合,激活细胞内信号通路,调节靶基因的表达,控制细胞的生理行为和生物进程,包括细胞黏附、迁移、分化、增殖、极性与凋亡等[1]。Wnt信号传导通路分为经典Wnt信号通路和非经典Wnt信号通路,其中经典Wnt信号通路,即Wnt/β-连环蛋白(β-catenin)通路是Wnt信号中研究最清楚的一条通路,在整个进化过程中高度保守,Wnt3a可以激活经典Wnt信号通路。当经典Wnt信号通路活化时,Wnt与受体Fzd结合,引起β-catenin在细胞内累积,并进入细胞核与淋巴细胞增强因子、T细胞因子形成复合物,激活下游靶基因的转录[1-3]。β-catenin的活性也受到整合素连接激酶(integrin-linked kinase,ILK)的调节,ILK是一种丝氨酸/苏氨酸蛋白激酶,它可以与胞质区的β1和β3整合素结合,控制细胞外基质与细胞骨架的连接,从而调节细胞迁移和黏附[4-5]。研究发现ILK磷酸化后可以促进β-catenin核易位并与淋巴细胞增强因子形成复合物[6]。本研究采用重组Wnt3a蛋白激活Wnt/β-catenin通路,观察其对大鼠血管平滑肌细胞(vascular smooth muscle cells,VSMCs)迁移和黏附的影响并探讨相关的作用机制。
1 材料与方法
1.1材料与试剂 Sprague-Dawley 雄性大鼠购自武汉大学动物实验中心,体质量100~150 g,许可证号SCXK(鄂)2008-0004。重组Wnt3a蛋白购自美国R&D公司,抗β-catenin和磷酸化β-catenin(Ser675)抗体均购自美国Cell Signaling公司,抗糖原合酶激酶3β(GSK-3β),磷酸化GSK-3β(Ser9)和α肌动蛋白(α-actin)抗体均购自美国Santa Cruz公司,胶原Ⅰ和抗ILK抗体购自美国Sigma公司,相关二抗购自武汉博士德生物工程有限公司。DMEM培养液、胎牛血清(fetal bovine serum,FBS)购自美国HyClone公司。Transwell小室购自美国Corning公司。
1.2方法
1.2.1VSMCs原代培养 无菌条件下分离Sprague-Dawley大鼠胸主动脉,小心去除外膜和内膜,将中层平滑肌切成1 mm2左右的组织块,用含20% FBS的DMEM培养液行组织块贴壁法原代培养VSMCs;在37 ℃、5% CO2条件下静置培养,3 d后更换培养液。待单层细胞覆盖细胞培养皿约80%时,取出组织块进行传代。用0.25%胰蛋白酶消化细胞,含10% FBS、2 mmol/L谷氨酰胺、100 μg/mL链霉素、100 U/mL青霉素的DMEM培养液行传代培养。实验采用融合度90%左右的第3~4代VSMCs。细胞鉴定采用α-actin免疫荧光染色。实验分两组,对照组[无菌磷酸盐缓冲液(PBS)处理]和Wbt3a组(终浓度为100 ng/mL的重组Wnt3a处理)。
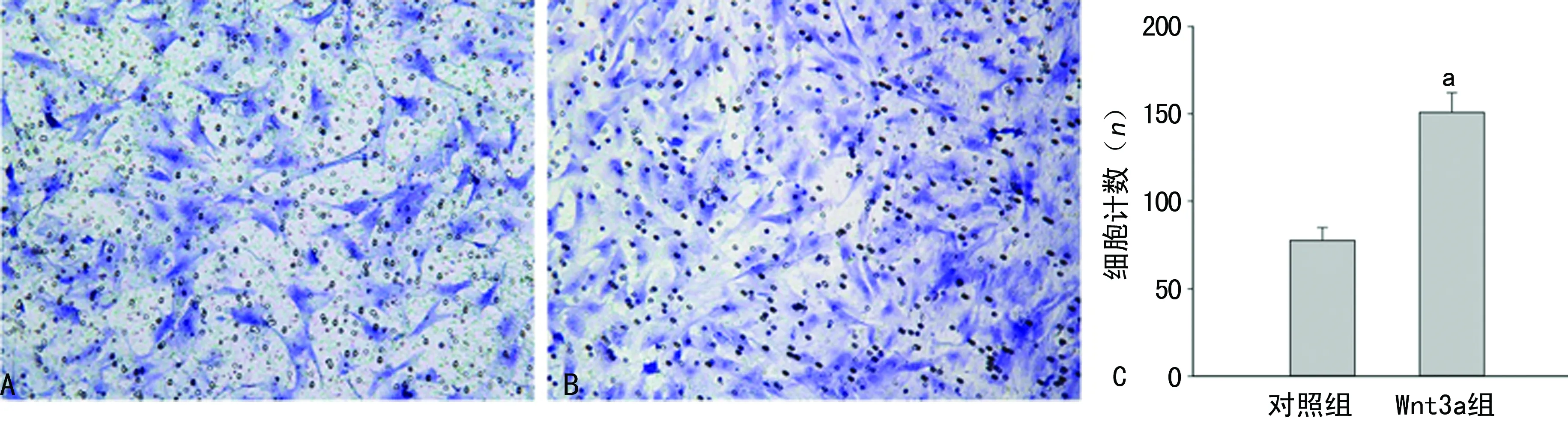
A:对照组;B:Wnt3a组;C:Transwell实验分析图;a:P<0.05,与对照组比较
图1 Transwen实验检测Wnt3a对VSMCs迁移能力的影响
1.2.2Transwell检测 采用Transwell小室法检测VSMCs迁移,在24孔培养板插入直径6.5 mm、硝酸纤维素滤膜孔径为8 μm的小室,上室加入无血清培养液的VSMCs(3×105个/mL) 100 μL,下室加入含10% FBS的培养液600 μL,于培养箱中作用24 h后取出滤膜,棉签小心去除上层未迁移细胞,常温下无水甲醇固定20 min,0.1%结晶紫染色15 min,双蒸水冲洗后,取下滤膜,下室朝上于显微镜下照相。每组设4个小室,每个滤膜上选择5个视野计数取平均值,实验重复3次。
1.2.3细胞基质黏附检测 96孔板包被胶原Ⅰ(20 μg/mL),在4 ℃下过夜,PBS冲洗后用1%牛血清清蛋白(BSA)在室温下阻断1 h,再用无血清的DMEM培养基冲洗,每孔接种3×104个VSMCs,37 ℃孵育1 h,PBS冲洗后,4%多聚甲醛室温下固定30 min,0.5%甲苯胺蓝染色15 min,双蒸水冲洗后在显微镜下照相,每孔随机选取5个视野并计数。最后经1%十二烷基硫酸钠(SDS)裂解细胞后,酶标仪(Infinite M200 Pro)590 nm测光密度(optical density,OD)值。
1.2.4Western blot分析 VSMCs用100 ng/mL的重组Wnt3a蛋白或无菌PBS处理3 d后收集VSMCs,加入含苯甲基磺酰(PMSF)的RIPA裂解液,冰上放置30 min,4 ℃下12 000 r/min 离心40 min,取上清。以BSA为标准,用Bradford比色法对上清进行蛋白定量。取20 μg蛋白样品,10% SDS-聚丙烯酰胺凝胶(PAGE)电泳,100 V转移约1 h,溴酚蓝到达分离胶的底端即可停止电泳。再将蛋白电泳转移至硝酸纤维素薄膜(PVDE)上,放入封闭液中37 ℃封闭1 h;加入抗β-catenin、磷酸化β-catenin(Ser675)、GSK-3β,磷酸化GSK-3β(Ser9)、ILK抗体,4 ℃过夜,反复洗膜后,将膜与二抗孵育,室温轻摇1 h,洗膜后采用增强化学发光检测系统进行观察。
2 结 果
2.1Wnt3a促进VSMCs迁移 Transwell实验显示Wnt3a组VSMCs迁移的数量明显高于对照组(P<0.05),提示Wnt3a刺激后可以显著增加VSMCs的迁移能力,见图1。
2.2细胞基质黏附检测 结果显示Wnt3a组中VSMCs黏附于胶原Ⅰ的数量较对照组明显增加(P<0.05)。另外,Wnt3a组的OD值也明显增加(P<0.05),见图2。提示Wnt3a具有提高VSMCs黏附胶原Ⅰ的能力。
2.3Western blot分析结果 为了检测Wnt3a影响VSMCs迁移和黏附的相关机制,笔者使用Western blot技术检测VSMCs中β-catenin,磷酸化β-catenin(Ser-G75),GSK- 3β、磷酸化GSK-3β(Ser)和ILK蛋白水平的表达。结果显示使用Wnt3a蛋白刺激后,VSMCs中磷酸化β-catenin(Ser675)、磷酸化GSK-3β(Ser9)和ILK蛋白的表达水平均显著上调(P<0.05),但是两组中总的β-catenin和总的GSK-3β的蛋白水平表达没有明显变化(P>0.05),见图3。
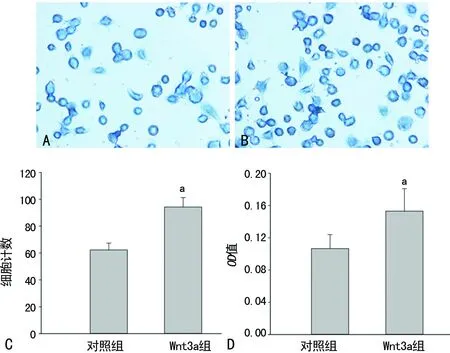
A:对照组;B:Wnt3a组;C:细胞黏附实验分析图(细胞计数),D:细胞黏附实验分析图(OD值);a:P<0.05,与对照组比较
图2两组大鼠VSMCs基质黏附能力比较

A:Western blot;B:Western blot分析图
图3两组VSMCs细胞中Wnt相关蛋白表达水平比较
3 讨 论
目前研究发现Wnt信号传导通路可以经下游信号调节细胞骨架结构并影响细胞迁移和黏附,一些Wnt信号通路分子是调节细胞迁移和黏附的重要成分。β-catenin是经典的Wnt信号通路必不可少的调节蛋白[7-9]。Wnt3a是Wnt家族研究较多的成员之一,它可以激活经典的Wnt信号通路并诱导细胞增殖[6],但Wnt3a对细胞迁移和黏附的影响还未进一步阐明。激活的Wnt/β-catenin信号可以被GSK-3β抑制,GSK-3β使β-catenin N末端磷酸化导致β-catenin降解。但是当β-catenin C末端Ser675位点磷酸化时却可以激活β-catenin,使β-catenin更易进入细胞核与淋巴细胞增强因子、T细胞因子结合增强转录活性[10-12]。本研究发现重组的Wnt3a蛋白刺激大鼠VSMCs后可以增强β-catenin Ser675位点和GSK-3β Ser9(抑制GSK-3β的活性)位点的磷酸化,提示Wnt3a刺激可以激活Wnt/β-catenin信号通路。
VSMCs迁移和增殖可以导致损伤的动脉内膜增生引起动脉粥样硬化加重和血管内再狭窄。这一系列过程受到细胞外基质、黏附分子及细胞表面的整合素家族等许多蛋白及信号通路的调节[9,12]。ILK是整合素受体下游信号一个重要的分子,它可以通过磷酸化使GSK-3β失活,GSK-3β失活又可以导致Wnt信号传导通路靶基因的激活,从而调节细胞的增殖、分化及存活。ILK还可以作为分子桥接蛋白与整合素结合,调节肌动蛋白和细胞骨架结构,影响细胞迁移和黏附[13-16]。研究还发现ILK可以通过磷酸化使GSK-3β失活,促进β-catenin核易位并激活经典的Wnt信号通路[14-17]。本研究在大鼠VSMCs中研究发现Wnt3a不仅可以激活经典的Wnt信号通路,还可以增加ILK蛋白水平的表达,并促进VSMCs迁移和黏附,提示Wnt3a可以通过ILK调节VSMCs迁移和黏附。
本研究得出Wnt3a可以通过ILK调节VSMCs迁移和黏附,这有可能成为治疗血管疾病和评估预后一个重要的靶点,然而,血管疾病的发生机制复杂并涉及许多信号传导通路,将来还应该在其他的细胞中和动物模型中进一步探讨Wnt3a信号及ILK的机制和作用。
[1]Van DV,Smits JF,Blankesteijn WM.The Wnt/frizzled pathway in cardiovascular development and disease:friend or foe?[J].Eur J Pharmacol,2008,585(2/3):338-345.
[2]Rao TP,Kühl M.An updated overview on Wnt signaling pathways:a prelude for more[J].Circ Res,2010,106(12):1798-1806.
[3]Tsaousi A,Mill C,George SJ.The Wnt pathways in vascular disease:lessons from vascular development[J].Curr Opin Lipidol,2011,22(5):350-357.
[4]Ghatak S,Morgner J,Wickström SA.ILK:a pseudokinase with a unique function in the integrin-actin linkage[J].Biochem Soc Trans,2013,41(4):995-1001.
[5]Kim C,Ye F,Ginsberg MH.Regulation of integrin activation[J].Annu Rev Cell Dev Biol,2011,27:321-345.
[6]Shin HR,Islam R,Yoon WJ,et al.Pin1-mediated modification prolongs the nuclear retention of β-Catenin in wnt3a-induced osteoblast differentiation[J].J Biol Chem,2016,291(11):5555-5565.
[7]Amin N,Vincan E.The Wnt signaling pathways and cell adhesion[J].Front Biosci (Landmark Ed),2012,17(1):784-804.
[8]Tan CW,Gardiner BS,Hirokawa Y,et al.Wnt signalling pathway parameters for mammalian cells[J].PLoS One,2012,7(2):e31882.
[9]Parmalee NL,Kitajewski J.Wnt signaling in angiogenesis[J].Curr Drug Targets,2008,9(7):558-564.
[10]Vargas DA,Sun M,Sadykov K,et al.The integrated role of Wnt/β-Catenin,N-Glycosylation,and E-Cadherin-Mediated adhesion in network dynamics[J].PLoS Comput Biol,2016,12(7):e1005007.
[11]Marchand A,Atassi F,Gaaya A,et al.The Wnt/beta-catenin pathway is activated during advanced arterial aging in humans[J].Aging Cell,2011,10(2):220-232.
[12]Mill C,George SJ.Wnt signalling in smooth muscle cells and its role in cardiovascular disorders[J].Cardiovasc Res,2012,95(2):233-240.
[13]Ho B,Hou G,Pickering JG,et al.Integrin-linked kinase in the vascular smooth muscle cell response to injury[J].Am J Pathol,2008,173(1):278-288.
[14]Ho B,Bendeck MP.Integrin linked kinase (ILK) expression and function in vascular smooth muscle cells[J].Cell Adh Migr,2009,3(2):174-176.
[15]Moraes JA,Frony AC,Dias AM,et al.Alpha1beta1 and integrin-linked kinase interact and modulate angiotensin II effects in vascular smooth muscle cells[J].Atherosclerosis,2015,243(2):477-485.
[16]Mcdonald PC,Fielding AB,Dedhar S.Integrin-linked kinase--essential roles in physiology and cancer biology[J].J Cell Sci,2008,121(Pt 19):3121-3132.
[17]Lu C,Yu X,Zuo K,et al.Tripterine treatment improves endothelial progenitor cell function via integrin-linked kinase[J].Cell Physiol Biochem,2015,37(3):1089-1103.
Wnt3aregulatesmigrationandadhesionofvascularsmoothmuscularcellsviaintegrin-linkedkinase*
WuXiaolin,ZhuRui△,LiBin,LiuWenwei,ZhouQing,ZhaoYuqin
(DepartmentofCardiology,XiangyangMunicipalCentralHospitalAffiliatedtoHubeiUniversityofArtsandScience,Xiangyang,Hubei441000,China)
ObjectiveTo investigate the effects and related mechanism of recombinant Wnt3a protein on vascular smooth muscle cells(VSMCs) migration and adhesion.MethodsPrimary rat VSMCs were cultured.The experiment was divided into the Wnt3a group and control group.The VSMC migration ability was detected by Transwell experiment.And the ability of VSMC adhesion to extracelluar matrix was detected by the celluar matrix adhesion assay.The protein expression levels of β-catenin,phosphor-β-catenin (Ser675),GSK-3β,phosphor-GSK-3β(Ser9) and integrin-linked kinase(ILK) in VSMCs were detected by Western blot and analyzed.ResultsThe number of VSMCs migration in the Wnt3a group was significantly higher than that in the control group (P<0.05).Compared with the control group,the number of VSMCs adhesion to collagen Ⅰ and the optical density value in the Wnt3a group were significantly increased (P<0.05),and the protein expression levels of β-catenin,Ser675,GSK-3β,Ser9 and ILK in the Wnt3a group were significantly up-regulated (P<0.05).ConclusionWnt3a can regulate VSMCs migration and adhesion by ILK.
] Wnt proteins;muscle,smooth,vascular;cell movement;cell adhesion;protein-serine-threonine kinases
10.3969/j.issn.1671-8348.2017.36.004
湖北省自然科学基金青年项目(2016CFB344)。
吴校林(1982-),博士,主治医师,主要从事冠心病相关机制的研究。△
,E-mail:zhurui@medmail.com.cn。
R346
A
1671-8348(2017)36-5049-03
2017-08-18
2017-09-26)

