过氧化物酶体增殖物PGC-1α对肝缺血再灌注损伤的保护作用研究
毕华强,李晓武,刘 辉,张 曦
(陆军军医大学西南医院肝胆外科,重庆 400038)
·论著·
过氧化物酶体增殖物PGC-1α对肝缺血再灌注损伤的保护作用研究
毕华强,李晓武,刘 辉,张 曦△
(陆军军医大学西南医院肝胆外科,重庆 400038)
目的探讨过氧化物酶体增殖物受体γ共激活因子-1α(PGC-1α)对肝缺血再灌注损伤的保护作用。方法构建大鼠肝缺血再灌注损伤模型,恢复灌注后12 h,以蛋白免疫印迹(Western blot)检测PGC-1α表达情况,并检测肝脏活性氧、三磷酸腺苷(ATP)水平及血丙氨酸氨基转移酶(ALT)活性变化,评估肝功能情况。另一方面,构建PGC-1α慢病毒过表达载体,并在大鼠缺血再灌注前转染,于缺血再灌注后,再以Western blot检测PGC-1α表达,肝脏活性氧、ATP水平和血肝酶活性变化,评估PGC-1α表达对肝缺血再灌注损伤的保护作用。结果缺血再灌注肝脏PGC-1α表达较假手术组及对照组(未手术)明显降低(均P<0.05),同时肝脏活性氧族水平及ALT活性显著升高,而肝ATP产生减少(均P<0.05)。PGC-1α慢病毒过表达载体转染显著上调缺血再灌注肝脏PGC-1α表达,同时肝脏活性氧族水平及ALT活性较未转染组显著降低,而肝ATP产生增加(均P<0.05)。结论PGC-1α表达有利于保护肝缺血再灌注损伤。
过氧化物酶体增殖物受体γ共激活因子-1α;肝;再灌注损伤
肝缺血再灌注损伤是肝移植及肝切除术后急性肝功能损伤的主要原因[1-2]。研究发现肝缺血再灌注后,肝脏线粒体融合蛋白2(Mfn2)表达显著降低,且与肝功能损害程度相关。进一步研究表明Mfn2作为下游靶蛋白,受过氧化物酶体增殖物受体γ共激活因子-1α(peroxisome proliferator-activated receptor-γ coactlvator-1α,PGC-1α)调节,同时过氧化物酶体增殖物受体γ激动剂罗格列酮也可减轻肝缺血再灌注损伤[3],提示PGC-1α可能对肝缺血再灌注损伤具有保护作用。本研究建立大鼠肝缺血再灌注模型,观察PGC-1α的表达变化与肝功能损伤间的关系,并构建PGC-1α的清蛋白启动子慢病毒过表达载体,使PGC-1α在肝脏特异性过表达,观察PGC-1α过表达后,对缺血再灌注肝功能的影响,探讨PGC-1α对肝缺血再灌注损伤的保护作用。
1 材料与方法
1.1动物与材料 体质量250~300 g雄性SD大鼠购自陆军军医大学动物实验中心。慢病毒包装颗粒购自上海吉凯生物技术有限公司,PGC-1α一抗及血丙氨酸氨基转移酶(ALT)活性检测试剂盒购自美国Abcam公司。β-actin一抗和二抗购自美国Santa Cruz生物公司。活性氧检测试剂盒购自南京凯基生物技术有限公司,三磷酸腺苷(ATP)检测试剂盒、ECL发光试剂盒购自南京碧云天生物科技有限公司。
1.2方法
1.2.1PGC-1α慢病毒过表达载体构建 聚合酶链反应(PCR)扩增鼠清蛋白启动子(-449 ~ +100,GenBank accession no.NM_009654),并克隆至pMD19-T载体,然后将此载体插入慢病毒颗粒的PacⅠ和BamHⅠ限制性酶切位点间,以替代原慢病毒GC启动子,再将大鼠PGC-1α基因(GenBank accession no.NM_031347.1) 克隆至上述慢病毒载体中,使其位于清蛋白启动子下游。将此慢病毒颗粒包装入质粒 pHelper 1.0,应用脂质体2000转染入293T细胞,应用实时定量PCR证实功能性病毒滴度后,以亲和色谱浓缩、纯化上述慢病毒颗粒。
1.2.2大鼠慢病毒过表达载体转染及肝缺血再灌注模型建立 将2×107TU 的PGC-1α慢病毒或空载体慢病毒重悬入1 mL Opti-MEM Ⅰ培养基,并经尾静脉注射。2周后,麻醉大鼠,开腹,以无损伤血管夹阻断供应肝中叶及肝左叶的肝动脉和门静脉血流90 min,然后开放血管夹恢复血供,建立肝缺血再灌注损伤模型(模型组)[4]。以不阻断肝血供的假手术模型(假手术组)作为对照。动物实验经陆军军医大学动物实验伦理委员会批准。
1.2.3蛋白免疫印迹(Western blot) 肝血供恢复后12 h处死大鼠,取1 g肝组织匀浆后,加入蛋白裂解液提取总蛋白。煮沸变性后按30 μg /孔上样,经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后转移至聚偏氟乙烯(PVDF)膜,以5%脱脂奶粉封闭60 min,加入PGC-1α一抗(1∶1 000)4 ℃孵育过夜,二抗室温孵育1 h后,ECL发光,曝光显影。
1.2.4肝活性氧检测 将1 g肝组织匀浆后应用清洁液漂洗,再以300 r/min离心5 min。将组织沉淀依据试剂盒说明书处理后,用荧光分光光度计检测活性氧水平。
1.2.5肝ATP检测 将20 mg肝组织用组织裂解液裂解后,以12 000 r/min离心10 min,收集上清液。上清液依据试剂盒说明书处理后,用荧光分光光度计检测ATP水平。
1.2.6ALT活性检测 大鼠处死后,收集血液,以3 000 r/min离心10 min获取血清,血清依据试剂盒说明书处理后,用酶标仪检测ALT活性。
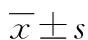
2 结 果
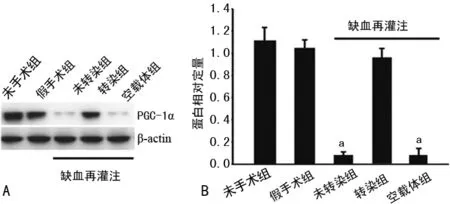
2.1肝PGC-1α表达与缺血再灌注损伤 Western blot检测显示,肝脏缺血再灌注12 h后,模型组PGC-1α表达水平较正常肝脏(未手术组)及假手术组肝脏明显降低(图1)。同时模型组肝脏活性氧水平较假手术组及未手术组显著升高,而ATP产生明显减少,ALT活性也显著上升(均P<0.05),见图2。

A:Western blot;B:定量分析图;a:P<0.05,与模型组比较
图1各组大鼠肝脏PGC-1α的表达比较

A:肝活性氧;B:肝ATP;C:ALT;a:P<0.05,与模型组比较。
图2各组大鼠肝功能性损伤检测结果比较
2.2PGC-1α慢病毒过表达载体转染保护缺血再灌注肝PGC-1α表达 于术前2周,经尾静脉注射转染含清蛋白启动子的PGC-1α慢病毒过表达载体,2周后行缺血再灌注手术,恢复再灌注12 h后,转染组缺血再灌注肝脏PGC-1α表达水平较未转染组及转染空载体组显著升高,见图3。
2.3保护肝PGC-1α表达减轻缺血再灌注损伤 经转染含清蛋白启动子的 PGC-1α慢病毒过表达载体,保护肝脏PGC-1α表达后,缺血再灌注肝活性氧水平较未转染组及空载体组显著降低,而ATP产生明显增加,ALT活性也显著下降(均P<0.05),见图4。
A:Western blot;B:定量分析图;a:P<0.05,与转染组比较。
图3各组大鼠肝PGC-1α水平比较

A:肝活性氧;B:肝ATP;C.ACT;a:P<0.05,与转染组比较。
图4肝PGC-1α表达对肝缺血再灌注损伤的影响
3 讨 论
肝缺血再灌注损伤造成的肝功能异常显著增加肝移植术患者、肝切除术患者及肝创伤患者的病死率[1-2,5]。防止缺血再灌注损伤是防止肝脏术后肝功能异常,改善患者生存率的重要策略。肝细胞线粒体形态、功能损伤是肝缺血再灌注损伤的主要超微病理特征[6-7]。近来研究发现PGC-1α是热源性的转录共激活因子,通过调节线粒体的形态和呼吸功能而参与细胞能量代谢,PGC-1α的表达缺失将导致生理刺激产生的ATP减少[8-9]。因此探讨PGC-1α在缺血再灌注损伤中的作用,对于开发防治缺血再灌注损伤策略具有重要意义。
本研究发现,肝缺血再灌注后,肝脏PGC-1α表达明显降低,而肝脏活性氧水平显著升高,ATP产生减少,提示PGC-1α表达与缺血再灌注后肝细胞线粒体功能障碍显著相关。有研究表明,肝缺血再灌注后,PGC-1α低表达可造成肝细胞活性氧水平显著增加,而活性氧对线粒体的能量代谢呼吸链具有显著损伤、破坏及毒性作用,进而导致线粒体肿胀,ATP能量产生障碍,最终使得肝细胞死亡[3]。肝细胞死亡使得肝酶释放入血,进而造成ALT等活性增加,提示肝功能损害。因此,PGC-1α的表达与肝细胞线粒体损伤和肝功能损害呈负相关。而转染含清蛋白启动子的 PGC-1α慢病毒过表达载体,可使 PGC-1α在清蛋白启动子调控下在缺血再灌注后的肝脏特异性表达。当PGC-1α表达逆转后,肝脏ATP的产生明显增加,活性氧水平显著下降,ACT活性降低,提示PGC-1α的表达对于肝缺血再灌注损伤具有显著保护作用。
本研究提示PGC-1α可能是肝缺血再灌注损伤的重要调节因子。罗格列酮作为过氧化物酶体增殖物受体γ激动剂,可促进PGC-1α表达而减轻肝缺血再灌注损伤。因此,研发新的PGC-1α表达诱导剂,有助于更有效防治缺血再灌注损伤。同时研究发现,PGC-1α对线粒体形态功能的保护调节作用,依赖于下游线粒体融合蛋白Mfn2的表达,PGC-1α通过调节Mfn2表达减轻线粒体形态功能损伤[3],因此,研发PGC-1α/Mfn2通路激活剂,可能是防治肝缺血再灌注损伤的又一新策略。
[1]J Sosa RA,Zarrinpar A,Rossetti M,et al.Early cytokine signatures of ischemia/reperfusion injury in human orthotopic liver transplantation[J].JCI Insight,2016,1(20):e89679.
[2]Theodoraki K,Tympa A,Karmaniolou I,et al.Ischemia/reperfusion injury in liver resection:a review of preconditioning methods[J].Surg Today,2011,41(5):620-629.
[3]Li J,Ke W,Zhou Q,et al.Tumour necrosis factor-α promotes liver ischaemia-reperfusion injury through the PGC-1α/Mfn2 pathway[J].J Cell Mol Med,2014,18(9):1863-1873.
[4]Ji H,Shen D,Zhang Y,et al.Activation of cyclic adenosine monophosphate-dependent protein kinase a signaling prevents liver ischemia/reperfusion injury in mice[J].Liver Transpl,2012,18(6):659-670.
[5]Guo A.The search for a magic bullet to fight multiple organ failure secondary to ischemia/reperfusion injury and abdominal compartment syndrome[J].J Surg Res,2013,184(2):792-793.
[6]Lin HC,Liu SY,Lai HS,et al.Isolated mitochondria infusion mitigates ischemia-reperfusion injury of the liver in rats [J].Shock,2013,39(3):304-310.
[7]Chen HH,Chen YT,Yang CC,et al.Melatonin pretreatment enhances the therapeutic effects of exogenous mitochondria against hepatic ischemia-reperfusion injury in rats through suppression of mitochondrial permeability transition[J].J Pineal Res,2016,61(1):52-68.
[8]Villena JA.New insights into PGC-1 coactivators:redefining their role in the regulation of mitochondrial function and beyond[J].FEBS J,2015,282(4):647-672.
[9]Gleyzer N,Scarpulla RC.Concerted action of PGC-1-related coactivator(PRC) and c-MYC in the stress response to mitochondrial dysfunction[J].J Biol Chem,2016,291(49):25529-25541.
Protectiveeffectofperoxisomeproliferatorreceptorγcoactivator-1αonhepaticischemia-reperfusioninjury
BiHuaqiang,LiXiaowu,LiuHui,ZhangXi△
(DepartmentofHepatobiliarySurgery,SouthwestHospital,theArmyMedicalUniversity,Chongqing400038,China)
ObjectiveTo investigate the protective effect of peroxisome proliferator receptor γ coactivator (PGC) -1α on hepatic ischemia-reperfusion injury.MethodsThe rat model of hepatic ischemia-reperfusion injury was established.The expression of PGC-1α was detected by Western blot after 12 hours of reperfusion.The changes of reactive oxygen species(ROS),ATP level and serum liver enzyme activity were measured,and the liver function was evaluated.On the other hand,PGC-1α lentiviral overexpression vector was constructed and transfected in rat before ischemia-reperfusion.After ischemia-reperfusion,the expression of PGC-1α,liver ROS,ATP level were measured by Western blot to explore the protective role of PGC-1α in liver ischemia reperfusion injury.ResultsThe expression of PGC-1α in ischemia-reperfusion liver was significantly lower than that in the control group (P<0.05).The level of ROS[(325.4±70.9)RLUvs.(108.5±25.2)RLU,P<0.05],the ALT activity in serum[(367.8±82.7)U/Lvs.(98.7±16.8 )U/L,P<0.05]in ischemia-reperfusion liver were increased than that in the control group,whereas liver ATP production was reduced[(6.1±3.7)pmolvs.(19.8±3.1)pmol,P<0.05)].The expression of PGC-1α in the liver was significantly up-regulated by PGC-1α lentiviral overexpression vector (57.3 ± 21.3) U/Lvs. (311.2±25.8) U/L,P<0.05),down-regulated ROS[(98.7±18.9)RLUvs.(300.2±45.6)RLU,P<0.05] and serum glutamic-pyruvic transaminase[(105.3±21.3)U/Lvs.(311.2±25.8)U/L,P<0.05)],and increased liver ATP production [(17.3±3.1)pmolvs.(5.8±2.0)pmol,P<0.05]in contrast to non-transfected rats.ConclusionPGC-1α contributes to protect liver ischemia reperfusion injury.
] peroxisome proliferator-activated receptor-γ coactlvator-1α;liver;reperfusion injury
毕华强(1979-),副主任医师,硕士,主要从事肝胆、胰腺的外科治疗与肿瘤治疗。△
,E-mail:13079242@qq.com。
10.3969/j.issn.1671-8348.2017.36.002
R657.3
A
1671-8348(2017)36-5044-03
2017-08-18
2017-09-26)

