人参白虎汤对1型糖尿病幼鼠血糖及干扰素γ、白细胞介素4的影响
陈 晶 郭 艳 闫玉洁 辛 丽 张俊玲
(华北理工大学2015级硕士研究生,河北 唐山 063000)
人参白虎汤对1型糖尿病幼鼠血糖及干扰素γ、白细胞介素4的影响
陈 晶 郭 艳 闫玉洁 辛 丽 张俊玲△
(华北理工大学2015级硕士研究生,河北 唐山 063000)
目的探究人参白虎汤对1型糖尿病(T1DM)幼鼠血糖及干扰素γ(IFN-γ)、白细胞介素4(IL-4)的影响作用。方法将50只幼鼠随机选取10只设为正常组,剩余40只以链脲佐菌素(STZ)腹腔注射1次诱导T1DM模型,造模成功后随机分为模型组、胰岛素组、人参白虎汤高剂量组及人参白虎汤低剂量组,每组各10只。胰岛素组予精蛋白生物合成人胰岛素注射液2 U/(kg·d)皮下注射,人参白虎汤高、低剂量组分别予人参白虎汤12、6 mL/(kg·d)灌胃,正常组及模型组予0.9%氯化钠注射液1 mL灌胃,均持续6周。观察5组幼鼠给药前后体质量变化,分别于给药前及给药结束后采集5组幼鼠尾静脉血测定空腹血糖,处死幼鼠取腹主动脉血采用酶联免疫吸附(ELISA)法检测IFN-γ和IL-4水平,并观察5组幼鼠胰腺的病理变化。结果给药前,模型组、胰岛素组、人参白虎汤高剂量组及人参白虎汤低剂量组幼鼠体质量均较正常组明显下降(P<0.05),空腹血糖升高(P<0.05);给药后,胰岛素组、人参白虎汤高剂量组及人参白虎汤低剂量组幼鼠体质量均较本组给药前及模型组同期升高(P<0.05),空腹血糖降低(P<0.05),但与正常组同期比较差异仍有统计学意义(P<0.05);与胰岛素组相比,人参白虎汤高剂量组体质量及空腹血糖无明显差异(P>0.05),而人参白虎汤低剂量组体质量低,空腹血糖高(P<0.05)。与正常组相比,模型组、胰岛素组、人参白虎汤高剂量组及人参白虎汤低剂量组IFN-γ水平升高,IL-4水平降低(P<0.05);与模型组相比,胰岛素组、人参白虎汤高剂量组及人参白虎汤低剂量组IFN-γ水平明显降低(P<0.05),IL-4水平明显升高(P<0.05),且人参白虎汤高剂量组与胰岛素组相比比较差异无统计学意义(P>0.05)。胰腺组织病理观察显示,胰岛素组、人参白虎汤高剂量组及人参白虎汤低剂量组胰岛β细胞损伤较模型组减轻,但仍未恢复正常。结论人参白虎汤能明显降低T1DM幼鼠血糖、IFN-γ水平,提高IL-4水平,改善胰腺病理结构,进而发挥修复T1DM幼鼠胰岛免疫损伤的作用。
糖尿病,1型;疾病模型,动物;白细胞介素4;干扰素Ⅱ型;小鼠
1型糖尿病(type 1 diabetes mellitus,T1DM)是因内源性胰岛素不能正常分泌而引起血糖升高等一系列临床表现的疾病,是由自身免疫反应介导的部分或全部胰岛β细胞破坏所引发,多发生于儿童和青少年。目前,T1DM发病率逐年上升[1],儿童一旦患病,则需终生治疗,且易合并全身器官损伤,严重降低患儿生活质量,甚至危及生命。中医学将糖尿病归为“消渴”范畴。人参白虎汤具有消渴生津之效。众多研究显示,细胞因子如干扰素γ(IFN-γ)和白细胞介素4(IL-4)在T1DM的发病中有重要作用[2]。目前,许多研究[3-6]聚焦在T1DM患儿与正常儿童IFN-γ和IL-4的变化比较,及IFN-γ和IL-4在T1DM发病中的作用。本实验通过链脲佐菌素(STZ)腹腔注射制备T1DM幼鼠模型,然后观察不同方法治疗后幼鼠体质量、空腹血糖、IFN-γ、IL-4水平及胰腺组织的病理变化情况,进一步探讨人参白虎汤对T1DM幼鼠血糖及胰岛免疫损伤的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 SD幼鼠50只,雌性,体质量100~120 g,购自北京华阜康生物科技股份有限公司,动物合格证号SCXK2016-0011,饲养于华北理工大学动物房,自由进水,普通饲料适应性喂养。
1.1.2 药物与试剂 STZ,美国Sigma公司,批号S0130;血糖仪、测试条[艾康生物技术(杭州)有限公司]。人参白虎汤药物组成:石膏30 g,甘草6 g,知母18 g,粳米12 g,人参9 g,药材购自北京同仁堂药房。以上药物水煎浓缩成含中药3 g/mL的汤剂。精蛋白生物合成人胰岛素注射液(丹麦诺和诺德公司,进口药品注册证号H20070163),保存于4 ℃冰箱中备用。
1.1.3 主要仪器 L-420低速离心机(湖南湘仪实验室仪器开发有限公司),CX4 Pro全自动生化分析仪(美国Beckman公司),DP80生物显微镜(日本OLYMPUS公司),HM340石蜡切片机(上海倍曼生物科技有限公司),美国热电Thermo移液器(1~10 μL、1~200 μL、5~1 000 μL、0.5~50 μL);IL-4及IFN-γ酶联免疫吸附(ELISA)试剂盒(上海森雄科技实业有限公司)。
1.2 实验方法
1.2.1 动物分组及造模方法 50只SD幼鼠饲养1周后,随机分为正常组10只,实验组40只。正常组幼鼠进行普通饲料喂养,实验组幼鼠禁食但不禁水,12 h后行STZ 60 mg/kg腹腔注射1次诱导T1DM模型,于72 h后测空腹血糖≥16.7 mmol/L,并有多饮、多食、多尿表现者即为造模成功[7]。结果40只幼鼠均造模成功,将40只T1DM幼鼠模型随机分为模型组、胰岛素组、人参白虎汤高剂量组及人参白虎汤低剂量组,每组各10只。
1.2.2 给药方法 造模成功后3 d,胰岛素组予精蛋白生物合成人胰岛素注射液2 U/(kg·d)皮下注射,人参白虎汤高、低剂量组分别予人参白虎汤12、6 mL/(kg·d)灌胃,正常组及模型组予0.9%氯化钠注射液1 mL灌胃,均持续6周。
1.3 观察指标
1.3.1 一般情况 观察5组幼鼠造模后一般情况,包括饮食、饮水、尿量、体质量、体毛、活动量等情况。
1.3.2 体质量 5组幼鼠均每周称体质量,观察其体质量的变化。
1.3.3 血糖 根据实验要求,分别于给药前及给药结束后采集5组幼鼠尾静脉血测定空腹血糖,并进行比较。
1.3.4 IFN-γ及IL-4水平 最后一次给药后,5组幼鼠禁食12 h后,予10%水合氯醛麻醉,剖腹,腹主动脉取血置于干燥的黄色管中,3 000 r/min,离心15 min,取上清液置于-80 ℃冰箱内待测。采用ELISA法检测IFN-γ及IL-4水平,操作严格按照试剂盒说明书进行。
1.3.5 胰腺病理观察 取腹主动脉血后,处死各组幼鼠,切除5组幼鼠胰腺组织,0.9%氯化钠注射液冲洗,于10%中性甲醛溶液中固定24 h,再进行石蜡包埋、切片、烤片、苏木精-伊红(HE)染色,最后显微镜(×200)下观察各组幼鼠胰腺的病理变化。

2 结 果
2.1 5组幼鼠一般情况 模型组、胰岛素组、人参白虎汤高剂量组及人参白虎汤低剂量组幼鼠造模后逐渐出现多饮,多食,多尿,体质量下降,体毛松散,活动量下降等症状,符合糖尿病模型的诊断,与有关文献报道的糖尿病动物症状、体征相似[6]。正常组幼鼠在此期间饮食、饮水、大小便、体毛、活动度较前基本无变化,体质量明显增长。
2.2 5组幼鼠给药前后体质量变化比较 见表1。
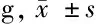
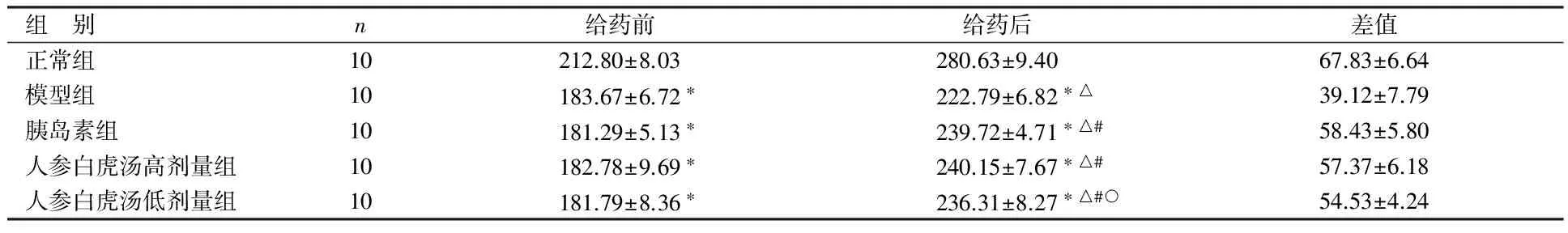
组 别n给药前给药后差值正常组10212.80±8.03280.63±9.4067.83±6.64模型组10183.67±6.72∗222.79±6.82∗△39.12±7.79胰岛素组10181.29±5.13∗239.72±4.71∗△#58.43±5.80人参白虎汤高剂量组10182.78±9.69∗240.15±7.67∗△#57.37±6.18人参白虎汤低剂量组10181.79±8.36∗236.31±8.27∗△#○54.53±4.24
与正常组比较,*P<0.05;与本组给药前比较,△P<0.05;与模型组比较,#P<0.05;与胰岛素组比较,○P<0.05
由表1可见,给药前,模型组、胰岛素组、人参白虎汤高剂量组及人参白虎汤低剂量组幼鼠体质量均较正常组明显下降(P<0.05),且各组组间比较差异无统计学意义(P>0.05)。给药后,胰岛素组、人参白虎汤高剂量组及人参白虎汤低剂量组幼鼠体质量均较本组给药前及模型组同期升高(P<0.05),但仍低于正常组同期(P<0.05);
与胰岛素组相比,人参白虎汤高剂量组幼鼠体质量无明显差异(P>0.05),人参白虎汤低剂量组幼鼠体质量降低(P<0.05)。给药后,模型组体质量较本组给药前升高(P<0.05),但仍低于正常组(P<0.05)。
2.3 5组幼鼠给药前后空腹血糖变化比较 见表2。

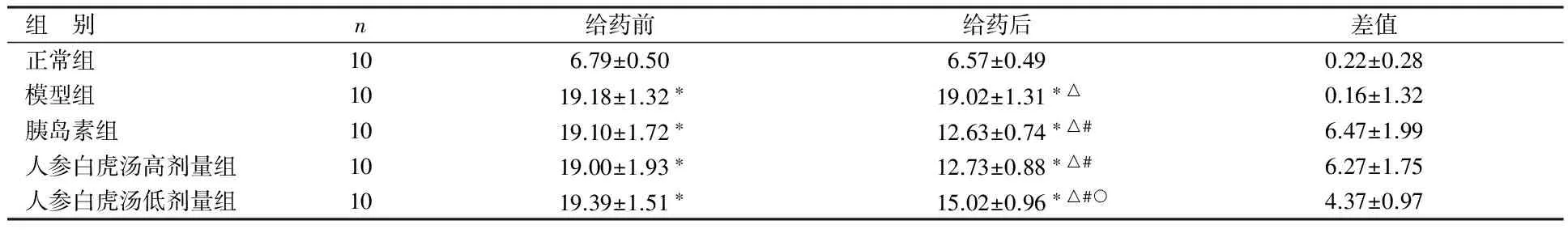
组 别n给药前给药后差值正常组106.79±0.506.57±0.490.22±0.28模型组1019.18±1.32∗19.02±1.31∗△0.16±1.32胰岛素组1019.10±1.72∗12.63±0.74∗△#6.47±1.99人参白虎汤高剂量组1019.00±1.93∗12.73±0.88∗△#6.27±1.75人参白虎汤低剂量组1019.39±1.51∗15.02±0.96∗△#○4.37±0.97
与正常组比较,*P<0.05;与本组给药前比较,△P<0.05;与模型组比较,#P<0.05;与胰岛素组比较,○P<0.05
由表2可见,给药前,与正常组相比,模型组、 胰岛素组、人参白虎汤高剂量组及人参白虎汤低 剂量组幼鼠空腹血糖均明显升高(P<0.05) ,且各组组间比较差异无统计学意义(P>0.05)。给 药后,胰岛素组、人参白虎汤高剂量组及人参白虎 汤低剂量组幼鼠的空腹血糖与本组给药前及模型 组同期相比明显下降( P<0.05) ,但仍高于正常 组同期(P<0.05);与胰岛素组相比,人参白虎汤 高剂量组比较差异无统计学意义(P>0.05),人 参白虎汤低剂量组空腹血糖仍较高(P<0.05)。正常组、模型组幼鼠的空腹血糖于给药前、后无明显变化(P>0.05) 。
2.4 5 组幼鼠IFN-γ及IL-4 水平变化比较见表3。
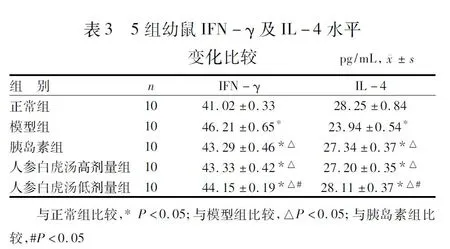
由表3可见,与正常组相比,模型组、胰岛素组、人参白虎汤高剂量组及人参白虎汤低剂量组IFN-γ水平升高,IL-4水平降低,比较差异均有统计学意义(P<0.05)。与模型组相比,胰岛素组、人参白虎汤高剂量组及人参白虎汤低剂量组IFN-γ水平明显降低(P<0.05),IL-4水平明显升高(P<0.05)。与胰岛素组相比,人参白虎汤高剂量组IFN-γ、IL-4水平比较差异无统计学意义(P>0.05),人参白虎汤低剂量组比较差异有统计学意义(P<0.05)。
2.5 5组幼鼠胰腺组织病理变化 正常组幼鼠的胰岛β细胞胞浆丰富,轮廓规整,满视野可见大量的胰岛β细胞,且分布均匀,排列整齐,细胞分界清晰。与正常组相比,模型组幼鼠胰岛中可见少量散在的胰岛β细胞,分布欠均匀,排列紊乱,且胰岛β细胞部分溶解。与正常组相比,胰岛素组、人参白虎汤高剂量组及人参白虎汤低剂量组胰岛β细胞数量在一定程度上减少,且排列欠规整,但与模型组比较,胰岛β细胞数量增多,分布稍均匀,排列稍整齐,胞浆稍丰富,且以人参白虎汤高剂量组改善更为明显。5组幼鼠胰腺组织病理图见图1。
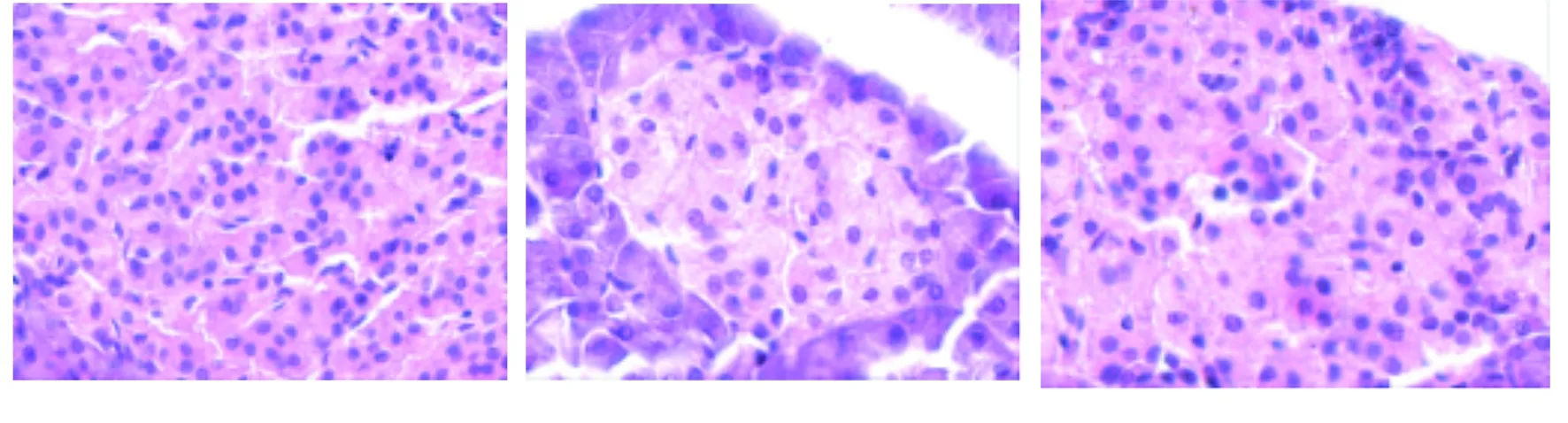
正常组 模型组 胰岛素组
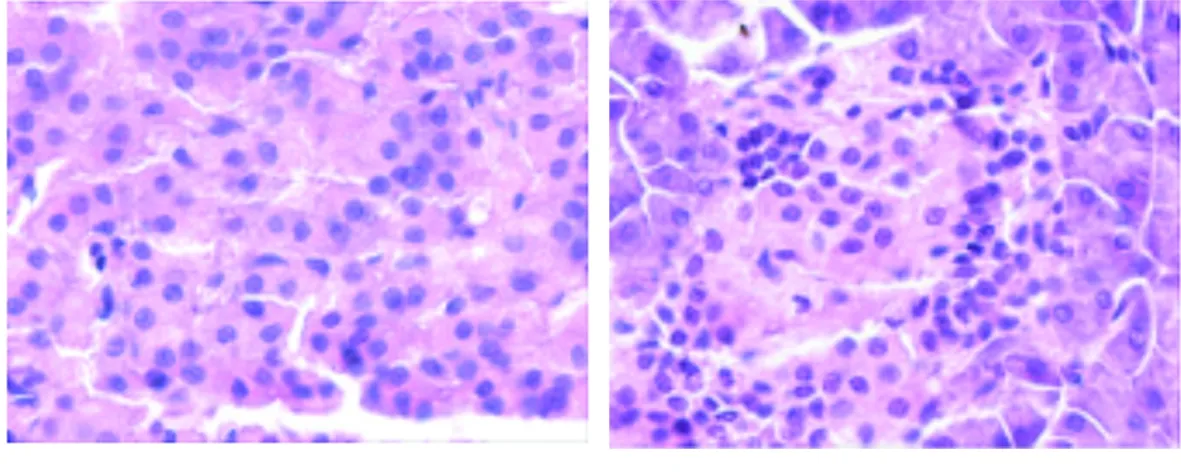
人参白虎汤高剂量组 人参白虎汤低剂量组
图1 5组幼鼠胰腺组织病理变化(HE×200)
3 讨 论
目前,我国儿童T1DM的发病率逐年上升,且随着年龄的增长而增加,其病程长,发展至成年常合并眼、心、肾、神经等多种并发症[8],且尚无办法根治,患儿常伴随出现各种心理社会问题[9],很大程度地影响了患儿的身心健康,因此T1DM的防控工作尤为重要。到目前为止,T1DM的病因病机尚未完全揭示,但主要研究显示,自身免疫细胞浸润胰岛,进一步引起胰岛β细胞损伤,使得胰岛素分泌缺乏,是T1DM发生的根本原因[10]。CD4+T淋巴细胞主要表达于辅助T(Th)细胞,在免疫系统中起主导作用[11]。Th细胞可分为Th1和Th2亚群,Th1/Th2主要通过自身或其他免疫细胞分泌的细胞因子进行自我调节和相互调节,以维持平衡。Th1细胞主要分泌IL-2、IFN-γ等细胞因子参与细胞免疫;Th2细胞主要分泌IL-4、IL-5等细胞因子参与体液免疫应答,免疫学常以IFN-γ和IL-4分别作为Th1、Th2细胞的特征性因子,二者比值的变化能够反映Thl/Th2的平衡状态。目前研究认为,Th1/Th2平衡紊乱是T1DM发病的主要机制[12]。Th1细胞是主要效应细胞,可直接或间接破坏胰岛β细胞。IFN-γ对细胞免疫反应具有促进作用,可以直接对胰岛β细胞产生细胞毒性。在免疫应答过程中,胰岛自身抗原能刺激记忆淋巴细胞产生IFN-γ,产生过多时,可导致胰岛β细胞免疫损伤,导致Th1/Th2失衡。国内外动物实验显示,T1DM模型幼鼠脾细胞上清液中的IFN-γ水平明显高于正常对照组[13-14]。Th2细胞对Th1细胞的功能有抑制作用,细胞因子IL-4可以减缓Th1细胞对胰岛β细胞的破坏作用,还可促进Th2细胞的生成和发育[15-16]。本研究结果显示,T1DM幼鼠模型血清中IFN-γ水平升高,IL-4水平降低,机体处于Th1强势,从而使得胰岛β细胞受损,导致T1DM的发生和发展,与研究相一致[1-3]。
T1DM属于中医学消渴、消瘅范畴[17],系先天不足,五脏柔弱,六淫侵袭,热毒留恋,化热损阴所致。先天不足者宜补,但先天难补,应以补益后天脾胃为主,同时清热解毒养阴。《金匮要略》曰:“渴欲饮水,口干舌燥者,白虎加人参汤主之。”白虎加人参汤后世亦谓之人参白虎汤,是治疗消渴的经典方剂,由石膏、甘草、知母、粳米、人参组成,具有清热泻火、益气生津的功效。现代药理研究表明,知母能够降低血糖[18-19]。人参中的多肽和多糖成分均可使STZ导致的高血糖下降,能增加葡萄糖分解、降低糖异生;人参二醇皂苷和多糖能够调节机体免疫功能[20]。
STZ对胰岛β细胞具有高度选择性,注入幼鼠体内后可通过自由基破坏大部分胰岛β细胞,使其功能障碍,导致胰岛素分泌严重不足,从而导致糖尿病,其模型在病理生理特性上接近胰岛素依赖型糖尿病,且组织毒性相对较小,具有耗时短、方法简便、易于掌握和重复性好的优点。本研究结果显示,STZ注射后,幼鼠体质量明显减轻,空腹血糖升高。经胰岛素及人参白虎汤高、低剂量治疗后,体质量明显升高,空腹血糖明显下降,观察胰腺组织的病理改变,胰岛β细胞并未完全丧失,其机制与β细胞凋亡减少、再生增加密切相关[21],尤以人参白虎汤高剂量组效果最佳。综上,人参白虎汤可明显降低T1DM幼鼠血糖,改善多饮、多食、多尿、体质量下降的症状,促进胰岛β细胞的恢复。进一步研究显示,胰岛素及人参白虎汤高、低剂量治疗后T1DM幼鼠IFN-γ水平升高,IL-4水平降低,比较差异均有统计学意义(P<0.05),且人参白虎汤高剂量组与胰岛素组相比,IFN-γ、IL-4水平比较差异无统计学意义(P>0.05)。提示人参白虎汤可调控T1DM幼鼠淋巴细胞免疫因子的释放,降低IFN-γ和升高IL-4,从而调节Th1/Th2失衡状态,修复胰岛β细胞的免疫损伤,从而降低T1DM幼鼠血糖,且有一定的剂量依赖性,为T1DM的免疫防治提供了新的治疗思路。
[1] 王亮,李红玲,刘安宁,等.IL-17及CXCL10在1型糖尿病患者血中的表达及临床意义[J].临床医药实践,2015,24(2):107-109.
[2] 杨玉,刘学武,杨利.Ⅰ型糖尿病不同病情血清IL-6、TNF-α、IFN-γ的变化及临床意义[J].江西医药,2011,46(11):991-994.
[3] 班博,王雪楠,郭焕.1型糖尿病患者Th1/Th2细胞亚群的研究[J].中国热带医学,2007,7(4):517-518,556.
[4] Jain SK,Rains J,Croad J,et al.Curcumin supplementation lowers TNF-alpha,IL-6,IL-8,and MCP-1 secretion in high glucose-treated cultured monocytes and blood levels of TNF-alpha, IL-6,MCP-1,glucose,and glycosylated hemoglobin in diabetic rats[J].Antioxidants & Redox Signaling,2009,11(2):241-249.
[5] Lee LF,Xu B,Michie SA,et al.The role of TNF-alpha in the pathogenesis of type 1 diabetes in the nonobese diabetic mouse:analysis of dendritic cell maturation[J].Proc Natl Acad Sci USA,2005,102(44):15995-16000.
[6] Kim KA,Lee MS.Recent progress in research on beta-cell apoptosis by cytokines[J].Front Biosci,2009,14(2):657-664.
[7] 陈璇,徐凛峰,汪悦,等.白虎二地汤改善2型糖尿病胰岛素抵抗大鼠糖脂代谢的实验研究[J].时珍国医国药,2015,26(10):2377-2379.
[8] 裴育,巴建明.1型和2型糖尿病与骨质疏松症的关系[J].中华糖尿病杂志,2016,8(1):12-14.
[9] 叶蓉.10-16岁1型糖尿病患儿心理行为特征及其影响因素的研究[D].上海:复旦大学,2009.
[10] 丁红,张月明.1型糖尿病胰岛β细胞凋亡的影响因素[J].中国公共卫生,2005,21(2):145-146.
[11] Tritt M,Sgouroudis E,d'Hennezel E,et al.Functional waning of naturally occurring CD4+regulatory T-cells contributes to the onset of autoimmune diabetes[J].Diabetes,2008,57(1):113-123.
[12] 陈永兴,卫海燕,李春枝,等.1型糖尿病患儿血清维生素A浓度变化及其与Th1/Th2平衡相关性[J].中国儿童保健杂志,2012,20(5):404-405,423.
[13] Cameron MJ,Arreaza GA,Zucker P,et a1.IL-4 prevents insulitis and insulin-dependent diabetes mellitus in nonobese diabetic mice by potentiation of regulatory T helper-2 cell function[J].J Immunol,1997,159(10):4686-4692.
[14] 张立新,庞维,付京晶,等.玉竹对STZ诱导的1型糖尿病小鼠的降糖作用[J].中药药理与临床,2012,28(2):106-109.
[15] Falcone M,Yeung B,Tucker L,et al.IL-4 triggers autoimmune diabetes by increasing self-antigen presentation within the pancreatic Islets[J].Clin Immunol,2001,98(2):190-199.
[16] Ko KS,Lee M,Koh JJ,et al.Combined administration of plasmids encoding IL-4 and IL-10 prevents the development of autoimmune diabetes in nonobese diabetic mice[J].Mol Ther,2001,4(4):313-316.
[17] 王冠群,王瑢睿,吕明圣,等.新世纪经方治疗专科专病回顾(八)——内分泌[J].中国中医药现代远程教育,2015,13(13):154-155.
[18] 杨会军,陈涛,付亚玲,等.植物多糖治疗糖尿病的药理研究进展[J].中药新药与临床药理,2009,20(3):294-296.
[19] 黄彩云,谢世荣,黄胜英.知母多糖对家兔血糖的影响[J].大连大学学报,2004,25(4):98-99.
[20] 张丽娜,谢席胜,左川,等.人参皂甙Rg1对糖尿病肾病大鼠TNF-α、MCP-1表达的影响[J].四川大学学报:医学版,2009,40(3):466-471.
[21] 李如江,赵春艳,高海玲,等.1型糖尿病小鼠胰岛β细胞量的变化及其机制[J].中国糖尿病杂志,2011,19(7):545-548.
EffectsofRenshen-baihudecoctiononplasmaglucose,interferon-γandinterleukin-4ofimmatureratswithtype1diabetesmellitus
CHENJing,GUOYan,YANYujie,etal.
2015-GradeMasterofHubeiUniversityofNorthChinaUniversityofScienceandTechnology,Hebei,Tangshan063000
ObjectiveTo observe the effects of Renshen-baihu decoction on plasma glucose, IFN-γ and interleukin-4 (IL-4) of immature rats with type 1 diabetes mellitus (T1DM).Methods10 rats were randomly selected from 50 rats as the normal group, the remaining 40 rats were injected intraperitoneally with streptozotocin (STZ) to induce T1DM model. After successful modeling, the rats were randomly divided into model group, insulin group, high dose of Renshen-baihu decoction group and low dose of Renshen-baihu decoction group, and 10 rats in each group. The insulin group was was injected subcutaneously with insulin by 2 U/ (kg·d). The high and low dose of Renshen-baihu decoction groups were respectively given Renshen-baihu decoction gavage by 12 mL / (kg·d) and 6 mL / (kg·d). The normal group and model group were given 1 mL 0.9% sodium chloride injection gavage. The treatment course was continuously for 6 weeks. The changes of body weight of immature rats before and after administration were observed in 5 groups. The tail vein blood was collected to detect fasting blood glucose before and after the administration in 5 groups. The abdominal aorta blood was collected to detect he levels of IFN-γ and IL-4 by enzyme-linked immunosorbent assay (ELISA) and the pathological changes of pancreas of immature rats were observed.ResultsThe body weight before administration in model group, insulin group, high dose of Renshen-baihu decoction group and low dose of Renshen-baihu decoction group were significantly lower than those in normal group (P<0.05), and fasting blood glucose increased (P<0.05). The body weight after administration in the insulin group, high dose of Renshen-baihu decoction group and low dose of Renshen-baihu decoction group were higher than those before administration and those in the model group at the same period (P<0.05), and the blood glucose was decreased (P<0.05), and had statistical differences with the normal group at the same period (P<0.05). Compared with the insulin group, there was no significant difference on the body weight and fasting blood glucose in the high dose of Renshen-baihu decoction group (P>0.05), while the the body weight in the low-dose of Renshen-baihu decoction group was lower and the fasting blood glucose was still higher (P<0.05). Compared with the normal group, the IFN-γ increased in model group, insulin group, high dose of Renshen-baihu decoction group and low dose of Renshen-baihu decoction group, and IL-4 reduced (P<0.05).Compared with the model group, the IFN-γ in insulin group, high dose of Renshen-baihu decoction group and low dose of Renshen-baihu decoction group were significantly decreased (P<0.05), IL-4 was significantly increased (P<0.05), and there was no significant difference between high dose of Renshen-baihu decoction group and insulin group (P>0.05). The observation of pancreatic tissue histopathology showed that the injury of islet β cell in the insulin group,high dose of Renshen-baihu decoction group and low dose of Renshen-baihu decoction group were less than that in model group, but still not returned to normal.ConclusionRenshen-baihu decoction can significantly reduce the blood glucose, IFN-γ, and increase IL-4 in immature rats with T1DM, improve the pathological structure of the pancreas, and thus can play a role in the repair of islet immune injury in immature rats.
Diabetes; Type 1; Disease model; Animal;IL - 4;IFN - γ;Rat
10.3969/j.issn.1002-2619.2017.11.025
R781.64;R285.5
A
1002-2619(2017)11-1700-06
△ 通讯作者:华北理工大学附属医院儿科,河北 唐山 063000
陈晶(1990—),女,硕士研究生在读。研究方向:儿科学,儿童糖尿病。
2017-07-19)
曹志娟)

