根际内生菌对猕猴桃溃疡病生防作用研究初探
崔丽红,宋金秋,陈继富,恩特马克·布拉提白,田清武
(湘西民族职业技术学院,吉首 416000)
根际内生菌对猕猴桃溃疡病生防作用研究初探
崔丽红,宋金秋*,陈继富,恩特马克·布拉提白,田清武
(湘西民族职业技术学院,吉首 416000)
对前期分离纯化得到的9株根际内生菌进行皿内拮抗活性试验,筛选出对猕猴桃溃疡病致病菌的抑制效果明显的JDG6、JDG16、JDG23菌株,其菌株抑菌圈平均直径分别为13.0 mm、14.5 mm、12.5 mm,JDG16抑制效果最好。对3个菌株进行盆栽试验,结果表明:当发酵滤液稀释100倍时,菌株JDG6,JDG16,JDG23均表现出较强的拮抗活性,可降低了猕猴桃溃疡病致病菌入侵植株体内的机率,抑制致病菌在植株体内的扩展,减轻病菌对植株的危害,为猕猴桃溃疡病生防菌株的研究提供了一定的参考。
根际内生菌;猕猴桃溃疡病;抑菌活性;生物防治
猕猴桃溃疡病(Pseudomonas syringae pv.actinidae)是由丁香假单孢杆菌变种所引起的一种病害,主要危害枝条、叶片、花蕾。该病极易传染,极具毁灭性[1-2]。生物防治是一种以有益生物或其他生物来抑制或杀死有害生物的方法,此方法不仅对植物生长没有影响,而且对致病菌不易产生抗药性,不污染环境,不影响人类健康,是未来替代化学药剂防治植物病害的优先选择[3-4]。2008年,西北农林科技大学申哲等[5]在感溃疡病的猕猴桃植株上喷施内生放线菌gcLA4发酵液100倍稀释液,以化学药剂施那宁为对照,抑制效果明显。2013年,四川农业大学燕金宜[6]从猕猴桃植株枝条上分离出的内生真菌J2,也对猕猴桃溃疡病病原菌有较好的抗性和遗传稳定性,是一个具有开发潜力的生防菌株。2015年,四川出入境检验检疫局检验检疫技术中心邵宝林等[7]通过盆栽试验和大田试验,发现从猕猴桃根际土壤中分离筛选出的芽孢杆菌B2对猕猴桃溃疡病菌有较好的抑制效果。2016年,成都理工大学郭睿文[8]运用牛津杯法,从猕猴桃植株中初步筛选出对猕猴桃溃疡病有拮抗作用的23株内生细菌,通过室内枝条防效实验,发现其中的6株对猕猴桃溃疡病致病菌的拮抗性比较稳定。
总之,经过十几年来的研究,国内外学者利用植物内生放线菌、内生真菌、内生细菌和芽孢杆菌来防治猕猴桃溃疡病的研究报道较少,而利用根际内生菌来防治溃疡病的研究则几乎没有。生产上,利用根际促生菌转化的生物菌剂,对苹果、桃、梨、草莓等[9]果树病害进行防治的方法已广泛使用。因此,笔者利用前期筛选出的9株根际内生菌[10]进行皿内抑菌活性试验和盆栽试验,旨在筛选出抑制猕猴桃致病菌更好的菌株,为下一步猕猴桃溃疡病生防菌株的研究提供了一定的参考。
1 材料与方法
1.1 材料
试验苗为植株长势相近的一年生的猕猴桃盆栽苗(品种为‘红阳’,株高1.2 m,主茎粗1.1 cm),2016年2月下旬进行。供试菌株为9株前期从绞股蓝根及其粘附土壤中筛选出的内生细菌:JDG6、JDG7、JDG14、JDG16、JDG18、JDG22、JDG23、JDG30、JDG32;指示菌 DX118由本地感溃疡病的猕猴桃植株上分离筛选鉴定后得到。
以无菌水为对照,将室内筛选得到的内生菌株JDG6、JDG16、JDG23发酵滤液按50倍、100倍、150倍稀释,每处理4次重复。采用喷雾法喷施待测发酵液,每5 d喷施1次,连续3次。7 d后在猕猴桃植株离地面主茎地面30—60 cm处用10号针将枝条韧皮部刺伤,刺30个部位,然后将沾有指示菌菌液(浓度1×109CFU/mL)的无菌药棉包住伤口,套上保鲜膜,进入常规管理。
1.2 培养基
内生菌TSB培养基:胰蛋白胨8.5 g+大豆蛋白胨1.5 g+NaCl 2.5 g+葡萄糖1.25 g+K2HPO41.25 g+琼脂10 g+蒸馏水500 mL,pH 7.5。
指示菌BPA培养基:牛肉浸膏1.5 g+蛋白胨2.5—5 g+蔗糖5 g+酵母膏5 g+琼脂8.5 g+蒸馏水500 mL,pH 7.0。
发酵培养基:葡萄糖40 g+豆饼粉20 g+酵母膏2 g+ZnSO4·7H2O 0.4 g+KH2PO40.2 g,pH 7.0
1.3 生防内生菌的室内筛选
将前期分离得到的9株内生菌,分别接种在TSB液体培养基中,在27℃,150 r/min条件下,恒温摇床培养24 h。将发酵液经过滤纸过滤后在3 500 r/min下离心10 min。提取上清液,用0.22μm滤膜过滤,即得发酵滤液[11]。
将指示菌DX118接种于5 mL BPA液体培养基,于28℃、150 r/min摇床培养24 h,用无菌水稀释制备1.5×108CFU/mL的菌悬液,取100μL指示菌悬液均匀涂布于BPA固体培养基上,然后将4个直径为6 mm的圆形滤纸按十字形放置在上面,而后以其中1个滴无菌水为对照,分别用移液松提取9株内生细菌100μL发酵滤液滴于其他3个滤纸片上,每种菌平行做3个样,28°C培养。48 h后观察各菌株的抑菌情况,并分别测量各抑菌圈的直径,求其平均值。
1.4 根际内生菌JDG6、JDG16、JDG23单胞分离与拮抗活性测定
采用单胞分离的方法进一步分离纯化1.3室内筛选得到的拮抗菌株,并再次对分离得到的单胞菌株进行抑菌活性测定[12]。
1.5 根际内生菌 JDG6、JDG16、JDG23的盆栽试验
接种30 d后观察病斑,统计病斑数,并用游标卡尺测量病斑大小(即叶片病斑和枝条病斑),计算发病率、病情指数和防治效果;60 d后,再次观察旧病斑的情况,测量旧病斑大小,统计新感染病班的个数,计算病斑扩展面积、病斑增长率和相对防效。
相关数据的处理方法:
病情指数[13]、防治效果、病斑扩展面积、病斑增长率、相对防效[14]的计算公式:病斑扩展面积=(旧伤口平均半径2-原伤口平均半径2)×3.14



表1 猕猴桃溃疡病程度分级标准[15]Table1 Classifiedstandardsofinfectiousdegreeinbacterialcankerkiwifruit
2 结果与分析
2.1 根际内生菌的室内筛选结果
室内筛选结果显示,9株根际内生菌中有3株对供试菌株(丁香假单胞杆菌 DX118)有不同程度的抑菌效果(图1),其中菌株JDG16对供试菌的抑菌效果最好,抑菌圈平均直径为14.5mm,菌株 JDG6和JDG23对其效果次之,抑菌圈平均直径分别为13.0mm、12.5mm,而其他的根际内生菌抑菌圈均不明显(表 1)。
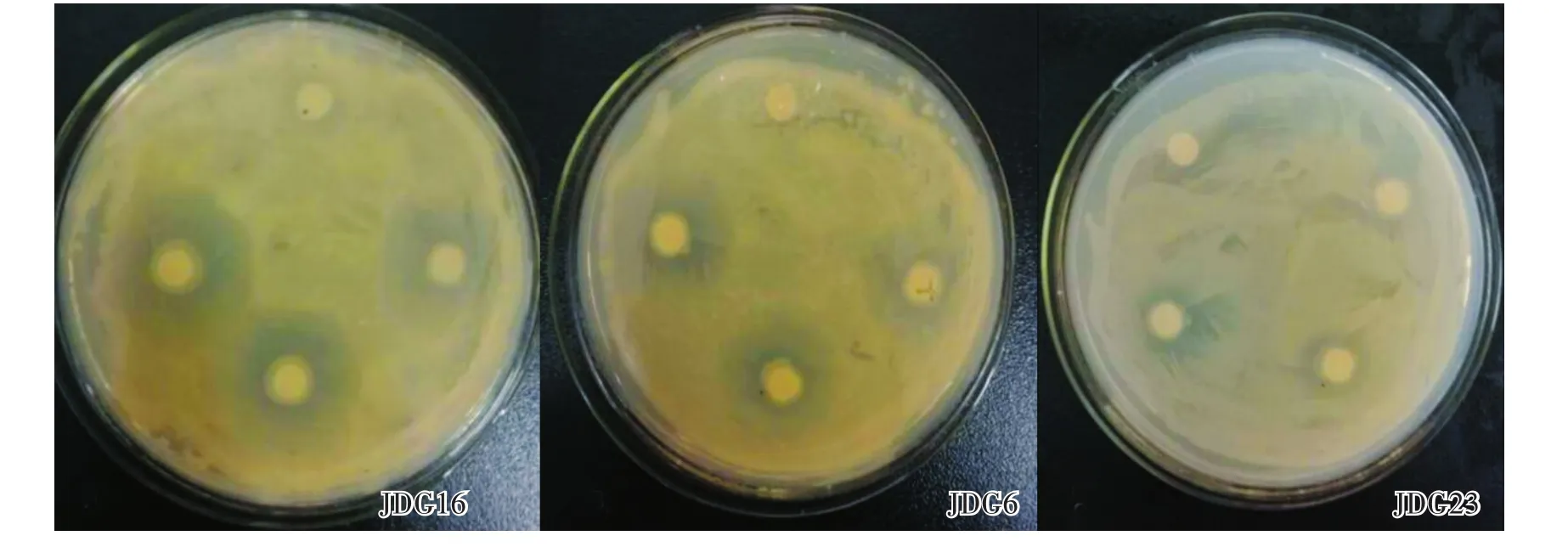
图1 根际内生菌JDG16、JDG6、JDG23对致病菌DX118的抑菌作用Fig1 ThebacteriostasisofrhizosphereendophytesJDG16,JDG6andJDG23onpathogenicbacteriumX118
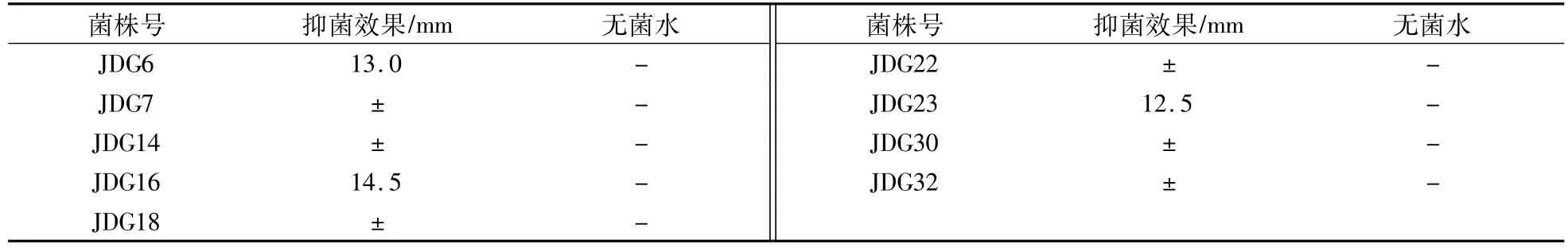
表2 根际内生菌JDG6、JDG16、JDG23对致病菌DX118的皿内拮抗效果Table2 Thein-vesselantagonismeffectofrhizosphereendophytesJDG6,JDG16andJDG23onpathogenicbacteriumX118
2.2 根际内生菌的盆栽效果
盆栽试验(表2和表3),当发酵滤液稀释100倍时,菌株JDG6,JDG16,JDG23均表现出较强的拮抗活性(表2)。其中,处理30d后的猕猴桃植株发病率明显比对照低,均在20%以下,防治后的病情指数均小于24%,而对照为57.8%,各处理的防治效果均在60%以上。这表明根际内生菌的发酵滤液可降低猕猴桃溃疡病致病菌入侵植株体内的机率,对致病病具有一定的阻碍作用。处理60d后,植株病斑增加个数较少,其病斑增长率均在21%以下,病斑扩展面积最大为3.04cm2,扩展面积显著低于对照(31.42cm2),且每处理的相对防效均在80%以上。这表明JDG6、JDG16、JDG23三种菌株的发酵滤液可抑制对猕猴桃溃疡病菌株(丁香假单胞菌DX118)在植株体内的扩展,可降低对植株的危害。

表3 根际内生菌JDG6、JDG16、JDG23发酵滤液对致病菌DX118的盆栽防治效果(30 d)Table 3 The pot control efficiency of rhizosphere endophytes JDG6,JDG16 and JDG23 fermentation filtrate on pathogenic bacterium X118(30 d)
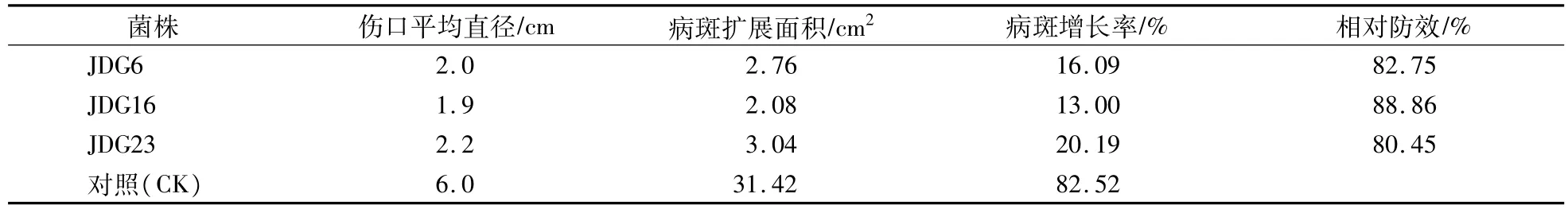
表4 根际内生菌JDG6、JDG16、JDG23发酵滤液对致病菌DX118的盆栽防治效果(60 d)Table 4 The pot control efficiency of rhizosphere endophytes JDG6,JDG16 and JDG23 fermentation filtrate on pathogenic bacterium X118(60 d)
3 结论与讨论
近年来,国内外研究者对根际细菌中的优势菌种——假单胞菌的拮抗病原菌已越来越重视[16-17],这方面的应用研究已有些报道,但将根际内生菌用于猕猴桃致病菌的生物防治的研究却少之甚少。如任智等[18]、邵红[19]、牟志美等[20]、徐大可[21]、李春宏等[22]分别对华重楼、春兰、桑树、越橘、棉花中的内生菌进行了研究,并在内生菌的拮抗作用方面取得了较好的成果。本研究利用前期分离筛选到的9株根际内生菌进行皿内拮抗活性测定,试验表明菌株JDG6、JDG16和JDG23抑制致病菌DX118的效果明显高于其他6菌株,其抑菌圈直径分别为13.0 mm、14.5 mm、12.5 mm。2015年张晖等[23]研究发现,香蕉根际耳炎假单胞菌对香蕉枯萎病病菌有很好的抑菌活性,与本研究结果基本一致。盆栽试验结果表明,JDG6、JDG16、JDG23菌株发酵液100倍稀释液时,抑制猕猴桃溃疡病致病菌的效果最为明显,其中JDG16菌株的相对防效达88.86%,但与JDG6、JDG23无明显差异。经16 srDNA分析,这3种菌株与猕猴桃致病菌 DX118属于假单胞菌属,因此分析这可能是由于这三株内生菌与猕猴桃的致病菌具有相同的生态位,在定殖过程中与猕猴桃的致病菌形成了营养物质的竞争关系,使致病菌因得不到所需的营养物质而被抑制或消亡,从而达到生物防治的效果。目前,本研究仅是对前期筛选出的9株根际内生菌进行了抑菌活性试验和盆栽试验,得到3株生防菌株对抑制猕猴桃溃疡病效果明显。但生防菌株对溃疡病致病菌的抑菌效果易受环境影响,具有一定的不确定性,故将其应用于生产仍有很多研究要做,下一步将对这3株菌株进行田间防效试验,进一步观察其防治效果。
[1]承河元,李瑶,万嗣坤,等.安徽省猕猴桃溃疡病病菌鉴定[J].安徽农业大学学报,1995,22(3):219-223.
[2]TAKIKAWAY L A R.Psendomonas syringae PV actinidia new Pathovar:The causal Bacterium of Canker of Kiwifruit in Japan[J].Ann Phytopathol Soc,1989,55(4):437-444.
[3]严婉荣,赵廷昌,肖彤斌,等.生防细菌在植物病害防治中的应用[J].基因组学与应用生物学,2013,32(4):533-539.
[4]CALVO C,ORELLANO M E.Antagonism of Bacillus species(strainBC121)towards Curvularia lunata[J].Curr.Sci.,2002,82(22):1457-1463.
[5]申哲,黄丽丽,涂璇,等.植物内生放线菌活性物质防治猕猴桃溃疡病[J].中国生物防治,2008,24(4):329-334.
[6]燕金宜.猕猴桃溃疡病鉴定及内生拮抗真菌的筛选[D].雅安:四川农业大学,2013.
[7]邵宝林,王成华,刘露希,等.猕猴桃溃疡病生防芽孢杆菌B2的鉴定及应用[J].中国农学通报,2015,31(26):103-108.
[8]郭睿文.猕猴桃内生菌多样性及溃疡病拮抗菌筛选[D].成都:成都理工大学,2016.
[9]CHET I,CHERNIN L.Biocontrol,microbial agents in soil[J].Encyclopedia of Environmental Microbiology,2002,45:465.
[10]宋金秋,吾鲁木汗·那孜尔别克,张缇.具有ACC脱氨酶活性的绞股蓝根际细菌的分离鉴定及其促生作用[J].吉首大学学报(自然科学版),2014,35(5):43-50.
[11]BAKER C J,STAVELY JR,MOCK N.Biocontrol of bean rust by Bacillus subtilis under field conditions[J].PlnatDis.1985,69:770-772.
[12]方中达.植病研究方法 [J].北京:中国农业出版社,1998.
[13]盛存波,安德荣,鲁燕汶,等.一株抗称猴桃溃疡病的芽抱杆菌分离和筛选研究初报[J].中国农学通报,2005,21(12):346-348.
[14]盛存波,安德荣,鲁燕汶,等.生防菌株B56-3防治称猴桃溃疡病应用研究[J]西北农业学报,2006,15(3):75-78.
[15]石志军,张慧琴,肖金平,等.不同猕猴桃品种对溃疡病抗性的评价[J].浙江农业学报,2014,26(3):752-759.
[16]SARAVANAN T,MUTHUSAMY M,MARIMUTHU T.Development of integrated approach to manage the fusarium wilt of banana[J].Crop Protection,2003,22(9):1117-1123.
[17]翟熙伦,杨金广,申莉莉,等.一株对TMV和PVY具有拮抗活性生防菌的筛选与鉴定[J].中国农业科学,2012,45(11):2180-2188.
[18]任智,张晓喻,祝凯,等.产薯蓣皂甙华重楼内生菌的筛选与鉴定[J].微生物学杂志,2007,27(2):6-9.
[19]邵红.春兰内生细菌群落多样性及功能菌株筛选[D].保定:河北大学,2011.
[20]牟志美,路国兵,冀宪领,等.桑树内生拮抗细菌 Burkholderia cepacia Lu10-1的分离鉴定及其内生定殖[J].微生物学报,2008,48(5):623-630.
[21]徐大可,夏秀英,魏立群,等.1株产几丁质酶的越橘内生拮抗细菌的研究[J].浙江大学学报.2009,35(4):395-400.
[22]李春宏,邓渊钰,赵明文,等.棉花内生细菌数量动态及其对棉花黄、枯萎病菌的拮抗作用[J].微生物学报,2009,49(9):1196-1202.
[23]张晖,宋圆圆,吕顺,等.香蕉根际促生菌的抑菌活性及对作物生长的促进作用[J].华南农业大学学报,2015,36(3):65-70.
Prelim inary exploration of biocontrol effect of rhizsphere endophyte on kiw i fruit canker
CUILi-hong,SONG Jin-qiu*,CHEN Ji-fu,ENTEMAKE·Bulatibai,TIAN Qing-wu(Xiangxi National Vocational Technical College,Jishou416000,China)
The in-vessel antagonism activity testwas conducted toward the 9 rhizosphere endophytes gained by primary stage’s separation and purification,and the JDG6,JDG16 and JDG23 bacterial strains which possessed significant inhibitory effect toward the pathogenic bacterium of kiwifruit bacterial canker were screened.Themean diameters of their inhibition zoneswere 13.0 mm,14.5 mm,and 12.5 mm.The JDG16 had the best inhibitory effect.The pot experiment was conducted toward the 3 bacterial strains.The results showed thatwhen the dilution of fermentation filtrate was 100,all JDG6,JDG16 and JDG23 had strong antagonistic activity and could decrease the invasion rate of the pathogenic bacterium of kiwifruit bacterial canker,restrain the extension of bacteria in the plantand decrease the damage of bacteria toward the plant.Thus,the results provided some reference for the research on biocontrol strain of kiwifruit bacterial canker.
Rhizosphere endophytes;Kiwi fruit canker;Bacteriostatic activity;Biological prevention
2017-03-01
湘西州2016年科技研发项目(重大项目)“猕猴桃细菌性溃疡病抗性砧木的选育与研究”;2016年度湖南省教育厅科学研究项目(16C15386);2015年度湖南省教育厅科学研究项目(15C1367)
崔丽红(1979—),女,硕士,副教授,研究方向:猕猴桃栽培与育种。E-mail:153280671@qq.com
*通信作者:宋金秋(1982—),女,硕士,讲师,主要从事微生物生态及植物病害防治研究。E-mail:64190208@qq.com
S436.634.1
A
1000-3924(2017)06-028-05
张睿)

