干扰素诱导跨膜蛋白3在结肠癌组织中的表达及对结肠癌细胞凋亡的调控作用研究
卞俊杰,李醒亚,郭伟华,田国防,贵永贤,吕振选
(1.河南省新乡市中心医院 肿瘤内科,河南 新乡 453000;2.郑州大学第一附属医院 肿瘤科,河南 郑州 450052)
干扰素诱导跨膜蛋白3在结肠癌组织中的表达及对结肠癌细胞凋亡的调控作用研究
卞俊杰1,李醒亚2,郭伟华1,田国防1,贵永贤1,吕振选1
(1.河南省新乡市中心医院 肿瘤内科,河南 新乡 453000;2.郑州大学第一附属医院 肿瘤科,河南 郑州 450052)
目的探讨干扰素诱导跨膜蛋白3(IFITM 3)在结肠癌组织中的表达及对结肠癌细胞凋亡的调控作用。方法实时荧光定量聚合酶链反应(qRT-PCR)检测结肠癌组织和对应的癌旁组织中IFITM 3的表达水平。细胞转染si-IFITM 3抑制IFITM 3的表达,同时转染si-control作为对照,MTT检测转染后48 h的细胞增殖情况。流式细胞术检测细胞凋亡情况。Western blot检测细胞中Bcl-2、Bax、p-STAT3、STAT3蛋白表达水平。结果IFITM 3在结肠癌组织中的表达水平高于癌旁组织,差异有统计学意义(P<0.05)。si-IFITM 3组结肠癌细胞HT29和HCT116的存活率与si-control组相比下降,差异有统计学意义(均P<0.05)。转染si-IFITM 3后的结肠癌细胞HT29和HCT116凋亡率高于si-control组,差异有统计学意义(均P<0.05)。转染si-IFITM 3后的结肠癌细胞HT29和HCT116中STAT3蛋白表达水平没有变化,p-STAT3、Bcl-2蛋白表达水平低于si-control组,Bax蛋白表达水平高于si-control组。结论干扰素诱导跨膜蛋白3在结肠癌组织中过度表达。抑制干扰素诱导跨膜蛋白3的表达,可以抑制结肠癌细胞的增殖,促进癌细胞凋亡,其作用机制与Bcl-2、Bax、STAT3有关。
结肠癌;干扰素诱导跨膜蛋白3;凋亡;增殖
结肠癌是一种常见的发生于消化道的恶性肿瘤,其发病率在所有胃肠道恶性肿瘤中位居第2位[1]。结肠癌多发生于40岁以后的人群,其中男性的发病率为女性发病率的2倍[2]。在中国,结肠癌每年死亡人数在全部恶性肿瘤中位居第5位[3]。环境、生活方式、饮食习惯等多种因素都可引发结肠癌。结肠癌严重威胁着人类的生命健康。
干扰素诱导跨膜蛋白(interferon-induced transmembrance,IFITM)广泛存在于不同种属的细胞内。IFITM 3具有广泛的抗病毒作用[4]。近年来研究表明,IFITM在乳腺癌组织中高表达,沉默IFITM 3基因的表达后,乳腺癌细胞增殖能力明显降低[5]。本研究通过实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)法检测IFITM 3基因在结肠癌组织中的表达水平,探讨IFITM 3基因对结肠癌细胞的增殖凋亡作用,以期为进一步研究结肠癌的发病机制提供依据。
1 资料与方法
1.1 一般资料
1.1.1 细胞及组织 人结肠癌细胞HT29和HCT116购自于中国科学院细胞库。人结肠癌组织及正常的癌旁组织各50例来自2011年1月-2014年6月在新乡市中心医院确诊治疗的结肠癌患者。
1.1.2 主要试剂及仪器 RPMI1640培养基、胰蛋白酶、青链霉素均购自于美国Sigma公司,BCA蛋白浓度检测试剂盒、逆转录试剂盒、荧光定量PCR试剂盒、MTT、Trizol细胞裂解液、Annexin V-FITC、PI、Loading buffer、PVDF膜、DMSO溶液均购自于北京鼎国生物试剂有限公司,Bcl-2多克隆抗体、Bax多克隆抗体、p-STAT3多克隆抗体、STAT3多克隆抗体、GAPDH单克隆抗体、辣根过氧化物标记的二抗均购自于杭州联科生物科技有限公司,流式细胞仪购于美国Thermo公司,紫外分光光度计购自于上海精密仪器表公司,二氧化碳CO2培养箱购自日本三洋公司。
1.2 方法
1.2.1 qRT-PCR检测IFITM 3在结肠癌组织中的表达 收集的50例结肠癌组织和正常的癌旁组织剪碎后,加入适量的Trizol细胞裂解液,充分混合后,放置于室温下裂解5 min。在裂解液中加入氯仿200μl,上下剧烈摇晃20次,放在室温下静置5 min。14 000 r/min,4℃离心15 min,用移液枪吸取上层水相层至新的EP管中,每个EP管中加入500μl的异丙醇后,放置于冰上静置10 min。14 000 r/min,4℃离心15 min。收集RNA沉淀,用75%的乙醇洗涤后,放置于室温条件下晾干,加入DEPC水溶解后,紫外分光光度计检测提取的RNA浓度及纯度。按照逆转录试剂盒说明书逆转录合成IFITM 3的cDNA,qRT-PCR检测IFITM 3表达水平。正向引物:5'-TGTCCAAACCTTCTTCTC-3',反向引物:5'-CGTCG CCAACCATCTTCC-3'。
1.2.2 细胞培养 培养人结肠癌细胞HT29和HCT116用含有10%胎牛血清的RPMI1640培养基,培养条件为37℃,湿度为95%,5% CO2培养箱。观察细胞融合度达到90%时,进行细胞传代。细胞传代用0.25%的胰蛋白酶消化细胞。
1.2.3 细胞转染 培养至对数生长期的人结肠癌细胞HT29和HCT116,加入胰蛋白酶消化细胞后,1 000 r/min离心10 min后,加入细胞生长液调整细胞浓度为2×104个/ml,接种至6孔细胞培养板中,每孔中加入2 ml细胞悬液。放置于CO2培养箱中培养。观察细胞融合度为60%左右时,按照常规方法将IFITM 3抑制物(si-IFITM 3)转染到结肠癌细胞中,同时转染si-control作为对照。转染后6 h更换为含有胎牛血清的细胞生长液,放置于37℃,5% CO2培养箱中继续培养48 h。
1.2.4 MTT检测细胞增殖 取转染后的结肠癌细胞,培养至对数生长期后,接种于96孔细胞培养板中,调整细胞浓度使每孔中细胞个数为2×103个。同时设置空白组,空白组中不加入细胞,加入等量的细胞生长液。每组设置7个复孔,以提高实验准确性。培养48 h后,在细胞中加入5 mg/ml的MTT溶液,每孔加入20μl。放置于37℃继续孵育4 h后,弃掉细胞培养液,在细胞中加入DMSO溶液,每孔中加入100μl。充分混合后,观察结晶物完全融化后,用酶标仪检测490 nm处每孔的吸光度,计算细胞的存活率。细胞存活率=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)
1.2.5 流式细胞术检测细胞凋亡 收集处于对数生长期的结肠癌细胞,加入细胞生长液,调整细胞浓度为1×106个/ml。取1 ml细胞悬浮液,1 000 r/min离心10 min后,加入提前预冷的PBS洗涤细胞2次。在细胞中加入Annexin V-FITC和PI各5μl后,充分混合,放置于室温下孵育20 min。加入400μl的结合缓冲液,混合均匀后,用流式细胞仪检测细胞的凋亡情况。
1.2.6 Western blot检测细胞中Bcl-2、Bax、p-STAT3、STAT3表达水平 取处于对数生长期的结肠癌细胞,弃掉细胞生长液,在细胞中加入含有PMSF浓度为1%的RIPA裂解液裂解细胞,每个6 cm的细胞培养皿中加入200μl体积的细胞裂解液。放置于冰上充分裂解40 min,观察细胞完全裂解后,12 000 r/min,4℃离心15 min。取上清液,用BCA蛋白浓度检测试剂盒检测提取的蛋白浓度。将提取的蛋白样品与5×Loading buffer充分混合后,放置于100℃水浴锅中煮沸5 min。取50μl变性蛋白样品加入到上样孔中,蛋白凝胶用12%分离胶和5%浓缩胶。电泳初始电压为80 V,终末电压为120 V。电泳结束后,蛋白凝胶在4℃转膜90 min,转膜电压为90 V。转膜后,PVDF膜依次与一抗、二抗孵育反应后,在暗室中曝光,分析蛋白表达含量。
1.3 统计学方法
采用SPSS22.0统计学软件进行数据分析,数据以均数±标准差(±s)表示,计量资料采用单因素方差分析进行比较,P<0.05为差异具有统计学意义。
2 结果
2.1 IFITM 3在结肠癌组织中的表达
收集的50例结肠癌组织和正常的癌旁组织经RNA提取,逆转录合成cDNA后,qRT-PCR检测IFITM 3水平。结果显示,IFITM 3在结肠癌组织中的表达水平高于癌旁组织,差异具有统计学意义(t=6.371,P=0.001)。见图 1。
2.2 细胞增殖结果
收集转染si-IFITM 3和si-control后培养48 h的细胞,MTT检测细胞增殖情况。结果显示,转染si-IFITM 3后,结肠癌细胞HT29和HCT116的存活率与si-control组相比下降,差异具有统计学意义(tHT29=6.438,PHT29=0.001;tHCT116=5.984,PHCT116=0.002)。见图2。
2.3 细胞凋亡结果

图1 IFITM 3在结肠癌组织和癌旁组织中的表达
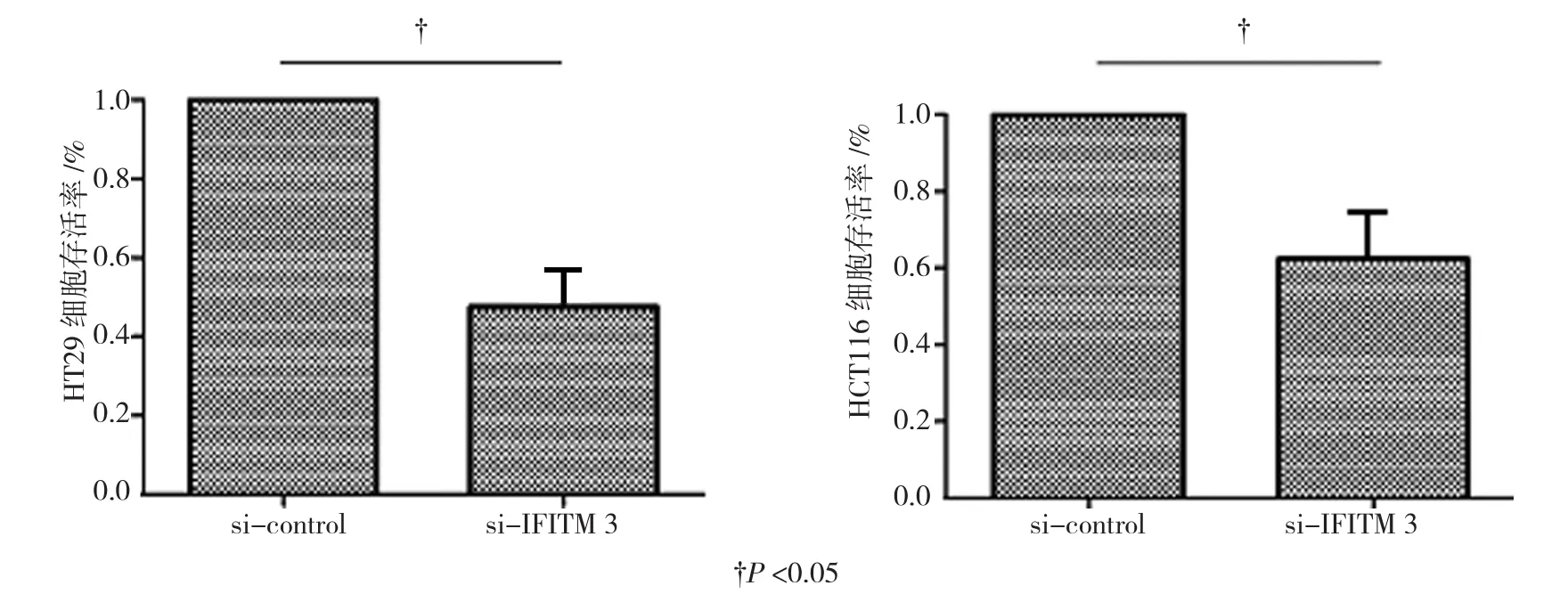
图2 IFITM 3对结肠癌细胞存活率的影响
收集转染si-IFITM 3和si-control后培养48 h的细胞,经Annexin V-FITC和PI双染色后,流式细胞术检测细胞凋亡情况。结果显示,转染si-IFITM 3后的结肠癌细胞HT29和HCT116凋亡率高于si-control组,差异具有统计学意义(tHT29=6.158,PHT29=0.002;tHCT116=8.967,PHCT116=0.000)。见图 3。
2.4 细胞中 Bcl-2、Bax、p-STAT3、STAT3 表达结果
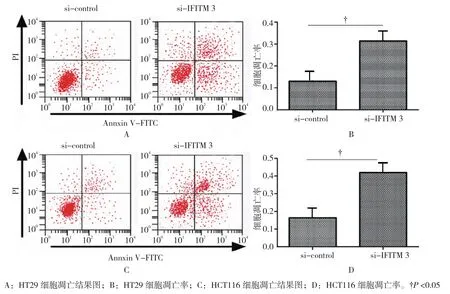
图3 IFITM 3对结肠癌细胞凋亡率的影响
收集转染si-IFITM 3和si-control后培养48 h的细胞,经细胞总蛋白提取,Western blot检测细胞中Bcl-2、Bax、p-STAT3、STAT3蛋白表达水平。结果如图4显示:与si-control组相比,si-IFITM 3组HT29-p-STAT3表达差异有统计学意义(t=8.897,P=0.000),与si-control组相比,si-IFITM 3组HT29-Bcl-2表达差异有统计学意义(t=8.217,P=0.001),与si-control组相比,si-IFITM 3组HT29-Bax表达差异有统计学意义(t=8.384,P=0.001);与si-control组相比,si-IFITM 3组HCT116-p-STAT3表达差异有统计学意义(t=9.054,P=0.000),与 si-control组相比,si-IFITM 3组HCT116-Bcl-2表达差异有统计学意义(t=8.587,P=0.001),与si-control组相比,si-IFITM 3组HCT116-Bax表达差异有统计学意义(t=9.035,P=0.000)。转染si-IFITM 3后的结肠癌细胞HT29和HCT116中STAT3蛋白表达水平没有变化,p-STAT3、Bcl-2蛋白表达水平低于si-control组,Bax蛋白表达水平高于si-control组。
3 讨论
结肠癌是一种常见的严重危害人类生命健康的疾病。结肠癌的发病率和死亡率极高,尤其是近年来随着人们生活水平的不断提高,结肠癌的发病率呈现逐年上升的趋势[6]。研究结肠癌的发病机制,对于治疗和诊断结肠癌的发生具有重要意义。
IFITM 3是IFITM蛋白家族中的一员[7]。最早发现IFITM在抗病毒方面具有重要作用,对肝炎病毒、艾滋病病毒、巨细胞病毒等都具有防御作用。IFITM的抗肿瘤作用是近年来研究的热点[8-9]。IFITM在宫颈癌、胶质瘤等头颈部的肿瘤中过度表达[10-11]。幽门螺旋杆菌感染的浸润癌以及胃癌前的病变中IFITM异常高表达[12]。IFITM 3在乳腺癌、肝癌中高表达,沉默IFITM 3后,肝癌细胞的侵袭迁移能力明显降低[13-14]。本研究收集了50例结肠癌组织和相对应的癌旁组织,qRT-PCR检测发现IFITM 3在结肠癌组织中高表达,与癌旁组织相比差异具有统计学意义。转染si-IFITM 3后,MTT检测了转染后48 h的细胞增殖情况发现,沉默IFITM 3表达可以抑制直肠癌细胞的增殖。
细胞凋亡的发生是一种正常的生物学现象[15]。在某些病理条件下,细胞增殖和凋亡不能维持正常的动态平衡,导致了癌症的发生。细胞凋亡受多种基因的复杂调控。Bcl-2蛋白家族与细胞凋亡密切相关。Bcl-2和Bax均属于Bcl-2蛋白家族中的成员,Bcl-2在细胞凋亡过程中发挥抑制作用,而Bax发挥促进作用[16]。信号转导与转录活化因子STAT3是STAT家族中的一员,在STAT信号转导通路中发挥重要作用[17]。STAT3参与乳腺癌、胃癌、前列腺癌、肝癌等多种癌细胞的生长发育[18-19]。STAT3在肿瘤中异常活化,是一种具有致癌作用的潜在因子[20]。本研究中,流式细胞仪检测了结肠癌细胞沉默IFITM 3后的细胞凋亡情况,沉默IFITM 3后2种结肠癌细胞的凋亡率均升高。Western blot检 测 Bcl-2、Bax、p-STAT3、STAT3蛋白表达变化,发现沉默IFITM 3后,结肠癌细胞中Bax蛋白表达升高,而Bcl-2、p-STAT3表达受到抑制。这提示,IFITM 3可以通过调控Bcl-2、Bax、p-STAT3表达影响结肠癌细胞的凋亡。
综上所述,IFITM 3在结肠癌组织中高表达。沉默IFITM 3后,结肠癌细胞增殖受到抑制,细胞凋亡增加,其作用机制与Bcl-2、Bax、STAT3有关。这为进一步研究结肠癌的发病机制奠定了基础,为诊断和治疗结肠癌提供了新方向。
[1]崔明, 陈东来, 刘茂兴, 等. MSKCC 结肠癌生存预测模型单中心验证性研究[J]. 中国实用外科杂志, 2016, 36(2): 210-213.
[2]何胜利, 沈婕, 徐选福, 等. 厚朴酚联合 5-FU对人结肠癌HCT-8细胞增殖和SFRP-4表达的影响[J]. 肿瘤, 2016, 34(12):1097.
[3]张静. Th17细胞及相关细胞因子在老年结肠癌患者中的表达[J]. 中国老年学杂志, 2016, 36(09): 2179-2181.
[4]陈俊娜, 孙晓琳, 董仕超. Rab5a促进CpG诱导的巨噬细胞中炎性细胞因子和Ⅰ型干扰素的表达[J]. 中国免疫学杂志, 2016,32(2): 165.
[5]OGONY J, CHOI H J, LUI A, et al. Interferon-induced transmembrane protein 1 (IFITM1) overexpression enhances the aggressive phenotype of SUM149 in fl ammatory breast cancer cells in a signal transducer and activator of transcription 2 (STAT2)-dependent manner[J]. Breast Cancer Research, 2016, 18(1): 1.
[6]SUBRAMANIAM D, PONNURANGAM S, DANDAWATE P R,et al. Targeting colon cancer stem cells: Novel marmelin analog THB suppresses DCLK1 and notch signaling[J]. Cancer Research,2016, 76(14): 4748.
[7]王金凤, 王瑞兰. 干扰素诱导跨膜蛋白3在H7N9中的研究进展[J]. 国际呼吸杂志, 2015, 35(14): 1082-1085.
[8]WILKINS J, ZHENG Y M, YU J, et al. Nonhuman primate IFITM proteins are potent inhibitors of HIV and SIV[J]. PloS one, 2016,11(6): 0156739.
[9]NARAYANA S K, HELBIG K J, MCCARTNEY E M, et al. The interferon-induced transmembrane proteins, IFITM1, IFITM2, and IFITM3 inhibit hepatitis C virus entry[J]. Journal of Biological Chemistry, 2015, 290(43): 25946-25959.
[10]YU F, XIE D, NG S S, et al. IFITM1 promotes the metastasis of human colorectal cancer via CAV-1[J]. Cancer letters, 2015,368(1): 135-143.
[11]BORG D, HEDNER C, GABER A, et al. Expression of IFITM1 as a prognostic biomarker in resected gastric and esophageal adenocarcinoma[J]. Biomarker Research, 2016, 4(1): 1.
[12]SUO S, REN X. Importance of interferon inducible transmembrane proteins and retinoic acid inducible gene I for influenza virus replication: A review[J]. Critical reviews in microbiology, 2016, 42(1): 75-82.
[13]FANOODI T S, MOTALLEB G, MOGHADAM A Y, et al. p21 gene expression evaluation in esophageal cancer patients[J].Gastrointestinal Tumors, 2015, 2(3): 144-164.
[14]吴荣寿, 邬林泉, 李科浩, 等. IFITM3在原发性肝癌中的表达及其对MMP-9调控效应[J]. 中国普通外科杂志, 2016, 25(1):68-76.
[15]景晓平, 程伟伟, 何丽. 白藜芦醇对MGC803细胞凋亡因子Bad, p-Bad, Caspase-3的影响[J]. 中国实验方剂学杂志, 2016,22(5): 147-150.
[16]武莉, 曹定睿, 刘臻, 等. 依托咪酯后处理对大鼠肝缺血再灌注肾细胞凋亡及Bcl-2和Bax表达的影响[J]. 中国药物与临床,2015, 15(4): 480-482.
[17]KANNAPPAN R, YADAV V R, AGGARWAL B B. γ-Tocotrienol but not γ-tocopherol blocks STAT3 cell signaling pathway through induction of protein-tyrosine phosphatase SHP-1 and sensitizes tumor cells to chemotherapeutic agents[J]. Journal of Biological Chemistry, 2016, 291(32): 16922.
[18]THAPER D, VAHID S, BISHOP J L, et al. New derivative of galiellalactone inhibits the STAT3 activity and suppresses ENZ-resistant prostate cancer in vitro[J]. Cancer Research, 2015,75(15): 728.
[19]LIN J M, CHOU J L, FRANKHOUSER D E, et al. Aberrant JAK/STAT signaling orchestrates global promoter methylation and promotes TGF-βmediated EMT through epigenetic silencing of miR-193a in gastric cancer[J]. Cancer Research, 2016, 76(14):1501.
[20]郑炜望. STAT3与肿瘤关系的研究综述[J]. 现代中西医结合杂志, 2015, 24(27): 3074-3078.
Expression of IFITM3 in colon cancer tissue and its effect on apoptosis of colon cancer cells
Jun-jie Bian1, Xing-ya Li2, Wei-hua Guo1, Guo-fang Tian1, Yong-xian Gui1, Zhen-xuan Lü1
(1. Department of Medical Oncology, Xinxiang Central Hospital, Xinxiang, Henan 453000, China;2. Department of Oncology, the First Aff i liated Hospital, Zhengzhou University,Zhengzhou, Henan 450052, China)
ObjectiveTo investigate the expression of interferon-induced transmembrane 3 (IFITM3) in colon cancer tissues and its effect on the apoptosis of colon cancer cells.MethodsThe expression level of IFITM3 in colon cancer tissues and corresponding adjacent tissues was detected by qRT-PCR. Colon cancer cells were transfected with si-IFITM3, while si-control was used as a control. The proliferation of the transfected cells was detected by MTT.Cell apoptosis was detected by fl ow cytometry. Western blot was used to detect the expression levels of Bcl-2, Bax,p-STAT3 and STAT3 proteins in the cells.Results The expression level of IFITM3 in the colon carcinoma tissues was signi fi cantly higher than that in the adjacent tissues, and the difference was statistically signi fi cant (P< 0.05).The survival rates of colon cancer HT29 and HCT116 cells of the si-IFITM3 groups were signi fi cantly decreased compared with those of the si-control groups (P< 0.05). The apoptosis rates of colon cancer HT29 and HCT116 cells of the si-IFITM3 groups were signi fi cantly higher than those of the si-control groups, and the differences were statistically signi fi cant (P< 0.05). The expression levels of STAT3 in the si-IFITM3-transfected HT29 and HCT116 cells did not change compared with those in the si-control groups, but the expressions of p-STAT3 and Bcl-2 protein were significantly lower than those in the si-control groups, and Bax protein expression levels were significantly higher than those in the si-control groups.ConclusionsIFITM3 is over-expressed in colon cancer tissues. Inhibition of IFITM3 expression can inhibit the proliferation of colon cancer cells and promote the apoptosis of the cancer cells,its mechanism is related to Bcl-2, Bax and STAT3.
colon cancer; IFITM3; apoptosis; proliferation
10.3969/j.issn.1005-8982.2018.01.009
1005-8982(2018)01-0044-06
2017-02-13
R735.3
A
(张西倩 编辑)

