胃袖状切除术改善2型糖尿病小鼠脂肪组织胰岛素抵抗机制研究*
赵文嫣,孙明,冯勇,耿东华,刘金钢
(1.中国医科大学附属盛京医院1.普通外科,2.泌尿外科,辽宁 沈阳 110004;3.中国医科大学附属第四医院 普通外科,辽宁 沈阳 110032)
胃袖状切除术改善2型糖尿病小鼠脂肪组织胰岛素抵抗机制研究*
赵文嫣1,孙明2,冯勇1,耿东华1,刘金钢3
(1.中国医科大学附属盛京医院1.普通外科,2.泌尿外科,辽宁 沈阳 110004;3.中国医科大学附属第四医院 普通外科,辽宁 沈阳 110032)
目的探讨胃袖状切除术(SG)对2型糖尿病小鼠脂肪组织微囊蛋白1(caveolin -1)表达及胰岛素抵抗的影响。方法实验于2015年1~6月在中国医科大学附属盛京医院中心实验室进行。选择30只肥胖2型糖尿病小鼠(+db/+db,C57BL/KsJ)为研究对象,按体重随机等分为3组:db/db组(无处理)、db/db-SG组(行SG)、db/db-sham组(假手术),每组10只。术前3 d和术后7、14、21及28 d测定动物体重及每100 g体重摄食量。术前5 d和术后30 d,测定小鼠空腹血糖(FBG)及口服葡萄糖耐量(OGTT),ELISA检测血浆胰岛素、三酰甘油(TG)、胆固醇(TC)、低密度脂蛋白(LDL);Western blot和实时聚合酶链反应(Real-time PCR)检测内脏脂肪组织caveolin-1、GLUT4蛋白及mRNA表达。结果db/db-SG组小鼠术后体重、摄食量、空腹血糖、OGTT曲线下面积、胰岛素抵抗指数与db/db组及db/db-sham组比较,差异有统计学意义(P<0.05),db/db-SG组小鼠术后体重及摄食量降低,空腹血糖下降,OGTT曲线下面积减少,胰岛素抵抗指数下降;db/db-SG组血清TG、TC、LDL水平与db/db组及db/db-sham组比较,差异有统计学意义(P<0.05),db/db-SG组小鼠下降;db/db-SG组小鼠脂肪组织caveolin-1、GLUT4蛋白和mRNA表达与db/db组及db/db-sham组比较,差异有统计学意义(P<0.05),均升高。结论SG可在术后短期内有效降低2型糖尿病小鼠体重及摄食量,降低TG、TC,改善胰岛素抵抗,可能与脂肪组织caveolin-1及GLUT4水平下降有关。
袖状胃切除;脂肪组织;胰岛素抵抗;脂肪组织微囊蛋白1
胃袖状切除术(sleeve gastrectomy,SG)是常用减重手术的一种,术中切除胃大弯侧80%左右的胃体,减重效果确切。现已有多项研究证实SG可缓解胰岛素抵抗(insulin resistance,IR)[1-2],但具体机制尤其是对脂肪组织IR的影响仍不明确。质膜微囊(caveolae)是细胞膜上直径约50~100 nm的烧瓶状内陷区域,具有脂质双层结构,与细胞内外的物质转运、信号转导等事件有关。微囊蛋白1(caveolin-1)是caveolae表面上的标记蛋白,在脂肪细胞中特异性表达[3]。研究发现,在脂肪细胞中胰岛素可诱导GLUT4转位至富含caveolae/caveolin-1的细胞膜上,与其共定位及表达,参与葡萄糖的跨膜转运。鉴于此,本研究以肥胖2型糖尿病小鼠(db/db)为研究对象,探讨SG对脂肪组织IR以及caveolin-1、葡萄糖转运体(GLUT4)表达的影响,为进一步揭示SG改善脂肪组织IR的机制提供新的思路。
1 材料与方法
本实验于2015年1~6月在中国医科大学附属盛京医院中心实验室进行。
1.1 动物分组及处理
选择6~7周龄雄性db/db小鼠(Leprdb,db/db,C57BL/KsJ)30只,均购自南京大学模式动物研究所。术前至少10 d单笼正常饮食饲养。1周后检测db/db小鼠体重及空腹血糖(fasting blood glucose,FBG),以FBG≥8.0 mmol/L为自发糖尿病模型的入选标准。入选的8周龄肥胖型2型糖尿病小鼠(db/db小鼠)30只按体重随机分为3组:db/db组、db/db-SG组、db/db-sham组,每组均为10只。所有小鼠适应环境1周后开始实验。
1.2 方法
1.2.1 db/db-SG组 行SG。术前6 h禁食水,10%水合氯醛0.3 ml/100 g体重腹腔注射麻醉,固定于操作台,取上腹正中切口1 cm,逐层切开入腹腔探查无异常继续手术,由幽门下至胃底游离大弯侧血管,再由大弯侧向胃底方向切除3/5胃体,残余胃体以6~0无损伤线缝合。关腹前青霉素8万u/100 g体重腹腔注射预防感染,术后4 h进流食(10%葡萄糖),48 h后正常鼠料喂养。
1.2.2 db/db-sham组 麻醉、术前术后给药、进食与db/db-SG组一致,取上腹正中切口1 cm,逐层切开入腹腔探查,胃前壁作0.5 cm切口,原位缝合。db/db-sham组不采取任何处理措施。术后30 d,10%水合氯醛0.3 ml/100 g体重腹腔注射麻醉,下腔静脉采血,留血清-80℃冷冻保存;处死全部小鼠后取附睾脂肪组织-80℃保存。
1.2.3 db/db组 相应指标检测时间与db/db-SG组及db/db-sham组相同,无特殊处理。
1.3 检测指标
①术前3 d和术后7、14、21、28 d测定动物体重及每100 g体重摄食量。②血糖及口服葡萄糖耐量试验(OGTT):术前5 d和术后30 d血糖仪各测空腹12 h血糖(FBG)1次;术前2 d和术后30 d各测1次OGTT,方法为测FBG后给予50%葡萄糖1.5 g/kg体重灌胃;尾静脉采血,时间点分别为0、30、60、90、120 min。③采用ELISA法检测血浆胰岛素、总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白(LDL)。计算胰岛素抵抗指数(HOMA-IR),HOMA-IR=(G0×I0)/22.5,其中 G0为 FBG(mmol/L),I0为空腹血浆胰岛素(μu/ml)。④实时聚合酶链反应(real-time polymerase chain reaction,real-time PCR)检测脂肪组织caveolin-1及GLUT4 mRNA表达,扩增条件:95℃ 30s变性,60℃ 30 s退火,72℃ 45s延伸,40个循环,最后72℃延伸5 min。caveolin-1引物,正向:5'-GGGACATCTCTACACTGTTCCCATC-3',反向:5'-CTTCTGGTTCTGCAATCACATCTTC-3';GLUT4 引物,正向:5'-CTGTAACTTCATTGTCGGCATGG-3',反向:5'-AGGCAGCTGAGATCTGGTCAAAC-3';GAPDH引物,正向:5'-CACCCTGTGCTGCTCACCGAGGCC-3',反 向 :5'-CCACACAGATGACTTGCGCTCAGG-3'。 ⑤Western blot法检测脂肪组织caveolin-1及GLUT4表达。
1.4 统计学方法
应用SPSS13.5软件进行统计学处理。各组数据采用均数±标准差(±s)表示,比较采用重复测量设计的方差分析,两两比较采用Student'st检验,P<0.05为差异有统计学意义。
2 结果
全部手术小鼠成活,手术均顺利完成,动物模型复制成功。
2.1 3组小鼠体重比较
采用方差分析比较3组小鼠体重,术前各组小鼠体重差异无统计学意义(F=0.151,P=0.863)。术后7、14、21和28 d各组小鼠体重差异采用重复测量设计的方差分析,结果:①术后3组间小鼠体重差异有统计学意义(F=23.056,P=0.002);②db/db-SG组内术后7、14、21及28 d体重有差异(F=14.029,P=0.005),db/db组和db/db-sham组各检测时间点体重无差异(F=0.422和0.386,P=0.445和0.563);③术后小鼠体重随时间推移下降趋势有统计学意义(F=10.009,P=0.000),db/db-SG组小鼠术后7 d内体重下降明显,在检测时间段内,随时间推移呈继续下降趋势。两两比较采用Student'st检验,术后7~28 d db/db-SG组小鼠体重持续下降,与db/db组比较(7 d:t=-3.386,P=0.028;14 d:t=-7.735,P=0.002;21 d:t=-0.596,P=0.010;28 d:t=-5.894,P=0.004),与db/db-sham 组比较(7 d:t=-3.343,P=0.029;14 d:t=-5.495,P=0.005;21 d:t=-4.135,P=0.014;28 d:t=-5.648.386,P=0.010),差异有统计学意义。见表1。
2.2 3组小鼠摄食量比较
采用方差分析比较术前各组间摄食量,差异无统计学意义(F=0.293,P=0.756)。术后7、14、21和28 d各组小鼠摄食量差异采用重复测量设计的方差分析,结果:①术后3组间小鼠摄食量差异有统计学意义(F=5.196,P=0.049);②db/db-SG组内术后7、14、21和28 d摄食量有差异(F=9.009,P=0.015),db/db组和db/db-sham组各检测时间点摄食量无差异(F=0.521和0.235,P=0.349和0.615);③术后小鼠摄食量随时间推移下降趋势无差异(F=0.892,P=0.071),db/db-SG组小鼠术后7 d内摄食量下降明显,但随时间推移下降趋势无差异。两两比较采用Student'st检验,db/db-SG组与db/db组比较(7 d:t=-3.864,P=0.018,14 d:t=-2.771,P=0.049;21 d:t=-4.157,P=0.014;28 d:t=2.877,P=0.045) 及db/db-sham组比较(7 d:t=-4.444,P=0.011,14 d:t=-3.169,P=0.034;21 d:t=-2.966,P=0.039;28 d:t=-3.134,P=0.0132)差异有统计学意义。见表2。
2.3 3组小鼠术前、术后FBG、OGTT、HOMAIR比较
术前3组FBG、OGTT曲线下面积、HOMA-IR比较,差异无统计学意义(P>0.05)。而术后30 d时db/db-SG组上述3个指标与db/db-sham组和db/db组比较,差异有统计学意义(P<0.05)。两两比较采用Student'st检验,db/db-SG组FBG与db/db组及db/db-sham组比较,均差异有统计学意义(t=-8.419和-7.689,P=0.001和0.002),db/db-SG组FBG下降;小鼠OGTT曲线下面积db/db-SG组与db/db组及db/db-sham组比较,均差异有统计学意义(t=-13.349和-12.579,均P=0.000),db/db-SG组OGTT曲线下面积下降;db/db-SG组HOMA-IR与db/db组及db/db-sham组比较,均差异有统计学意义(t=-12.970和-12.010,均P=0.000),db/db-SG组HOMA-IR下降。见表3。
表1 3组术前、术后体重变化比较 (n =10,g,±s)

表1 3组术前、术后体重变化比较 (n =10,g,±s)
注:1)与db/db组比较,P <0.05;2)与db/db-sham组比较,P <0.05
db/db 组 52.6±3.6 53.5±2.6 54.6±1.9 55.5±3.6 57.2±3.4 db/db-sham 组 54.1±3.5 52.7±1.9 53.6±2.9 53.8±3.5 54.9±2.6
表2 3组术前、术后摄食量变化比较 (n =10,g,±s)
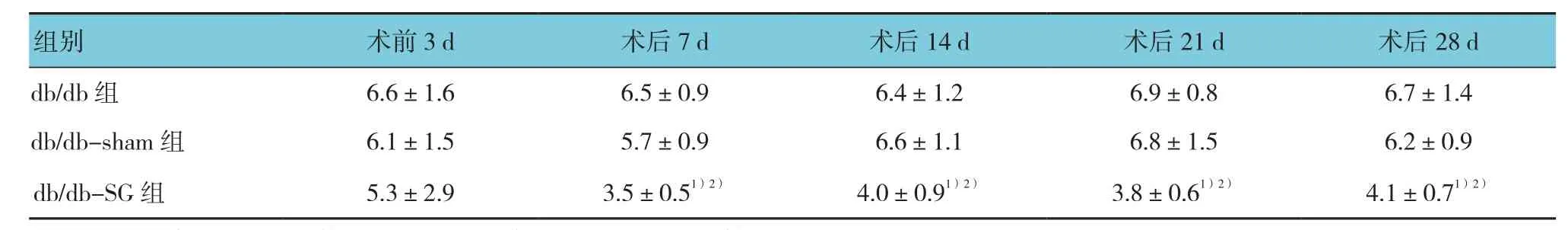
表2 3组术前、术后摄食量变化比较 (n =10,g,±s)
注:1)与db/db组比较,P <0.05;2)与db/db-sham组比较,P <0.05
db/db 组 6.6±1.6 6.5±0.9 6.4±1.2 6.9±0.8 6.7±1.4 db/db-sham 组 6.1±1.5 5.7±0.9 6.6±1.1 6.8±1.5 6.2±0.9
2.4 3组术前、术后血浆TC、TG、LDL比较
术前3组TC、TG、LDL比较,差异无统计学意义(P>0.05);术后30 d,db/db-SG组小鼠血浆TC、TG、LDL与db/db组及db/db-sham组比较,差异有统计学意义(P<0.05),db/db-SG组水平降低,低于db/db组及db/db-sham组。两两比较采用Student'st检验,db/db-SG组TC与db/db组及db/db-sham组比较,均差异有统计学意义(t=-3.562和-4.082,P=0.022和0.015),db/db-SG组TC下降;db/db-SG组TG与db/db组比较,差异无统计学意义(t=-2.659,P=0.056),与db/db-sham组比较,差异有统计学意义(t=-4.227,P=0.013),db/db-SG组 TG下 降;db/db-SG组 LDL与db/db组及db/db sham组比较,均差异有统计学意 义(t=-3.277和 -2.982,P=0.031和 0.041),db/db-SG组LDL下降。见表4。
2.5 脂 肪 组 织caveolin-1、GLUT4蛋 白 及mRNA表达比较
术后30 d,db/db-SG组小鼠内脏(附睾)脂肪组织caveolin-1、GLUT4蛋白及mRNA表达与db/db组、db/db-sham组比较,差异有统计学意义(P<0.05),db/db-SG组表达上调。见附图和表5。
表3 3组术前、术后FBG、OGTT、HOMA-IR比较 (n =10,±s)

表3 3组术前、术后FBG、OGTT、HOMA-IR比较 (n =10,±s)
注:1)与db/db组比较,P <0.05;2)与db/db-sham组比较,P <0.05
db/db 组 26.6±4.6 25.5±3.8 3 197.8±175.6 3 073.9±256.2 5.0±0.2 5.4±0.3 db/db-sham 组 27.2±5.1 28.6±4.9 3 247.0±217.4 3 170.9±288.8 5.4±0.3 5.2±0.3 db/db-SG 组 24.6±4.9 6.4±1.01)2) 3 137.1±223.5 935.5±106.51)2) 5.3±0.7 2.7±0.21)2)F值 0.234 32.976 0.213 89.589 0.629 92.591
表4 3组术前、术后血浆TC、TG、LDL变化 (n =10,mmol/L,±s)
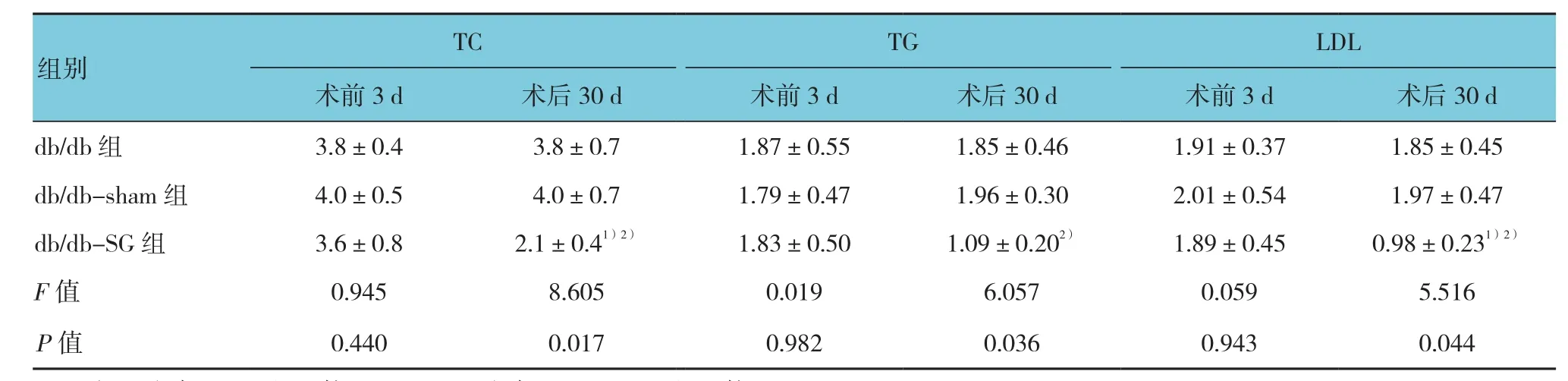
表4 3组术前、术后血浆TC、TG、LDL变化 (n =10,mmol/L,±s)
注:1)与db/db组比较,P <0.05;2)与db/db-sham组比较,P <0.05
db/db 组 3.8±0.4 3.8±0.7 1.87±0.55 1.85±0.46 1.91±0.37 1.85±0.45 db/db-sham 组 4.0±0.5 4.0±0.7 1.79±0.47 1.96±0.30 2.01±0.54 1.97±0.47 db/db-SG组 3.6±0.8 2.1±0.41)2) 1.83±0.50 1.09±0.202) 1.89±0.45 0.98±0.231)2)F值 0.945 8.605 0.019 6.057 0.059 5.516

附图 caveolin-1、GLUT4蛋白表达
表5 术后小鼠脂肪组织caveolin-1、GLUT4 mRNA相对表达量 (n =10,±s)

表5 术后小鼠脂肪组织caveolin-1、GLUT4 mRNA相对表达量 (n =10,±s)
注:1)与db/db组比较,P <0.05;2)与db/db-sham组比较,P <0.05
db/db组 1 1 db/db-sham 组 1.25±0.19 1.19±0.15 db/db-SG 组 3.20±0.31)2) 2.26±0.511)2)F值 194.025 14.695
3 讨论
SG是一种纯粹的限制性减重手术,其不改变胃肠道正常结构,手术切除大弯侧胃体约80%,保留十二指肠起始部、胃幽门、胃小弯和迷走神经的完整性,既达到了胃减容的目的,又能保持相对正常的饮食行为。相比于胃旁路手术等其他吸收不良型减重术式,SG创伤小,围手术期不良事件发生率低,远期并发症少,更加安全、有效。目前,SG多用于对肥胖病人的减重治疗,而对于明确诊断的2型糖尿病病人,胃旁路手术依然是常用术式。但对于一些高龄且合并症多的病人,胃旁路手术风险较高,围手术期病死率高。因此,探讨相对安全的SG对于糖脂代谢异常及IR缓解的机制,具有重要临床意义。
脂肪组织中葡萄糖的跨膜转运是摄取利用的限速步骤,这一过程是由GLUT4介导的[4]。ROS-BARO等[5]认为细胞膜上的caveolae是细胞回摄GLUT4所必须的,且caveolin-1在这一过程中发挥着重要作用。研究表明,caveolin-1失活可能加速GLUT4降解,从而导致胰岛素刺激的葡萄糖转运障碍,是发生IR的原因之一[6]。而且,已有研究发现[7],caveolin-1可以抑制炎症反应,在脂肪细胞,siRNA下调caveolin-1后,促炎症细胞因子、肿瘤坏死因子-α和白细胞介素-6均增加,而抑炎因子白细胞介素-10以及脂联素等的合成和释放则被抑制。caveolin-1对细胞的糖脂转运、内吞、调节炎症因子等生物学过程中均起重要作用。
db/db小鼠是一种自发性肥胖型2型糖尿病模型鼠。本研究对db/db小鼠施行SG后,小鼠短期(30 d)内体重明显下降,摄食量降低,血糖和IR改善,且血清TC、TG、LDL等脂代谢指标亦不同程度好转,提示小鼠术后短期内IR改善,体内糖脂代谢趋于稳定,验证了SG对糖尿病及肥胖的改善作用。脂肪组织是胰岛素作用最主要的靶器官。为了探究SG对脂肪组织IR的影响,本研究检测了术后小鼠附睾脂肪组织,即内脏脂肪组织中caveolin-1、GLUT4蛋白和mRNA表达水平,发现均较未手术和假手术组有不同程度的上升,这可能与手术后体重减轻、IR缓解有关。GLUT4表达的上升提示着葡萄糖转运能力的提高;而caveolin-1的表达上升则可能促进GLUT4的表达和活性增强,并可能抑制脂肪组织炎症通路活性,降低促炎症细胞因子水平,从而使细胞糖脂代谢及内环境趋于稳定。
目前,对于SG改善IR的机制研究有限,但已有资料表明[8-9],SG对于改善糖脂代谢异常是一种安全、有益的方式。本研究进一步证实了在肥胖2型糖尿病小鼠模型中,SG可以在短期内降低体重及摄食量,降低血糖,改善IR,使糖脂代谢状态至接近正常,而术后脂肪组织caveolin-1、GLUT4表达上升可能与这一现象有关,是SG改善脂肪组织IR的原因之一。
[1]RIZZELLO M, ABBATINI F, CASELLA G, et al. Early postoperative insulin-resistance changes after sleeve gastrectomy[J]. Obes Surg, 2010, 20(1): 50-55.
[2]HADY H R, DADAN J, GOŁASZEWSKI P, et al. Impact of laparoscopic sleeve gastrectomy on body mass index, ghrelin,insulin and lipid levels in 100 obese patients[J]. Wideochir Inne Tech Malo Inwazyjne, 2012, 7(4): 251-259.
[3]BERTA A I, KISS A L, LUKÁTS A, et al. Distribution of caveolin isoforms in the lemur retina[J]. J Vet Sci, 2007, 8(3): 295-297.
[4]LAZER M A. How obesity causes diabetes:not a tall tale[J].Science, 2005, 307(5708): 373-375.
[5]ROS-BARO A, LOPEZ-IGLESIAS C, PEIRO S, et al. Lipid rafts are required for GLUT4 internalization in adipose cells[J]. Proc Natl Acad Sci USA, 2001, 98(21): 12050-12055.
[6]GONZÁLEZ-MUÑOZ E, LÓPEZ-IGLESIAS C, CALVO M, et al. Caveolin-1 loss of function accelerates glucose transporter 4 and insulin receptor degradation in 3T3-L1 adipocytes[J].Endocrinology, 2009, 150(8): 3493-3502.
[7]CATALÁN V, GÓMEZ-AMBROSI J, RODRÍGUEZ A, et al.Expression of caveolin-1 in human adipose tissue is upregulated in obesity and obesity-associated type 2 diabetes mellitus and related to in fl ammation. Clin Endocrinol (Oxf), 2008, 68(2): 213-219.
[8]HIMPENS J, DAPRI G, CADIÈRE G B. A prospective randomized study between laparoscopic gastric banding and laparoscopic isolated sleeve gastrectomy:results after 1 and 3 years[J]. Obes Surg, 2006, 16(11): 1450-1456.
[9]ROA P E, KAIDAR-PERSON O, PINTO D, et al. Laparoscopic sleeve gastrectomy as treatment for morbid obesity:technique and short-term outcome[J]. Obes Surg, 2006, 16(10): 1323-1326.
Effect of sleeve gastrectomy on insulin resistance in adipose tissue of obesity-associated type 2 diabetes (+db/+db) mice*
Wen-yan Zhao1, Ming Sun2, Yong Feng1, Dong-hua Geng1, Jin-gang Liu3
(1. Department of General Surgery, 2. Department of Urology, Shengjing Hospital of China Medical University, Shenyang, Liaoning 110004, China; 3. Department of General Surgery, the Fourth Aff i liated Hospital, China Medical University, Shenyang, Liaoning 110032, China)
ObjectiveTo observe the effect of sleeve gastrectomy (SG) on the expression of caveolin-1 in adipose tissue and insulin resistance status.MethodsThirty 10-week old obesity-associated type 2 diabetes(+db/+db) (C57BL/KsJ) mice were randomly allocated to db/db-SG group, db/db-sham group and db/db blank control group, each group had 10 rats. Body weight and food intake were recorded 3 d before operation and 7, 14, 21 and 28 d after operation. On the 5th d before operation and the 30th d after operation, FBG and OGTT were detected before and after operation; ELISA was used to detect the plasma insulin, TG, TC and LDL; RT-PCR and Western blot were used to detect the expressions of caveolin-1 and GLUT4 in the viceral adipose tissue.ResultsCompared with the db/db-sham group and the blank control group, the mice in the SG group showed obviously-reduced body weight and food intake (P< 0.05), apparent downward trends of FBG level, AUC of OGTT, and HOMA-IR (P< 0.05). The plasma TC, TG and LDL levels in the SG group decreased as well (P< 0.05). The expressions of caveolin-1 and GLUT4 protein and mRNA in the viceral adipose tissue signi fi cantly increased in the SG group compared to the db/db-sham group and the blank control group (P< 0.05).ConclusionsSG can signi fi cantly lower the body weight and food intake, decrease the plasma TC, TG and LDL, and alleviate the insulin resistance status in a short period after surgery, which may be related to reduced expression of caveolin-1 and GLUT4 in the adipose tissue.
gastric sleeve surgery; adipose tissue; insulin resisitance; caveolin-1
10.3969/j.issn.1005-8982.2018.01.004
1005-8982(2018)01-0016-05
2017-01-13
沈阳市科学技术计划项目应用基础研究专项(No:150422);辽宁省自然科学基金(No:2015020505)
耿东华,E-mal:gdh024@126.com
R-332
A
(张蕾 编辑)

