持续无创呼吸机辅助通气结合布地奈德和猪肺磷脂注射液治疗支气管肺发育不良低出生体重儿临床观察
陈文霞,张雪,付扬喜,郭焕利,程光清,陈群
(安康市中心医院(北院区)新生儿科,陕西 安康 725000)
持续无创呼吸机辅助通气结合布地奈德和猪肺磷脂注射液治疗支气管肺发育不良低出生体重儿临床观察
陈文霞,张雪,付扬喜,郭焕利,程光清,陈群
(安康市中心医院(北院区)新生儿科,陕西 安康 725000)
目的探究持续无创呼吸机辅助通气结合布地奈德和猪肺磷脂注射液治疗支气管肺发育不良低出生体重儿的临床疗效。方法选取2013年6月至2016年6月期间安康市中心医院(北院区)新生儿科收治的96例合并新生儿呼吸窘迫综合征的低出生体重儿为研究对象,采用随机数表法将患儿分为A、B、C三组各32例。A组患儿给予持续无创呼吸机辅助通气治疗,B组患儿给予持续无创呼吸机辅助通气+猪肺磷脂注射液治疗,C组患儿给予持续无创呼吸机辅助通气+布地奈德+猪肺磷脂注射液治疗。比较三组患儿治疗后不同时间的pH值、二氧化碳分压(PaCO2)值,以及吸氧时间、住院天数和不良反应发生情况。结果A、B、C三组患儿治疗第1天的pH值分别为(7.18±0.08)、(7.08±0.07)和(7.11±0.04),差异均无统计学意义(P>0.05);治疗第2~6天,三组患儿的pH值均先升高后降低,差异均具有统计学意义(P<0.05);A、B、C三组患儿治疗第1天的PaCO2值分别为(30.30±6.69)mmHg、(29.20±4.77)mmHg和(31.70±6.70)mmHg,差异无统计学意义(P>0.05);治疗第2~6天,三组患儿的PaCO2值均显著升高,B组与C组患儿的PaCO2值均高于A组,C组患儿的PaCO2值高于B组,差异均具有统计学意义(P<0.05);A、B、C三组患儿的总住院时间分别为(28.95±10.43)d、(26.43±9.03)d和(27.36±9.16)d,差异无统计学意义(P>0.05);A组患儿的辅助通气时间、高氧持续时间、总吸氧时间分别为(66.29±31.25)h、(4.33±1.72)h、(15.34±9.86)d,均显著高于B组和C组,B组患儿的辅助通气时间、高氧持续时间、总吸氧时间分别为(51.46±18.74)h、(2.96±1.12)h、(11.62±8.87)d,均高于C组患儿的(48.28±15.47)h、(2.22±0.95)h、(9.41±8.17)d,差异均具有统计学意义(P<0.05);三组患儿的各项不良反应发生率比较差异无统计学意义(P>0.05)。结论持续无创呼吸机辅助通气结合布地奈德和猪肺磷脂注射液能够有效治疗低出生体重儿支气管肺发育不良,且安全性较佳。
无创呼吸机;布地奈德;猪肺磷脂注射液;低出生体重儿;支气管肺发育不良
随着新生儿监护技术和围产科学的不断发展,早产儿的存活率逐年升高,因此近年来支气管肺发育不良等早产儿并发症的发病率逐年升高[1]。支气管肺发育不良患儿需要长时间住院护理,且出院后存在呼吸暂停、喂养困难、生长发育缓慢、远期认知功能障碍、猝死、脑瘫等威胁,因此积极预防和治疗早产儿并发支气管肺发育不良具有十分重要的意义[2]。国内外临床上目前并无系统的治疗和预防支气管肺发育不良的方法,目前常用的方法有肺泡表面活性物质替代治疗、氧疗、糖皮质激素、一氧化氮、维生素A、咖啡因、利尿剂、支气管扩张剂和抗生素治疗等[3-4]。而肺泡表面活性物质替代治疗和糖皮质激素治疗是目前临床上公认的主要治疗方法,但糖皮质激素治疗早期患儿不良反应发生率较高[5]。本研究对布地奈德结合猪肺磷脂注射液对低出生体重儿支气管肺发育不良的影响进行了探究,以期为后期临床治疗提供参考,现报道如下:
1 资料与方法
1.1 一般资料 选取2013年6月至2016年6月期间康市中心医院(北院区)新生儿科收治且符合以下纳入和排除标准的96例合并新生儿呼吸窘迫综合征的低出生体重儿为研究对象,采用随机数表法将患儿分为A、B、C三组,各32例。A组32例患儿中男性21例,女性11例;胎龄27~32周,平均(30.21±1.78)周;出生体质量850~1 500 g,平均(1 217.32±113.42)g。B组32例患儿中男性20例,女性12例;胎龄27~32周,平均(29.74±1.63)周;出生体质量 880~1 500 g,平均(1 197.29±110.48)g。C组32例患儿中男性19例,女性13例;胎龄27~32周,平均(29.17±1.52)周;出生体质量870~1 480 g,平均(1 201.55±109.48)g。三组患儿的一般资料比较差异均无统计学意义(P>0.05),具有可比性。本研究已获得我院伦理委员会批准。
1.2 病例选择 (1)纳入标准:①日龄不超过12 h的患儿;②经临床诊断合并新生儿呼吸窘迫综合征的患儿;③体质量不超过2 500 g的患儿;④需要进行气管插管机械通气的患儿;⑤监护人自愿参加本项研究并已经签署知情书。(2)排除标准:①非呼吸窘迫综合征引起的呼吸衰竭患儿;②存在一项或者多项危及生命的先天发育异常的患儿;③颅内出血患儿。
1.3 治疗方法A组患儿给予持续无创呼吸机辅助通气治疗,FiO2≥40%,吸氧时间≥48 h;在A组患儿治疗基础上,B组患儿出生6 h内给予气管插管滴入100 mg/kg的猪肺磷脂注射液(生产厂家:意大利凯西制药公司;生产批号:1024296),每隔12 h重复给药;在B组患儿治疗基础上,C组患儿氧驱雾化吸入布地奈德混悬液(生产厂家:阿斯利康公司;生产批号:H20140475),每日2次,每次用1 mL生理盐水+0.5 mg布地奈德混悬液混合置入一次性雾化器内连接氧气以6~8 L/min流量驱动,持续雾化吸入10 min。
1.4 观察指标 记录并对比三组患儿治疗后不同时间的pH值、二氧化碳分压(PaCO2)值,以及吸氧时间、住院天数和不良反应发生情况。
1.5 统计学方法应用SPSS19.0统计软件包进行数据分析,计数资料以频数表示,采用χ2检验,计量资料以均数±标准差(x-±s)表示,多组计量资料比较采用方差分析,两两比较采用t检验,以P<0.05为差异具有统计学意义。
2 结 果
2.1 三组患儿治疗后不同时间的pH值比较 治疗第1天三组患儿的pH值比较差异无统计学意义(F=1.687,P>0.05)。治疗第2~6天,三组患儿的pH值均先升高后降低,第4天达到顶峰,B组与C组患儿的pH值均高于A组患儿,C组患儿的pH值高于B组患儿,差异均具有统计学意义(P<0.05),见表1。
表1 三组患儿治疗后不同时间的pH值比较

表1 三组患儿治疗后不同时间的pH值比较
注:与A组比较,aP<0.05;与B组比较,bP<0.05。
组别A组B组C组F值P值例数32 32 32第1天7.18±0.08 7.08±0.07 7.11±0.04 1.687 0.089第2天7.24±0.09 7.27±0.05a 7.31±0.03ab 2.492 0.024第3天7.27±0.08 7.28±0.05a 7.34±0.02ab 2.573 0.011第4天7.28±0.04 7.30±0.06a 7.38±0.03ab 2.396 0.031第5天7.18±0.04 7.25±0.05a 7.36±0.02ab 1.975 0.049第6天7.08±0.05 7.22±0.06a 7.32±0.04ab 2.559 0.014
2.2 三组患儿治疗后不同时间的PaCO2值比较 治疗第1天三组患儿的PaCO2值比较差异无统计学意义(F=1.676,P>0.05)。治疗第2~6天,三组患儿的PaCO2值均显著升高,B组与C组患儿的PaCO2值均高于A组患儿,C组患儿的PaCO2值高于B组患儿,差异均具有统计学意义(P<0.05),见表2。
2.3 三组患儿的吸氧时间和住院天数比较 三组患儿的总住院时间比较差异无统计学意义(F=1.767,P>0.05)。A组患儿的辅助通气时间、高氧持续时间、总吸氧时间均明显高于B组和C组患儿,B组患儿的辅助通气时间、高氧持续时间、总吸氧时间均高于C组,差异具有统计学意义(P<0.05),见表3。
2.4 三组患儿的不良反应比较 三组患儿的各项不良反应发生率比较差异均无统计学意义(P>0.05),见表4。
表2 三组患儿治疗后不同时间的PaCO2值比较[mmHg,

表2 三组患儿治疗后不同时间的PaCO2值比较[mmHg,
注:与A组比较,aP<0.05;与B组比较,bP<0.05;1 mmHg=0.133 kPa。
组别A组B组C组F值P值例数32 32 32第1天30.30±6.69 29.20±4.77 31.70±6.70 1.676 0.092第2天30.87±6.08 34.67±3.97a 38.53±4.80ab 2.481 0.026第3天32.50±5.28 35.10±4.36a 40.37±3.53ab 2.279 0.037第4天34.03±5.22 36.07±3.93a 40.70±3.40ab 2.580 0.010第5天35.47±5.38 37.57±4.11a 41.00±3.02ab 1.983 0.048第6天37.10±5.38 40.17±5.19a 41.67±3.69ab 2.147 0.040
表3 三组患儿的吸氧时间和住院天数比较

表3 三组患儿的吸氧时间和住院天数比较
注:与A组比较,aP<0.05;与B组比较,bP<0.05。
组别A组B组C组F值P值例数32 32 32辅助通气时间(h)66.29±31.25 51.46±18.74a 48.28±15.47ab 2.549 0.016高氧持续时间(d)4.33±1.72 2.96±1.12a 2.22±0.95ab 2.412 0.030总吸氧时间(d)15.34±9.86 11.62±8.87a 9.41±8.17ab 2.279 0.037总住院天数(d)28.95±10.43 26.43±9.03 27.36±9.16 1.767 0.080
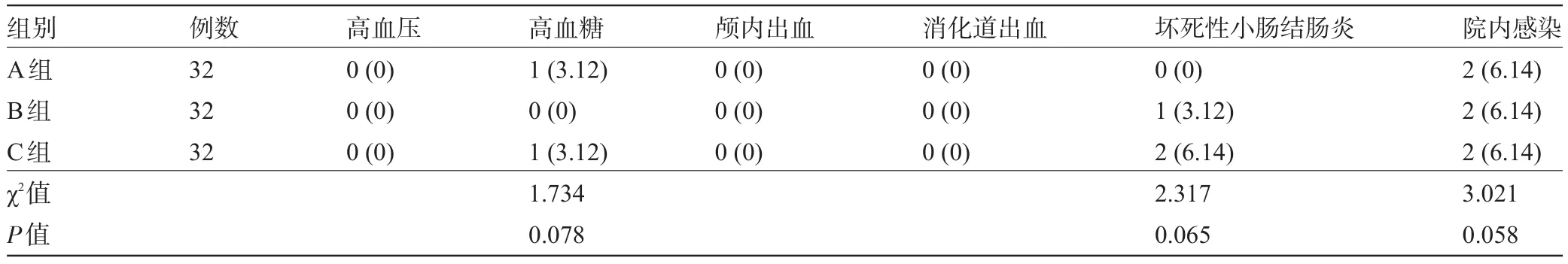
表4 三组患儿的不良反应比较[例(%)]
3 讨 论
支气管肺发育不良包括气管软化、先天性支气管闭锁、气管支气管巨大症等疾病,患儿多表现出不同程度的阻塞和狭窄,存在呼吸窘迫综合征、缺氧、出汗、面色苍白、呕吐、嗜睡、气促、干咳、呼吸困难、发绀等症状,轻度患儿肋间隙凹陷,肺部有湿啰音和哮鸣音,呼吸暂停发作,需吸氧和辅助通气,病程可持续数月,严重者出现心力衰竭和呼吸衰竭,对早产儿的生命质量产生严重影响[6-7]。支气管肺发育不良的发病机制较复杂,急性肺损伤、肺发育不成熟和损伤后异常修复是支气管肺发育不良的三个重要因素。多数早产儿需要高氧辅助呼吸,但是由于高氧辅助呼吸会在体内产生大量的活性氧,而早产儿的抗氧化活性能力较低,不能将肺内产生的活性氧及时清除,会导致氧化应激反应,引起肺损伤,进而导致支气管肺发育不良[8-9]。本研究对布地奈德结合猪肺磷脂注射液对低出生体重儿支气管肺发育不良的影响进行了探究,以期能为后期临床治疗提供参考。
已有研究指出,低出生体重儿体内缺乏肺泡表面活性物质,通气血流比例严重失调,短时间内滴入肺泡表面活性物质虽然能够降低肺泡表面张力,但是不能对肺功能进行持续的改善[10]。支气管肺发育不良发生的关键环节为炎性损伤,糖皮质素能够有效抑制炎性反应,缓解肺水肿和支气管,促进肺泡表面活性物质和肺抗氧化酶的合成,进而改善患儿肺功能,缩短呼吸机辅助治疗的时间,降低支气管肺发育不良的发生率[11]。布地奈德是一种具有高效局部抗炎功能的糖皮质激素,能够增强平滑肌细胞、内皮细胞和溶酶体膜的稳定性,对抗体的合成和免疫反应产生抑制,降低组胺等过敏活性介质的释放,降低其活性,并抑制抗原与抗体结合时对酶产生的促进作用,抑制支气管收缩物质的合成和释放,减轻平滑肌的收缩反应[12]。但是由于低出生体重儿的肺组织处于萎陷状态,肺内含血量较高,含气量较低,单纯使用糖皮质激素无法到达肺泡和肺组织毛细血管末端内,无法阻止肺内炎性反应的发生,预防支气管肺发育不良。肺表面活性物质指分布在肺泡液体分子层表面的由肺泡Ⅱ型上皮细胞分泌的一种复杂的脂蛋白,主要成分是二棕榈酰卵磷脂和表面活性物质结合蛋白,能够降低肥胖表面张力,维持大小肺泡容量的相对稳定性,阻止肺泡毛细血管内的液体向肺泡内滤除[13]。本研究显示,治疗第2~6天三组患儿的pH值均先升高后降低,第4天达到顶峰,B组与C组患儿的pH值均高于A组患儿,C组患儿的pH值高于B组患儿,差异有统计学意义(P<0.05)。治疗第2~6天三组患儿的PaCO2值均显著升高,B组与C组患儿的PaCO2值均高于A组患儿,C组患儿的PaCO2值高于B组患儿,差异有统计学意义(P<0.05)。这说明布地奈德结合猪肺磷脂注射液治疗能够较快的纠正血pH值、PaCO2值,缩短呼吸机辅助通气时间。同时三组患儿各项不良反应发生率差异无统计学意义(P>0.05)。说明联合使用布地奈德和猪肺磷脂注射液治疗并无显著不良反应,安全性较佳。
综上所述,布地奈德结合猪肺磷脂注射液能够有效预防低出生体重儿支气管肺发育不良,且安全性较佳。
[1]del Cerro MJ,Sabaté Rotés A,Cartón A,et al.Pulmonary hypertension in bronchopulmonary dysplasia:Clinical findings,cardiovascular anomalies and outcomes[J].Pediatr Pulmonol,2014,49(1):49-59.
[2]Laux D,Malan V,Bajolle F,et al.FOX gene cluster defects in alveolar capillary dysplasia associated with congenital heart disease[J].Cardiol Young,2013,23(5):697-704.
[3]胡剑,俞敏,唐云,等.小剂量糖皮质激素预防早产儿支气管肺发育不良效果观察[J].山东医药,2014,54(48):48-49.
[4]Baker CD,Seedorf GJ,Wisniewski BL,et al.Endothelial colony-forming cell conditioned media promote angiogenesis in vitro and prevent pulmonary hypertension in experimental bronchopulmonary dysplasia[J].Am J Physiol Lung Cell Mol Physiol,2013,305(1):L73-L81.
[5]薛辛东,杨海萍.早产儿支气管肺发育不良防治及管理的新认识[J].中华妇幼临床医学杂志(电子版),2014,10(1):5-8.
[6]Hatanaka K,Yoshioka T,Tasaki T,et al.Pulmonary rhabdomyomatous dysplasia of the newborn in neurofibromatosis type 1[J].Pathol Res Pract,2014,210(5):318-320.
[7]苏衡.布地奈德混悬液氧驱雾化吸入防治早产儿支气管肺发育不良的临床效果[J].国际医药卫生导报,2016,22(14):2128-2130.
[8]曹冰冰,黄为民.糖皮质激素防治新生儿支气管肺发育不良利弊研究进展[J].中国妇幼保健,2016,31(7):1557-1560.
[9]Zhu Y,Fu J,You K,et al.Changes in pulmonary tissue structure and KL-6/MUC1 expression in a newborn rat model of hyperoxia-Induced bronchopulmonary dysplasia[J].Exp Lung Res,2013,39(10):417-426.
[10]彭磊,乐功芳,陈绪萍,等.早产儿支气管肺发育不良的高危因素及防治对策[J].临床肺科杂志,2015,20(1):92-95.
[11]陈荟竹,宁刚.外源性肺泡表面活性物质治疗新生儿呼吸窘迫综合征后胸部X线表现[J].放射学实践,2014,29(12):1415-1419.
[12]文茂,王瑞泉,陈冬梅,等.布地奈德混悬液预防早产儿支气管肺发育不良的临床观察[J].世界最新医学信息文摘(连续型电子期刊),2016,16(12):85-85,90.
[13]徐发林,张彦华,段佳佳,等.不同分度早产儿支气管肺发育不良临床高危因素[J].中华实用儿科临床杂志,2013,28(14):1073-1076.
Clinical observation of continuous non-invasive ventilation combined with budesonide and poractant alfa injection in the treatment of low birth weight infants with bronchopulmonary dysplasia.
CHEN Wen-Xia,ZHANG Xue,FU Yang-xi,GUO Huan-li,CHENG Guang-qing,CHEN Qun.Department of Neonatology,the Central Hospital(North District)of Ankang City,Ankang 725000,Shaanxi,CHINA
ObjectiveTo explore the clinical efficacy of continuous non-invasive ventilation combined with budesonide and poractant alfa injection in the treatment of bronchopulmonary dysplasia in low birth weight infants.MethodsA total of 96 low birth weight infants with neonatal respiratory distress syndrome,who admitted to Department of Neonatology of the Central Hospital(North District)of Ankang City from June 2013 to June 2016,were selected and divided into A,B,C three groups according to random number table method,with 32 cases in each group.The A group哇was given continuous non-invasive ventilation treatment,the B group was given continuous non-invasive ventilation and poractant alfa injection,and the C group was given continuous non-invasive ventilation plus budesonide and poractant alfa injection.The pH value,partial pressure of carbon dioxide(PaCO2),oxygen uptake time,hospitalization days and adverse reactions were compared between the three groups at different times after the treatment.ResultsThe pH values in the A,B and C group were respectively(7.18±0.08),(7.08±0.07)and(7.11±0.04)at the first day of treatment(P>0.05),and the values significantly increased and then decreased during day 2 to day 6 of treatment(P<0.05).The values of PaCO2in A,B and C group were respectively(30.30±6.69)mmHg,(29.20±4.77)mmHg and(31.70±6.70)mmHg at the first day of treatment(P>0.05),and the values in the three groups were significantly increased during day 2 to day 6 of treatment,which were significantly higher in B,C group than in A group and in C group that in B group(P<0.05).The hospitalization time of A,B and C group were respectively(28.95±10.43)d,(26.43±9.03)d and(27.36±9.16)d(P>0.05).The auxiliary ventilation time,high oxygen duration,total oxygen uptake time in A group were(66.39±31.25)h,(4.33±1.72)h,(15.34±9.86)d,respectively,which were significantly longer than corresponding(51.42±18.74)h,(2.96±1.12)h,(11.62±8.87)d in B group and(48.28±15.47)h,(2.22±0.95)h(9.41±8.17)d in C group(P<0.05).There was no significant difference in the incidence of adverse reactions between the three groups(P>0.05).ConclusionContinuous non-invasive ventilation combined with budesonide and poractant alfa injection can effectively treat low birth weight children with bronchopulmonary dysplasia,with better safety.
陈文霞。E-mail:chenwenxia1234567@126.com
Non-invasive ventilator;Budesonide;Poractant alfa injection;Low birth weight;Bronchopulmonary dysplasia
R722.1
A
1003—6350(2017)23—3851—04
10.3969/j.issn.1003-6350.2017.23.021
2017-06-08)

