S100A4蛋白及ZEB1蛋白表达水平与胃癌侵袭转移及预后的关系
胡阳,刘博,欧阳文,麻继臣,宋新梅,董魁星
(1.中国人民解放军白求恩国际和平医院干部病房一区,河北 石家庄 050000;2.保定市第二医院肿瘤内科,河北 保定 071051)
S100A4蛋白及ZEB1蛋白表达水平与胃癌侵袭转移及预后的关系
胡阳1,刘博2,欧阳文1,麻继臣1,宋新梅2,董魁星1
(1.中国人民解放军白求恩国际和平医院干部病房一区,河北 石家庄 050000;2.保定市第二医院肿瘤内科,河北 保定 071051)
目的探讨S100A4蛋白及ZEB1蛋白表达水平与胃癌侵袭转移及预后的关系。方法选取中国人民解放军白求恩国际和平医院2013年5月至2015年5月接诊的胃癌患者68例,采用HE染色技术对采集的胃组织标本进行病理学确诊;采用免疫组织染色法检测胃癌组织、癌旁正常组织及腺瘤样异型增生、慢性胃炎、胃黏膜肠上皮化生组织标本中S100A4的及ZEB1蛋白表达水平,分析两种蛋白的表达与胃癌侵袭转移及预后的关系。结果S100A4的表达水平分析显示,胃癌(55.9%)>腺瘤样异型增生(36.4%)>肠上皮化生(20.0%)>慢性胃炎(15.4%)>癌旁正常组织(7.4%)。ZEB1的表达水平分析显示,胃癌(82.4%)>腺瘤样异型增生(45.5%)>慢性胃炎(30.8%)>肠上皮化生(26.7%)>癌旁正常组织(23.5%);组间比较差异均具有统计学意义(P<0.05)。患者的年龄和性别与S100A4表达无明显相关,S100A4在胃癌组织中的表达水平与侵袭深度、淋巴结转移、肿瘤大小、肿瘤TNM分期呈正相关,差异具有统计学意义(P<0.05)。胃癌组织分化程度、肿瘤大小、年龄、性别与胃癌组织中ZEB1的表达均无明显相关(P>0.05)。胃癌侵袭较深、存在淋巴结转移、肿瘤TNM分期Ⅲ~Ⅳ时,胃癌组织中的ZEB1表达阳性率较高(P<0.05)。结论S100A4及ZEB1过度表达,肿瘤浸润深度,淋巴结转移,静脉浸润,淋巴管浸润和TNM分期可作为胃癌患者不良预后的独立预测指标。
S100A4蛋白;ZEB1蛋白;胃癌;侵袭;转移;预后
胃癌是临床常见的消化道恶性肿瘤之一,死亡率极高,仅次于肺癌[1]。胃癌发病后病情进展较快,且容易发生侵袭转移造成患者术后病情复发,大多数的胃癌患者预后较差[2]。研究表明,恶性肿瘤的侵袭和转移涉及体内多种信号传导通路以及多个基因表达与分子调控的复杂过程[3]。相关研究表明,S100A4蛋白通过调控细胞间黏附、细胞周期进程和相关的肿瘤转录因子表达进而影响到肿瘤的侵袭转移和预后[4-5]。ZEB1是一种E盒结合锌指蛋白,能够促进上皮-间质转化(epithelial-meseiichymal transition,EMT)并且诱导基质金属蛋白酶的表达,对肿瘤细胞侵袭和转移具有明显的促进作用,在多种恶性肿瘤组织中均有表达[6]。本文旨在探讨S100A4和ZEB1的表达与胃癌细胞侵袭和转移以及患者预后之间的关系。
1 资料与方法
1.1 一般资料 选取2013年5月至2015年5月中国人民解放军白求恩国际和平医院收治的68例胃癌患者的175例胃组织标本为研究对象,其中胃手术切除组织标本:胃癌组织标本(68例),癌旁正常组织标本(68例);内镜活检组织标本:腺瘤样异型增生(11例),慢性胃炎(13例),胃黏膜肠上皮化生(15例)。经确认所有患者术前均未进行放疗或化疗。根据国际抗癌联盟(Union Internationale Contre le Cancer,UICC)标准对胃癌标本进行TNM分期,应用HE染色、EVG染色和D2-40免疫染色对胃癌细胞侵袭静脉及淋巴管情况进行评定。患者出院后进行为期6个月的电话跟踪随访,并统计患者门诊复查结果进行预后分析。研究取得患者同意,签订知情同意书,经医院伦理委员会通过。
1.2方法免疫组化检测:采用EnVision方法对胃癌及其癌前病变组织进行免疫组化染色。兔抗人S100A4多克隆抗体(海阳光试剂有限公司)。小鼠抗人ZEB1单克隆抗体(上海艾跃生物科技有限公司—Active motif中国),DAB显色试剂盒、SP试剂盒(上海酶联生物科技有限公司)。所有检测试验操作均严格按照试剂盒的说明书进行。阴性对照[磷酸盐缓冲液(PBS)代替一抗,pH7.4,0.01 mol/L]。对患者病理组织切片进行免疫组化染色,依据结果判定患者的S100A4及ZEB1表达情况:邀请两名临床经验丰富的病理科医师作为评定专家(评定专家未接触患者的临床资料),遵循随机原则,将免疫组化切片随机分配,显微镜下放大200倍观察S100A4阳性细胞数和ZEB1阳性细胞数,并进行组间比较。检测阳性判断标准:细胞质内可见黄色颗粒分布则判定为阳性;检测标准:组织细胞染色,为 0~5%,记为(-);染色细胞数6%~25%为弱阳性,记为(+);染色细胞数25%~50%为中阳性记(++),超过一半的细胞染色为强阳性,记为(+++)。
1.3 统计学方法所有数据采用SPSS20.0统计软件进行分析,计数资料以例(%)表示,统计分析采用χ2检验;计量资料的统计描述用均数±标准差(x-±s)表示,两组间比较采用独立样本t检验,多组间比较行方差分析(F检验),组内比较采用配对资料t检验。多因素分析采用Logistics回归分析,以P<0.05为差异有统计学意义。
2 结果
2.1 免疫组化分析S100A4及ZEB1的表达 免疫组化染色结果表明,S100A4及ZEB1蛋白阳性表达主要定位于细胞核中,呈棕黄色颗粒。S100A4及ZEB1蛋白的表达按以下顺序逐渐减少:胃癌>腺瘤样异型增生>肠上皮化生>慢性胃炎>癌旁正常组织,组间比较差异具有统计学意义(P<0.05),见表1。

表1 S100A4及ZEB1的表达情况[例(%)]
2.2 S100A4及ZEB1表达与临床病理学特点的关系 患者的年龄和性别与S100A4表达无明显相关性(P>0.05),S100A4在胃癌组织中的表达水平与侵袭深度、淋巴结转移、肿瘤大小、肿瘤TNM分期呈正相关,差异具有统计学意义(P<0.05)。S100A4基因表达在肠型(IT)胃癌高于弥漫型(DT)癌,差异具有统计学意义(P<0.001),见表2。性别、肿瘤直径和胃癌组织分化均与胃癌组织中ZEB1的表达无关(P>0.05),而浸润深度、淋巴结转移、远处转移及肿瘤TNM分期与胃癌组织中ZEB1的表达相关,差异具有统计学意义(P<0.05)。当胃癌浸润深度较深、伴有淋巴结转移、伴有远处转移、TNM分期Ⅲ~Ⅳ时,胃癌组织中的ZEB1表达阳性率较高(P<0.05),分别为92.9%、90.6%、91.7%、90.9%。提示ZEB1的表达可能与胃癌的转移、侵袭及进展有关,见表3。

表2 胃癌组织中S100A4与临床病理学特点的关系(例)

表3 ZEB1表达与临床病理学特点的关系(例)
2.3 多因素分析S100A4及ZEB1表达与胃癌患者生存的关系 对68例胃癌患者进行为期6个月的随访。多因素分析采用Cox比例模型来确定各种临床病理参数的独立预后作用。研究结果表明,浸润深度,淋巴管及静脉浸润,淋巴结转移,TNM分期与S100A4及ZEB1表达均是胃癌的预后不良的独立因素(P<0.05),见表4。
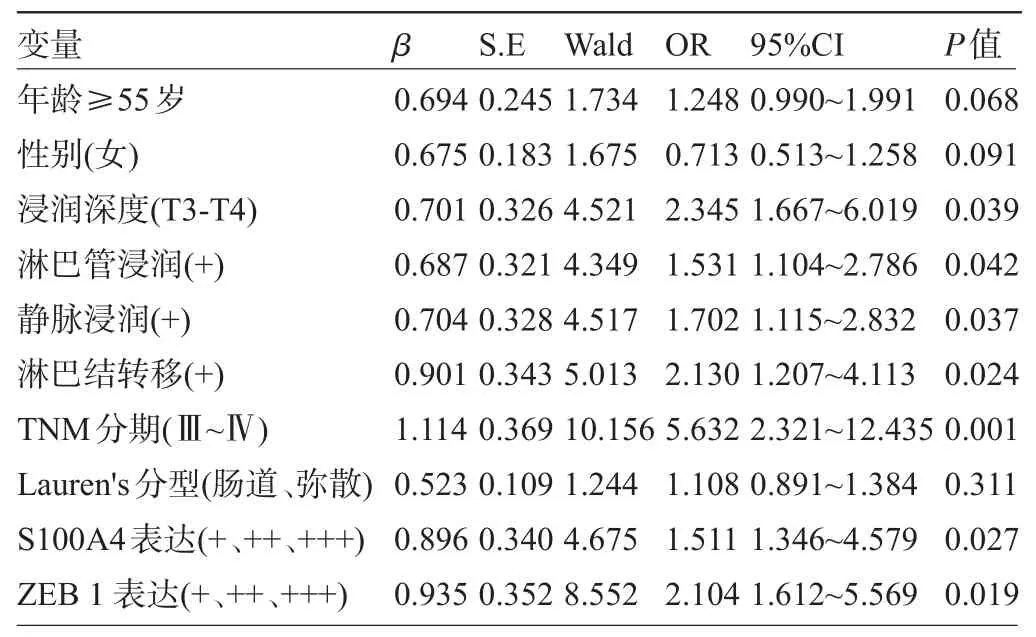
表4 S100A4及ZEB1表达与胃癌患者生存的关系
3 讨 论
上皮-间质转化(EMT)对于多细胞生物发育过程具有重要意义,是指上皮细胞到间质细胞转化这一基础过程,它赋予细胞转移和入侵的能力,能够减少凋亡与衰老,促进免疫抑制。但EMT同样参与机体气管纤维化、组织愈合、慢性炎症以及癌症等过程。在乳腺癌、肝癌、卵巢癌、胃癌以及鼻咽癌等上皮来源的恶性肿瘤组织中,EMT诱导基因调控,上皮细胞失去细胞极性和细胞连接,组织松散,运动能力增强,因而容易从肿瘤的原发病灶迁移到邻近的组织器官中,具备了肿瘤细胞浸润和远处转移的条件[8]。目前,研究已证实,EMT为恶性肿瘤细胞侵袭转移的重要生理基础[9]。
S100属于转移相关性基因,S100A4基因调控AKT/Slug通路并且抑制E-cadherin蛋白表达,调控细胞间黏附、细胞周期进程和相关的肿瘤转录因子表达进而影响到食管癌患者肿瘤的侵袭转移和预后[10]。近年来,Chen等[11]学者陆续发现S100A4过度表达,对p53相关基因进行调控,然后与突变型p53蛋白鳌合,抑制p53蛋白对肿瘤细胞凋亡作用,而抑制S100A4基因在体内进行表达时,能够明显抑制BGC823癌变细胞的增殖,促进癌变细胞的凋亡。ZEB1是一种E盒结合锌指蛋白,能够促进上皮-间质转化(epithelial-meseiichymal transition,EMT)并且诱导基质金属蛋白酶的表达,对肿瘤细胞侵袭和转移具有明显的促进作用,在多种恶性肿瘤组织中均有表达。临床研究表明,ZEB1能够在mRNA水平抑制卵巢癌、口腔鳞状细胞癌、胰腺癌等多种恶心肿瘤细胞E-cadherin蛋白表达,同时促进EMT进程,导致癌变细胞迁移和扩散[12]。ZEB1在肺癌组织中高度表达与肺癌患者淋巴结浸润、淋巴结转移以及患者的预后不良密切相关。
本研究中,研究结果显示S100A4基因在胃癌组织中的表达与患者预后呈负相关,这与以前的报道相一致。Cox比例风险回归模型分析结果表明,胃癌组织中的S100A4表达、静脉侵袭或淋巴管侵袭、淋巴管转移、浸润深度以及TNM分期均为胃癌患者预后不良的独立因素。国外学者对C期结肠癌患者病理切片进行免疫组化染色检测发现,细胞核未发现S100A4的染色,仅细胞质出现染色,且S100A4的过度表达与患者的预后状况呈负相关[13]。Kang等[14]发现S100A4过度表达是大肠癌患者不良预后的独立预测指标。近年来,国内外研究均发现类似的结果在膀胱癌、胰腺癌、咽喉癌患者中均存在[15]。S100A4基因上调肿瘤生长因子-β通路,同时促进基质金属蛋白酶(MMP)的表达,促使细胞外基质降解,抑制E-钙结合蛋白表达,使癌变细胞黏附较小,丧失细胞极性,发生邻近组织侵袭和远处转移。上述这些研究发现均表明,S100A4基因表达是胃癌患者的不良预后的独立预测指标。
本文通过免疫组化染色检测并分析比较胃癌组织与癌旁正常组织中ZEB1的表达差异,结果显示胃癌组织中ZEB1在的阳性表达率明显高于癌旁正常胃黏膜组织中的ZEB1表达阳性率,提示ZEB1为癌变相关基因,当其在胃癌组织中过度表达时,对肿瘤细胞侵袭和转移具有明显的促进作用,诱导病情进一步恶化,导致患者预后不良。通过将ZEB1表达情况结合胃癌临床病理特征进行Logistic二元线性回归分析,结果显示ZEB1阳性表达率与胃癌患者的胃癌的组织分化程度、肿瘤大小、年龄、性别均无关,而胃癌侵袭较深、存在淋巴结转移、肿瘤TNM分期较晚时,胃癌组织中的ZEB1表达阳性率较高(P<0.05)。明显高于浸润较前、无淋巴结转移及TNM分期较早的患者,提示胃癌组织浸润深度、淋巴结转移、远处转移及肿瘤TNM分期与胃癌组织中ZEB1的表达密切相关。ZEB1在胃癌组织中过度表达促进上皮-间质转化,调控E-cadherin蛋白表达下降,导致细胞极性缺失获得迁移能力,促进肿瘤侵袭和转移参了对肿瘤细胞调亡、细胞周期及复制衰老等方面的调控,参与病情的进展。
S100A4及ZEB1在胃癌组织中过表达与胃癌侵袭、淋巴结转移、肿瘤大小和患者的不良预后密切相关,检测胃癌组织中S100A4及ZEB1表达情况有助于对胃癌恶性程度的临床判断并为治疗提供依据。
[1]Ferlay J,Shin HR,Bray F,et al.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008-Ferlay-2010-International Journal of Cancer-Wiley Online Library[J].Int J Cancer,2010,127(12):2893-2917.
[2]张天彪,宿文辉,赵滢,等.S100钙结合蛋白A4在胃癌组织中的表达及意义[J].中国癌症杂志,2015.25(6):424-432.
[3]Kim MJ,Hong JH,Park ES,et al.Gastric metastasis from primary lung adenocarcinoma mimicking primary gastric cancer[J].World J Gastrointest Oncol,2015,7(3):12-16.
[4]Kang HJ,Yoon JW,Park JH,et al.Cancer pain control for advanced cancer patients by using autonomic nerve pharmacopuncture[J].J Pharmacopuncture,2014,17(3):62-69.
[5]魏疆,禄邵英.胃癌患者中Z EB1蛋白的检测及其表达意义[J].陕西医学杂志,2015,44(1):104-106.
[6]Gregory PA,Bracken CP,Smith E,et al.An autocrine TGF-beta/ZEB/miR-200 signaling network regulates establishment and maintenance of epithelial-mesenchymal transition[J].Mol Biol Cell,2011,22(10):1686-1698.
[7]苏林,辛彦.E-cadherin和FSP-1/S100A4在胃癌及其癌前病变中的表达与临床病理意义[J].现代肿瘤医学,2014,22(12):2903-2908.
[8]Wang D,Zhang J,Liu Z,et al.Functional expression,characterization and application of the human S100A4 protein[J].Mol Med Rep,2015,11(1):175-181.
[9]赵滢,宿文辉,张天彪,等.S100钙结合蛋白A2在胃癌组织中的表达及意义[J].现代肿瘤医学,2015,23(19):2804-2809.
[10]Chen D,Zheng XF,Yang ZY,et al.S100A4 silencing blocks invasive ability of esophageal squamous cell carcinoma cells[J].World J Gastroenterol,2012,18(9):915-922.
[11]Chen D,Zhang R,Shen W,et al.RPS12-specific shRNA inhibits the proliferation,migration of BGC823 gastric cancer cells with S100A4 as a downstream effector[J].Int J Oncol,2013,42(5):1763-1769.
[12]周蕾,胡永莲,武世伍,等.Slug、ZEB1和KISS-1在胃腺癌中的表达及其临床意义[J].南方医科大学学报,2016,36(4):532-537.
[13]徐飞鹏,许庆文,王妃凤.肽基脯氨酰顺反异构酶和钙结合蛋白S100A9在胃癌组织中的表达及意义[J].中华实验外科杂志,2013,30(2):225-226.
[14]Kang YG,Jung CK,Lee A,et al.Prognostic significance of S100A4 mRNA and protein expression in colorectal cancer[J].J Surg Oncol,2012,105(2):119-124.
[15]Chen N,Sato D,Saiki Y,et al.S100A4 is frequently overexpressed in lung cancer cells and promotes cell growth and cell motility[J].Biochem Biophys Res Commun,2014,447(3):459-464.
Relationship between the expression of S100A4 protein,ZEB1 protein and invasion,metastasis,prognosis of gastric cancer.
HU Yang1,LIU Bo2,OUYANG Wen1,MA Ji-chen1,SONG Xin-mei2,DONG Kui-xing1.1.Cadre Ward, Bethune International Peace Hospital of the People's Liberation Army,Shijiazhuang 050000,Hebei,CHINA;2.Department of Internal Medicine-Oncology,the Second Hospital of Baoding,Baoding 071051,Hebei,CHINA
ObjectiveTo explore relationship between the expression of S100A4 protein,ZEB1 protein and invasion,metastasis,prognosis of gastric cancer.MethodsA total of 68 patients with gastric cancer were selected in Bethune International Peace Hospital of the People's Liberation Army from May 2013 to May 2015.HE staining technique was used to diagnose the gastric tissue samples.Immunohistochemical staining was used to detect the expression level of S100A4 protein,ZEB1 protein in gastric cancer tissues,normal tissues and adenomatous dysplasia,chronic gastritis,intestinal metaplasia of gastric mucosa.Relationships between the expression of S100A4 protein,ZEB1 protein and invasion,metastasis,prognosis of gastric cancer were analyzed.ResultsThe expression levels of S100A4 were decreased successively in gastric cancer(55.9%),adenomatous dysplasia(36.4%),intestinal metaplasia(20.0%),chronic gastritis(15.4%),and adjacent normal tissue(7.4%).The levels of ZEB1 from high to low were in gastric cancer(82.4%),adenomatous dysplasia(45.5%),chronic gastritis(30.8%),intestinal metaplasia(26.7%),and adjacent normal tissue(23.5%).The differences between groups were statistically significant(P<0.05).There was no significant correlation between expression of S100A4 in gastric cancer and age,sex(P>0.05),while S100A4 levels in gastric cancer were correlated withdepth of tumor invasion,lymph node metastasis,tumor size,tumor TNM staging(P>0.05).There was no significant correlation between expression of ZEB1 in gastric cancer and tumor differentiation degree,tumor size,age and sex(P>0.05).The positive expression rates of ZEB1 in gastric cancer were higher in patients with deeper gastric cancer invasion,lymph node metastasis,tumor TNM stage ofⅢ~Ⅳ (P<0.05).ConclusionOverexpression of S100A4 and ZEB1,depth of tumor invasion,lymph node metastasis,venous invasion,lymphatic invasion and TNM staging can be the independent predictors of adverse outcomes in patients with gastric cancer.
胡阳。E-mail:dvdrc58@163.com
S100A4 protein;ZEB1 protein;Gastric cancer;Invasion;Metastasis;Prognosis
R735.2
A
1003—6350(2017)23—3832—04
10.3969/j.issn.1003-6350.2017.23.016
2016-07-25)

