SNAI2在结直肠癌中的表达及其对细胞增殖和侵袭能力的影响
邹永平,李龙鹤
(海南省人民医院急诊外科,海南 海口 570311)
SNAI2在结直肠癌中的表达及其对细胞增殖和侵袭能力的影响
邹永平,李龙鹤
(海南省人民医院急诊外科,海南 海口 570311)
目的明确锌指转录因子2(SNAI2)在结直肠癌组织中的表达及对结直肠癌细胞增殖和侵袭能力的影响。方法收集海南省人民医院胃肠外科2015年9月至2016年4月间收治的50例临床结直肠癌组织样本及癌旁组织,使用反转录-聚合酶链反应(RT-PCR)技术检测其中SNAI2的表达水平,t检验比较两组SNAI2水平的差异。针对SNAI2基因,设计四组干扰RNA序列和一组无任何靶向位点的随机插入序列。将各组序列剪切到慢病毒载体上,用二代包装系统包装成慢病毒悬液。将HT29接种至6孔板,分别标记为对照组、shSNAI2 1#组、shSNAI2 2#组、shSNAI2 3#组、shSNAI2 4#组。对照组注入插入随机序列载体的慢病毒悬液,shSNAI2 1#组、shSNAI2 2#组、shSNAI2 3#组、shSNAI2 4#组分别注入插入四组干扰RNA序列的慢病毒悬液。挑选SNAI2表达最高的SW480细胞系进行慢病毒感染,获得稳定knock-down SNAI2细胞系。在高表达SNAI2的SW480细胞系中,采用慢病毒感染的方法构建稳定干扰SNAI2细胞株。通过噻唑蓝(MTS)比色法检测细胞增殖能力,划痕实验检测细胞侵袭迁移能力。同时Western blot检测E-钙黏蛋白(E-cadherin)、波形蛋白(Vimentin)的表达。结果癌旁组织SNAI2的表达量低于结直肠癌组织,差异有统计学意义(P<0.05);与对照组比较,细胞黏附分子E-cadherin表达量升高,细胞骨架蛋白、Vimentin表达量降低,差异均有统计学意义(P<0.05);siSNAI2的SW480细胞系中,与对照组比较,细胞增殖能力、侵袭能力显著降低,差异有统计学意义(P<0.05)。结论SNAI2在人结直肠癌中表达量升高,作为一种癌基因,其可促进结直肠癌细胞的体外增殖、侵袭和体内转移能力。
SNAI2;结直肠癌;细胞增殖;细胞侵袭
结直肠癌(carcinoma of colon and rectum)是全世界常见的恶性肿瘤之一,在中国,其人群发病率位居第五,且呈逐年上升的趋势,严重威胁着人类的健康[1]。近年来许多研究显示,锌指转录因子2(SNAI2)在多种恶性肿瘤形成的过程中起到重要的作用:它参与肿瘤干细胞的形成,并在肿瘤的发生发展中发挥促进作用[2]。本研究拟探讨SNAI2在结直肠癌细胞中的表达水平及其对结直肠癌细胞增殖和侵袭能力的影响。
1 材料与方法
1.1 临床样本来源 样本收集于海南省人民医院胃肠外科2015年9月至2016年4月间大肠癌病理标本50例,以及相应癌旁组织50例(距癌变边缘15 cm切取)取材后液氮保存。
1.2 细胞来源 实验所用的人结直肠癌细胞系HT29、SW620、SW480、LOVO、HCT116、LS174T、HCT8细胞均来自中国医学科学院研究中心。
1.3 主要试剂 RPMI-1640培养基(Hyclone)、DMEM培养基(Hyclone)、胎牛血清(Hyclone)、逆转录试 剂 盒 (Maxima®First Strand cDNA Synthesis Kit,Fermentas)、定 量 PCR试 剂 盒(iQ SYBR Green Supermix,BioRad)、RNAiso Plus(TaKaRa公司,Code No.9108)、细胞增殖能力检测试剂盒(MTS,Promega)、BCAAssay Reagent(美国Pierce Chemical公司)、PVDF膜(Millpore公司,Cat NO.IPVH00010)。
1.4 主要抗体 SNAI2抗体(Abcam,ab27568)、E-cadherin抗体(Abcam,ab15148)、Vimentin抗体(Abcam,ab92547)、β-actin抗体(Santa Cruz,sc-4778)。
1.5 RT-PCR检测SNAI2基因的表达 TRIZOL法抽提细胞总RNA。紫外分光光度仪检测RNA浓度,取5 μg RNA进行逆转录反应,采用Cyber Green荧光实时定量PCR反应体系检测基因表达水平。反应条件:预变性94℃ 4 min,扩增条件94℃ 30 s,60℃1 min,40个循环。SNAI2上游引物:5'-AGACCCGCTGGCAAGGTGA CGCAAT-3';SNAI2下游引物:5'-AATGCTTATTATGCA TCTGAAGT-3';扩增引物大小为1 308 bp。以β-actin为内参基因,其上游引物序列为5'-TGGCACCCAGCACA ATGAA-3';下游引物序列为5'-CTAAGTCATAGTCCG CCTAGAAGCA-3';目的片段大小为186 bp。
1.6 Western-blot检测 SNAI2、E-cadherin以及Vimentin表达水平 收集结直肠癌癌细胞,裂解液冰上裂解1 h,15 000 g,15 min离心后提取上清液,收集蛋白质,BCA法行蛋白定量分析,配制10%丙烯酰胺胶,上样,80 V稳压跑胶30 min,120 V稳压跑胶1 h,湿转至PVDF膜,5%脱脂奶粉封闭1.0 h,一抗4℃孵育过夜,二抗37℃孵育1.5 h,发光液曝光显影。一抗浓度比为1:1 000,二抗浓度比为1:3 000,以β-actin作为内参。
1.7 慢病毒转染构建稳定knock-down SNAI2细胞系 针对SNAI2基因设计四组干扰RNA序列和一组无任何靶向位点的随机插入序列。将各组序列剪切到慢病毒载体上,用二代包装系统包装成慢病毒悬液。将HT29接种至6孔板,分别标记为对照组、shSNAI2 1#组、shSNAI2 2#组、shSNAI2 3#组、shSNAI2 4#组。对照组注入插入随机序列载体的慢病毒悬液,shSNAI2 1#组、shSNAI2 2#组#、shSNAI2 3#组、shSNAI2 4#组分别注入插入四组干扰RNA序列的慢病毒悬液。挑选SNAI2表达最高的SW480细胞系进行慢病毒感染,获得稳定knock-down SNAI2细胞系。具体方法:用Lipofectamine 2000以2.5:1的体积比将慢病毒shRNA质粒(6 μg/dish)、packing质粒(psPAX2,4.5 μg/dish)和Envelop质粒(pMD2.G;1.5 μg/dish)一并转入293T细胞,7 h后更换正常培基,培养48 h,过滤收集上清液,并将带有慢病毒的上清液感染SW480细胞,感染3 d后(加入Polybrene),使用Puromycin筛选稳定细胞系,并进行Western blot验证。有效shRNA序列为shSNAI21#:TTCACAGCTGTCCCAGAGGG;shSNAI2 2#:TGAGGCGGGACCCTCAGGCC;shCtrl:GCTGTTT TTTGAGATTTCAG,详细步骤参见文献[3]。
1.8 MTS法检测细胞增殖活力 收集对数生长期细胞,以5×103个细胞每孔的细胞浓度,将细胞接种至96孔板中,每孔加入100 μL细胞悬液(设置5个复孔),置于5%CO2、37℃培养箱中培养。分别检测细胞0 h、24 h、48 h以及72 h的细胞增殖活力,MTS与培基以1:5的比例混合均匀,混匀后于生化培养箱中孵育60 min后用多孔板酶标仪在490 nm检测吸光度。
1.9 细胞侵袭实验以及细胞划痕修复实验 采用Transwell小孔迁移试验检测细胞的侵袭能力,具体步骤见参见文献[3]及说明书。
1.10 统计学方法应用SPSS19.0统计学软件对数据进行统计分析,计量资料以均数±标准差(x-±s)表示,两两比较采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 RT-PCR检测临床样本中SNAI2 mRNA的表达 RT-PCR结果显示,结直肠癌组织细胞中SNAI2 mRNA水平相比正常癌旁组织显著升高,差异具有统计学意义(P<0.05),见图1。
2.2 Western blot检测直肠癌细胞系中SNAI2的表达 在 HT29、SW620、SW480、LOVO、HCT116、LS174T、HCT8细胞系中检测SNAI2蛋白的表达水平,选取表达量最高的细胞系构建稳定knock-down SNAI2细胞系。结果显示,SW480细胞系SNAI2表达量高于其他细胞系,见图2。
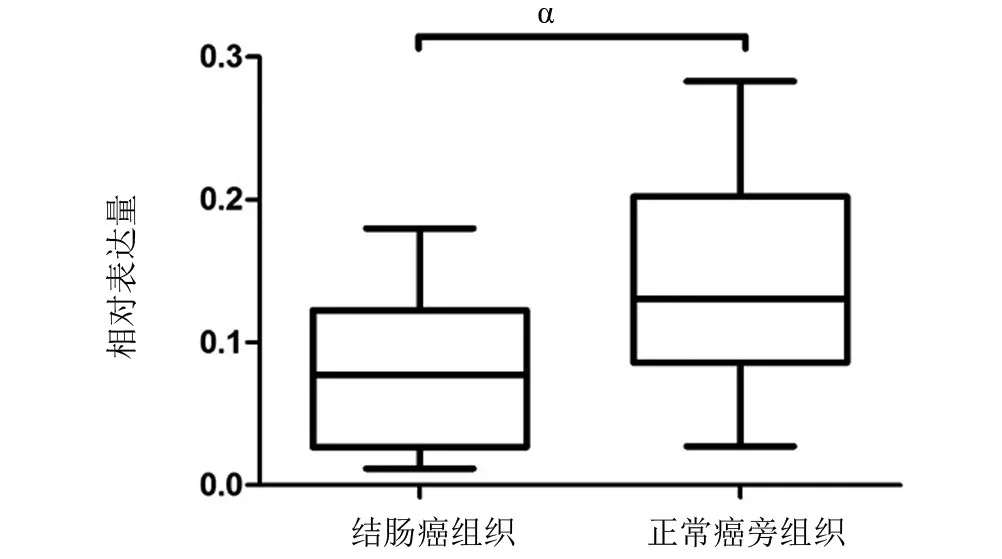
图1 SNAI2在结肠癌组织和正常癌旁组织中的mRNA表达水平比较

图2 SNAI2在结肠癌细胞系中的蛋白表达水平及比较
2.3 五组SNAI2蛋白及mRNA的表达量比较 Western blot法检测SNAI2蛋白表达量,结果显示,shSNAI2 1#组、shSNAI2 3#组SNAI2蛋白水平下调显著,与对照组相比,差异均有统计学意义(P<0.05);RT-PCR 法检测显示,shSNAI2 1#组、shSNAI2 3#组SNAI2 mRNA表达明显下调,与对照组相比,差异均有统计学意义(P<0.05),见图3和图4。
2.4 干扰SNAI2表达对SW480细胞增殖能力的影响 利用MTS方法检测敲除SNAI2后,SW480细胞增殖活力的变化。MTS法连续检测3 d对照组及knock-down SNAI2稳定细胞系中的细胞增殖活力改变,在经过慢病毒感染后的稳定knock-down SNAI2细胞中,细胞在第2天、第3天细胞增殖活力明显降低,差异具有统计学意义(P<0.05),见图5。

图3 SW480 knock-down SNAI2细胞系4组序列的蛋白表达水平

图4 SW480 knock-down SNAI2细胞系4组序列的mRNA表达水平

图5 SW480 knock-down SNAI2细胞系MTS增殖活力的变化
2.5 干扰SNAI2表达对SW480细胞迁移能力的影响 对shSNAI2的SW480细胞系进行细胞划痕修复实验。在划痕0 h及24 h两个时间点进行拍照,比较两组细胞的迁移能力。结果显示,与对照组比较,shSNAI2的SW480细胞系细胞迁移能力减弱,见图6。

图6 SW480细胞knock-down SNAI2细胞系划痕修复实验比较
2.6 干扰SNAI2表达水平对SW480细胞中E-cadherin和Vimentin蛋白表达水平的影响 上皮间充质转化(epithelial-mesenchymal transition,EMT)相关分子:E-钙黏蛋白(E-cadherin)和波形蛋白(Vimentin)的表达水平可作为评价肿瘤细胞侵袭转移的标志性特征。利用Western blot检测E-cadherin和Vimentin的蛋白表达水平。从结果可以看出,SNAI2下调后,E-cadherin的表达显著上调,Vimentin表达降低,见图7。

图7 SW480细胞knock-down SNAI2细胞系E-cadherin和Vimentin蛋白的表达量
3 讨 论
SNAI2在人正常机体内充当调节激活转录的作用,并参与神经嵴细胞的产生和迁移[4]。近年来有许多报道显示,其与多种肿瘤的发生发展密切相关:SNAI2参与抑制紧密连接蛋白(Zo-1)的表达,促进上皮细胞恶性转化[5]。Tripathi等[6]研究发现,乳腺细胞中,SNAI2通过结合E2-BOX蛋白和募集羧基末端结合蛋白-1(C-terminal-binding protein-1,CTBP1)及组蛋白去乙酰化酶1(histone deacetylase-1,HDAC1),调控乳腺癌相关基因BRCA2的表达。Wang等[7]和Gu等[8]研究证明,在卵巢癌细胞中,SNAI2可通过抑制Aurora-A的表达来促进细胞的侵袭及转移。在肝癌细胞中,SNAI2可促进转录因子SOX2及Nanog的表达,促进肝癌细胞的侵袭和转移[9],对TWIST1诱导的EMT及其促进侵袭转移能力也起到重要作用[10]。
本研究运用荧光定量PCR技术检测结直肠癌样本及癌旁正常组织中SNAI2的mRNA表达水平,发现结直肠癌组织中SNAI2的mRNA表达明显高于正常癌旁组织,提示高表达的SNAI2在癌症发生发展的过程中可能起一定的作用进而我们通过慢病毒转染shRNA SNAI2质粒构建稳定敲除SNAI2的SW480细胞系。MTS的结果发现SNAI2表达下调后,肿瘤细胞增殖能力显著降低,表明SNAI2在结直肠癌中能促进肿瘤细胞的增殖。划痕修复实验结果示SNAI2下调后,细胞迁移能力显著减弱,表明SNAI2在结直肠癌中能促进肿瘤细胞的迁移。经进一步对shSNAI2 SW480细胞系的EMT相关分子E-cadherin及Vimentin进行检测,结果显示,E-cadherin是上皮细胞表达的一种重要的黏附分子,代表细胞的黏附强度,恶变过程中E-cadherin的表达下调往往意味着细胞活动性增加,肿瘤细胞转移能力增强;Vimentin是构成细胞骨架的重要成分,在细胞移行、黏附中起关键作用。有许多研究指出Vimentin在恶性肿瘤中表达增强且与细胞侵袭转移正相关[11]。本实验中,下调SNAI2后,E-cadherin表达上调,Vimentin表达下调,提示SNAI2在结直肠癌侵袭转移中起到促进作用。
综上所述,SNAI2对结直肠癌的发生发展有着积极的作用。在接下来的研究中,将进一步通过动物体内实验验证SNAI2在肿瘤发生发展中的作用,并结合临床标本,分析临床资料,阐明SNAI2在结直肠癌患者的预后以及复发和转移中的确切作用,SNAI2在肿瘤发生侵袭转移的早期和后期分别扮演着何种角色,确定其可能的靶标分子,为结直肠癌的临床诊治以及诊断提供一个新的分子靶标。
[1]赵晓敏,李云涛,季国忠.结直肠癌筛查现状与进展[J].中国临床研究,2016,29(6):838-841.
[2]Cobaleda C,Pérez-Caro M,Vicente-Dueñas C,et al.Function of the zinc-finger transcription factor SNAI2 in cancer and development[J].Annu Rev Genet,2007,41:41-61.
[3]王舰梅.DAB2IP在结直肠癌侵袭和转移中的作用机制[D].广州:南方医科大学,2014.
[4]Gismervik K,Bruheim T,Rørvik LM,et al.Invasive slug populations(Arion vulgaris)as potential vectors for Clostridium botulinum[J].Acta Vet Scand,2014,56(1):65.
[5]Huang JW,Guan BZ,Yin LH,et al.Effects of estrogen-related receptor alpha(ERRα)on proliferation and metastasis of human lung cancer A549 Cells[J].J Huazhong Univ Sci Technolog Med Sci,2014,34(6):875-881.
[6]Tripathi MK,Misra S,Khedkar SV,et al.Regulation of BRCA2 gene expression by the SLUG repressor protein in human breast cells[J].J Biol Chem,2005,280(17):17163-17171.
[7]Wang Z,Liu Y,Lu L,et al.Fibrillin-1,induced by Aurora-A but inhibited by BRCA2,promotes ovarian cancer metastasis[J].Oncotarget,2015,6(9):6670-6683.
[8]Gu A,Jie Y,Yao Q,et al.Slug is associated with tumor metastasis and angiogenesis in ovarian cancer[J].Reprod Sci,2017,24(2):291-299.
[9]Zhao X,Sun B,Sun D,et al.Slug promotes hepatocellular cancer cell progression by increasing sox2 and nanog expression[J].Oncol Rep,2015,33(1):149-156.
[10]Grzegrzolka J,Biala M,Wojtyra P,et al.Expression of EMT Markers SLUG and TWIST in breast cancer[J].Anticancer Res,2015,35(7):3961-3968.
[11]Patil PU,D'Ambrosio J,Inge LJ,et al.Carcinoma cells induce lumen filling and EMT in epithelial cells through soluble E-cadherin-mediated activation of EGFR[J].J Cell Sci,2015,128(23):4366-4379.
Expression of SNAI2 in colorectal cancer and its effect on cell proliferation and invasion.
ZOU Yong-ping,LI Long-he.Department of Emergency Surgery,Hainan General Hospital,Haikou 570311,Hainan,CHINA
ObjectiveTo define the expression of SNAI2 in colorectal cancer and its effect on the proliferation and invasion of colorectal cancer cells.MethodsThe expression level of SNAI2 was detected by reverse transcription polymerase chain reaction(RT-PCR)in 50 cases of colorectal cancer tissues and adjacent tissues from Department of Gastrointestinal Surgery in our hospital during Sep.2015 and Apr.2016,and the difference between the two groups was detected by t test.For the SNAI2 gene,four groups of interfering RNA sequences and a group of random insertion sequences without any targeting sites were designed.The sequence of each group was sheared onto lentiviral vector and packaged into lentivirus suspension by two generation packaging system.HT29 was inoculated into 6 orifice plates and labeled as control group,shSNAI2 1#group,shSNAI2 2#group,shSNAI2 3#group,and shSNAI2 4#group.The control group was injected with lentivirus suspension inserted into the random sequence vector.ShSNAI2 1#group,shSNAI2 2#group,shSNAI2 3#group and shSNAI2 4#group were injected with four groups of lentivirus suspension which interfered with RNA sequence.SNAI2 cell line with the highest expression of SW480 was selected for lentivirus infection,and stable knock-down SNAI2 cell line was obtained.In SW480 cells with the high expression of SNAI2,the SNAI2 interference of stable cell lines was established through slow infection.The proliferation ability of cell was detected by thiazole blue(MTS)colorimetry method.The cell invasion ability was detected by scarification test.Western blot was used to detect the expression of E-cadherin and Vimentin.ResultsThe expression of SNAI2 in normal adjacent tissues was less than that in colorectal cancer tissues compared with normal adjacent tissues,and the difference was statistically significant(P<0.05).The expression of cell adhesion molecule E-cadherin increased compared with the control group,while the expression of cytoskeletal protein and Vimentin decreased,both with statistically significant difference(P<0.05).In
2014年海南省应用技术研发与示范推广专项(编号:ZDXM2014066)
邹永平。E-mail:strong007@qq.com the SW480 siSNAI2 cell line,compared with the control group,the cell invasion and proliferation ability decreased significantly(P<0.05).ConclusionSNAI2 is highly expressed in human colorectal cancer tissue,and it could promote the proliferation,invasion and migration of colorectal cancer cells in vivo.
SNAI2;Colorectal cancer;Cell proliferation;Cell invasion
R735
A
1003—6350(2017)23—3789—04
10.3969/j.issn.1003-6350.2017.23.002
2017-07-07)

