超滤膜提取金银花多糖及其抗氧化活性的影响
邓朝阳,张森旺,王慧宾,胡居吾,熊伟
(江西省科学院应用化学研究所,江西南昌 330096)
超滤膜提取金银花多糖及其抗氧化活性的影响
邓朝阳,张森旺,王慧宾,胡居吾,熊伟
(江西省科学院应用化学研究所,江西南昌 330096)
目的:以金银花为研究对象,利用微滤-超滤-纳滤技术分离提纯金银花提取液中的多糖。方法:根据金银花多糖与其他成分分子量差异,先采用微滤膜对金银花浸提液进行除杂,然后采用超滤和纳滤膜分离金银花粗多糖。并考察金银花不同分离段多糖还原能力以及对DPPH自由基的清除效果。结果:纯化后的金银花多糖主要存在于超滤的截留液中,而纳滤膜的截留液中金银花多糖抗氧化能力最强。结论:微滤超滤膜联用可以达到纯化金银花多糖的目的。
金银花;多糖;提取;膜分离技术;抗氧化活性
多糖广泛存在于自然界,是来自高等植物、动物细胞膜、微生物细胞壁中的天然大分子物质,为构成生命活动的四大基本物质之一,并与维持生命所需的多种生理功能密切相关[1]。近几年,大量文献报道[2-6]多糖具有抗氧化、抗炎、抗肿瘤、增强免疫力、抗病毒以及抗衰老等活性,中药金银花(Lonicera japonica)为忍冬科(Caprifoliaceae)、忍冬属(Lonicera Linn.)植物的干燥花蕾,是我国传统的药食同源植物,具有清热解毒、凉散风热之功效[7]。多糖作为金银花成分之一,据目前的了解,对其研究较少。
与传统的多糖分离技术相比,膜分离技术比微滤、超滤、纳滤、反渗透具有一定的优势,其可以在室温下单独操作,不需要相变,可以节省时间适合大规模生产。更重要的是,膜分离技术对于生物活性和热敏性物质更加适用。近年来,超滤和纳滤技术已广泛应用于分离多糖和多酚类物质[8]。
先前的研究主要集中在金银花中绿原酸等小分子化合物的研究上,而对其多糖类成分研究较少。本研究以金银花为原料,利用微滤-超滤-纳滤分离技术对金银花提取液进行分离,收集各段成分,并对其抗氧化活性进行初步评价,进一步阐释中药金银花的药效成分,合理设计金银花多糖膜分离提取工艺。
1 实验材料
1.1 材料与试剂
金银花,产地河南新乡,置于60℃的恒温鼓风干燥箱中,恒温烘干后,置于密封袋中密封,保存于4℃的冰箱中待用。
二苯基苦味酰基苯肼(DPPH)购于Sigma公司;苯酚、浓硫酸、葡萄糖、氯化铁、铁氰化钾、无水乙醇、Vc、BHT、硫酸亚铁、水杨酸、氯仿、丙酮、正丁醇、过氧化氢,均购于国药集团化学试剂有限公司。所用试剂均为分析纯。
1.2 实验仪器
分析天平(北京赛多利斯仪器系统有限公司)、紫外-可见分光光度计(北京谱析通用公司)、Direct-Q3CHAO超纯水系统(美国密理博公司)、Q-250B3高速多功能粉碎机(上海冰都电器有限公司)、SHZ-Ⅲ循环水真空泵(郑州长城科工贸有限公司)、RE-3000旋转蒸发器(上海荣生生化仪器厂)、BONA-GM-18微滤-超滤-纳滤膜分离实验机(配有不同规格的卷式膜组件,济南博纳生物技术有限公司)。
1.3 实验方法
1.3.1 金银花多糖提取液的制备
取上述金银花用粉碎机粉碎,采用水浸提法,以液料比20∶1、浸提温度90℃、浸提时间2h为提取工艺参数,提取金银花多糖。冷却后离心,合并滤液,将提取液用膜分离技术进行纯化精制。
1.3.2 膜分离试验
在室温条件下,样品液经输液泵输入膜分离组件,以错流过滤的方式通过膜组件,经膜分离后透过液从膜组件外侧出口端流出,截留液返回进料罐中再次循环膜过滤[9],集中收集相应的截留液、透过液,得到相应截留分子量的多糖溶液。实验工艺流程如图1所示。
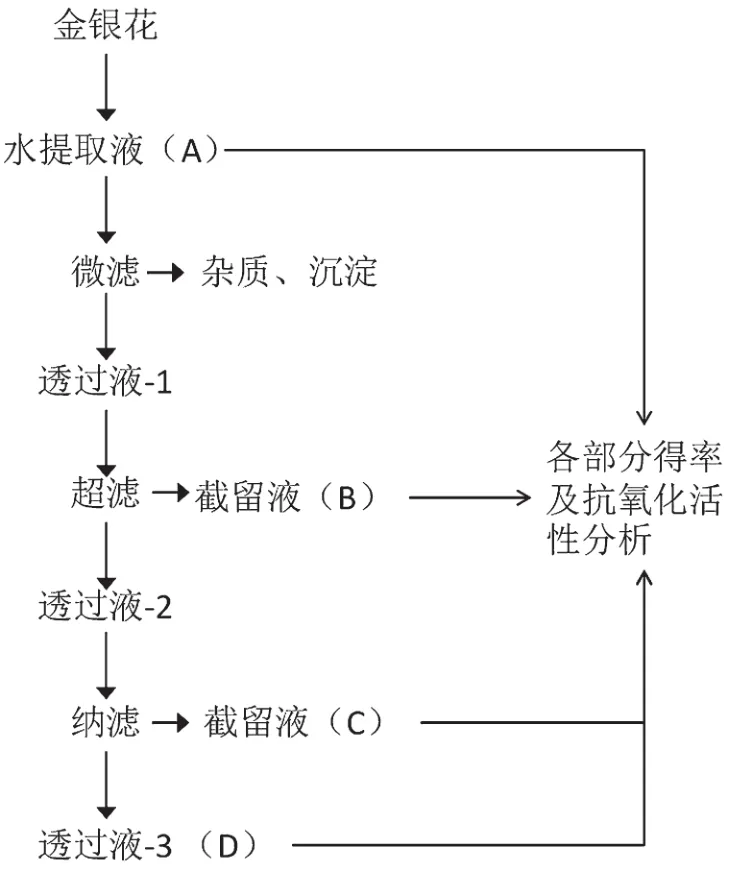
图1 实验工艺流程图
1.4 分析方法
1.4.1 苯酚硫酸法测定多糖含量
(1)标准曲线的绘制。精密称取干燥至恒重的葡萄糖标准样品20mg,用蒸馏水定容至20mL,得到浓度为1mg/mL的葡萄糖标准溶液。分别取0、10、20、30、40、50、60μL和70μL标准溶液于小试管中并以此加蒸馏水至200μL。各加5%苯酚溶液0.4mL,混合均匀,滴加2mL的浓硫酸,摇匀放在沸水浴中加热15min,冷却至室温后,在490nm处用酶标仪测定其吸光值。以葡萄糖浓度C1(μg/mL)为横坐标,吸光值A为纵坐标,绘制葡萄糖标准曲线,得到线性回归方程为A=0.003 1C1+0.018 2,相关系数r2=0.996 8。
(2)多糖含量测定。取各分离段提取液1.0mL,加5%的苯酚溶液0.4mL,摇匀滴加浓硫酸2mL,混合均匀,在沸水浴中加热15min,冷却至室温后,用酶标仪在490nm下测定吸光值。根据回归方程计算各分离段多糖含量。

式①中:Y1为多糖含量,%;C1为代入标准曲线中计算出多糖质量浓度,mg/mL;D为样品溶液的稀释倍数;V为待测样液的体积,mL;m为称取金银花的质量,mg。
A、B、C和D组分多糖得率

式②中:Y2分别为A、B、C和D组分的得率,%;m1分别为A、B、C和D组分质量(干基计),mg。
A、B、C和D组分多糖纯度

式③中:P为粗多糖或粗低聚糖纯度,%。
1.4.2 DPPH自由基清除能力测定
按照Hu[10]方法,取不同浓度A、B、C和D溶液100μL加到96孔透明板中,分别加入100μL 0.2mmol/L的DPPH溶液。依照相同的操作方法,将不同浓度的样品液分别与80%甲醇混匀作为空白组,采用酶标仪在波长517nm处测其吸光值,重复3次实验,每次3组平行,取平均值。
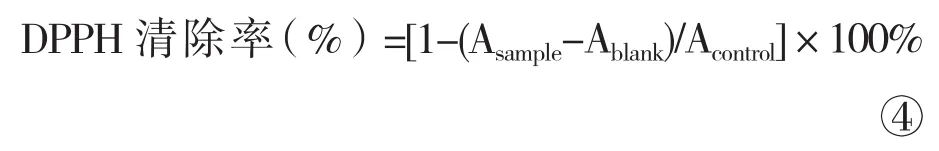
式④中,Asample为DPPH溶液与样品液的吸光度之和;Ablank为样品与提取溶剂的吸光度之和;Acontrol为DPPH溶液与提取溶剂的吸光度之和。
2 结果与讨论
2.1 金银花各分离段得率及其多糖含量
选用一定规格的微滤-超滤膜,在实验用膜分离装置上对金银花中各组分糖进行分段,实验过程中分别收集截留液和透过液,减压浓缩,冷冻干燥得到A、B、C和D 4段样品,分别称其质量,并测定其得率及纯度,结果如图2所示。
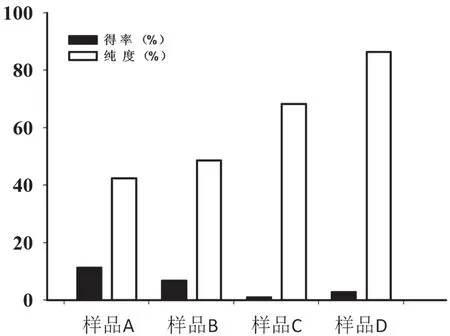
图2 金银花各提取液样品得率及纯度
从图2可以看出,金银花多糖提取液经过一系列膜分离后分为3部分,其中得率最高的为超滤膜截留液B部分,得率为6.85%;纳滤膜截留液C和纳滤膜透析液D的得率相对较低,其得率分别为1.03%和2.89%。在本次实验中,所得到B、C和D组分多糖都不纯,B中的糖纯度为48.68%,与金银花多糖提取液纯度基本一致。提取液中含有大量的沉淀等杂质,导致其纯度降低,而B部分多糖纯度较低是因为金银花中除了分子量大的多糖外,还含有较多的蛋白质。C样品中,糖纯度为68.32%,这部分主要是由低聚糖组成,往往含有很多分子量相近的色素或小分子化合物的聚合体在里面,所以其纯度也不高。D样品中,纯度为86.37%,说明所测糖含量为其单糖含量,并不是多糖的含量,往往里面还含有一些水溶性的多酚或者黄酮等小分子化合物。
2.2 不同分离段金银花多糖DPPH自由基清除能力变化
清除DPPH自由基是一种用途最为广泛的抗氧化模型,由于其快捷、高效、稳定的特点常被用来检测各种样品的清除自由基的能力。金银花多糖过膜后不同分离段的清除DPPH自由基能力如图3所示。由图可知,所有样品的清除能力都随着加入样品的浓度增加而增强,当样品浓度为120mg/mL时,A、B、C和D的清除率分别为86.39%、60.12%、95.32%和88.38%,说明各分离段都具有清除DPPH自由基能力。相同浓度下,其清除DPPH自由基能力的大小顺序为C>D>A>B,各多糖部位表现出清除DPPH自由基的能力不同,这可能与其含有的化学成分不同有关,除了多糖本身具有清除DPPH自由基能力,与含有的或者化学键链接的小分子化合物有关[11-12],C段中清除自由基能力最强,说明其多糖本身可能连接小分子化合物,如黄酮多酚等抗氧化活性较强的物质。以上数据说明表金银花多糖清除DPPH自由基的活性段主要是C段-低聚糖分离段。
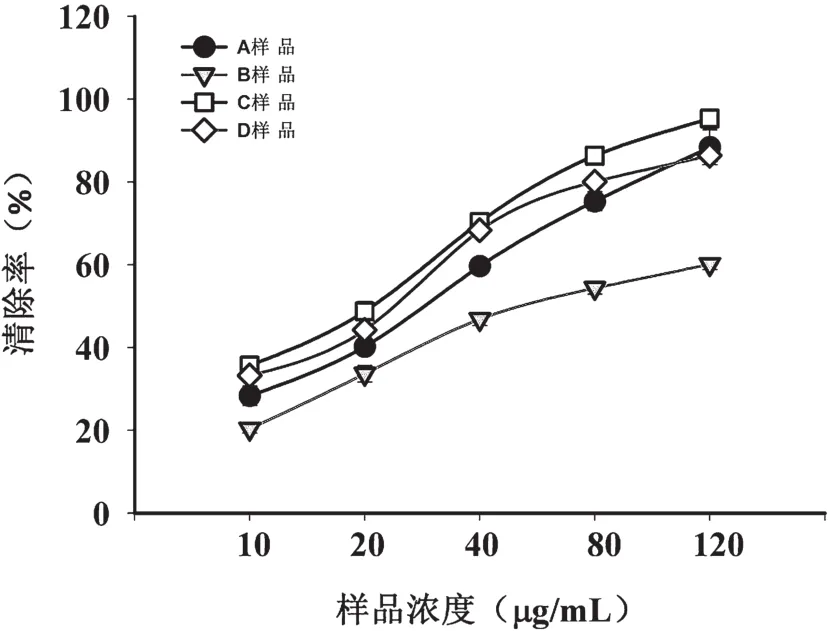
图3 金银花不同分离段对DPPH自由基的清除率
2.3 不同分离段金银花多糖还原能力变化
Fe3+还原能力是酚类物质抗氧作用的重要机制,其表现形式通过电子转移,化合物还原能力主要通过氢质子的传递破坏自由基链来发挥其抗氧化作用[13]。金银花多糖过膜后的不同分离段的Fe3+还原能力由图4可知,横坐标代表样品的浓度,纵坐标代表其吸光度,吸光度越大,说明样品还原能力越强,相同浓度下的不同样品中,其强弱关系分别为C>D>A>B,与清除DPPH自由基的能力一致。随着样品浓度的增加,其样品吸光度逐渐增大,还原能力逐渐增强,线性关系良好。以上数据充分说明金银花多糖过膜后的不同分离段还原能力最强活性段为C段。
之前国内文献[7]报道金银花多糖抗氧化的研究,发现金银花多糖对·DPPH自由基和·OH自由均有较强的清除能力,其EC50分别为0.016mg/mL和0.21mg/mL。本实验研究金银花多糖清除能力效果更好,原因是其提取金银花的方式不同,文献采用酸性提取金银花多糖,造成其他多糖未提取完全,提取过程中也可能导致多糖与抗氧化能力较强的小分子化和化学键的断裂。
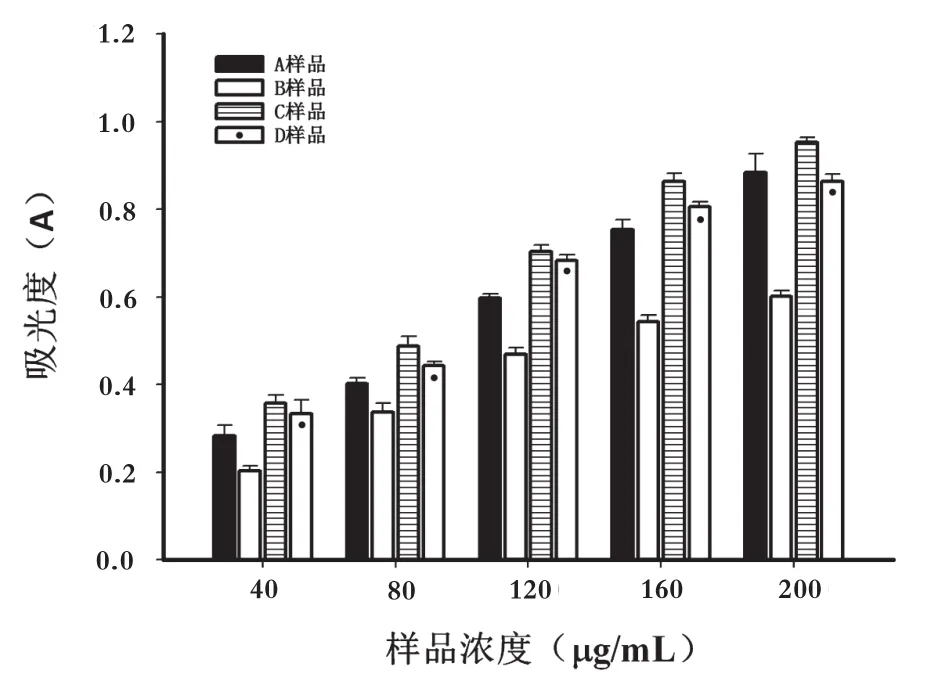
图4 金银花不同分离段Fe3+还原能力
3 结论
采用微滤-超滤-纳滤膜分离技术对金银花多糖提取液进行了提取分离,并对各分离段的得率和纯度进行计算,探讨了各分离段的抗氧化活性,结果表明:金银花多糖主要集中在超滤截留液B中,但是抗氧化活性最强段为纳滤截留液C。可见,微滤-超滤-纳滤技术对于分离金银花中的多糖成分是一种有效的分离方法,是金银花多糖提取走向实用化、工业化的有效途径。
[1]俞慧红,竺巧玲,戴飞,等.多糖抗氧化作用的研究现状[J].食品研究与开发,2008,29(3):172-176.
[2]李粉玲,蔡汉权,林泽平.红豆多糖抗氧化性及还原能力的研究[J].食品工业,2014(2):190-194.
[3]Liu YJ,Du JL,Cao LP,et al.Anti-inflammatory and hepatoprotective effects of Ganoderma lucidum polysaccharides on carbon tetrachlorideinduced hepatocyte damage in common carp (Cyprinus carpio L.)[J].International immunopharmacology,2015,25(1):112-120.
[4]Sun Y,Sun T,Wang F,et al.A polysaccharide from the fungi of Huaier exhibits anti-tumor potential and immunomodulatory effects[J].Carbohydrate polymers,2013,92(1):577-582.
[5]Komatsu T,Kido N,Sugiyama T,et al.Antiviral activity of acidic polysaccharides from Coccomyxa gloeobotrydiformi,a green alga,against an in vitro human influenza A virus infection[J].Immunopharmacology and immunotoxicology,2013,35(1):1-7.
[6]Ma X,Dan Guo D,Peterson E C,et al.Structural characterization and anti-aging activity of a novel extracellular polysaccharide from fungus Phellinus sp.in a mammalian system[J].Food &Function,2016,7(8):3468-3479.
[7]向佳兰,王茜,谢阳,等.响应曲面法优化金银花多糖提取条件及抗氧化活性研究[J].乐山师范学院学报,2015,30(12):36-41.
[8]Giacobbo A,Bernardes A M,de Pinho M N.Nanofiltration for the recovery of low molecular weight polysaccharides and polyphenols from winery effluents[J].Separation Science and Technolo gy,2013,48(17):2524-2530.
[9]原超,范三红,林勤保,等.超滤、纳滤技术分离大枣功效成分的研究[J].食品科技,2012(2):102-107.
[10]Wu H,Zhu J,Diao W,et al.Ultrasound-assisted enzymatic extraction and antioxidant activity of polysaccharides from pumpkin (Cucurbita moschata)[J].Carbohydrate polymers,2014,113:314-324.
[11]Yuan Y,Macquarrie D.Microwave assisted extraction of sulfated polysaccharides (fucoidan) from Ascophyllum nodosum and its antioxidant activity[J].Carbohydrate polymers,2015,129:101-107.
[12]Li XM,Li XL,Zhou AG.Evaluation of antioxidant activity of the polysaccharides extracted from Lycium barbarum fruits in vitro[J].European Polymer Journal,2007,43(2):488-497.
[13]Alam M N,Bristi N J,Rafiquzzaman M.Review on in vivo and in vitro methods evaluation of antioxidant activity[J].Saudi Pharmaceutical Journal,2013,21(2):143-152.
Extraction and Isolation of Polysaccharide from Lonicera japonica by Membrane Separation Technology and Evaluation of its Antioxidant Activity
Deng Chao-yang,Zhang Sen-wang,Wang Hui-bin,Hu Ju-wu,Xiong Wei
(Institute of Applied Chemistry,Jiangxi Academy of Sciences,Jiangxi Nanchang 330096)
Objectives:To extract and purify the polysaccharide from Lonicera japonica by microfiltration (MF),ultrafiltration (UF) and nanofiltration (NF) and evaluate its anti-oxidant activity.Methods:According to the molecular weight difference of Lonicera japonica polysaccharide and other components,using microfiltration membrane to leach impurity extract of Lonicera japonica,then determine the purity of using an integrated sedimentation and ultrafiltration process to treat the penetrating fluid of ultrafiltration and evaluate the ability of DPPH free radical scavenging activity and reducing power.Results:Much of the polysaccharide were detected in the retention fluid from the membrane with ultrafiltration.The best anti-oxidant activity ability of polysaccharide was mainly concentrated in the retention fluid from the membrane with nanofiltration.Conclusions:the preferred aperture of microfiltration and ultrafiltration membrane can purified Lonicera japonica.
Lonicera japonica;Polysaccharide;Extraction and purification;Membrane separation technology;Antioxidant activity
R284.2;S567 文献标志码:A
2096-0387(2017)06-0038-04
国家自然科学基金项目(31260400);江西省科技计划项目(20151BBF60024);江西省科学院国家级预研项目(2014YGY09)。
邓朝阳(1967-),女,江西南昌人,本科,副研究员,研究方向:天然产物化学。

