洗涤条件对重组TATm-survivin(T34A)包涵体纯度的影响
张海毅
(威海职业(技术)学院,山东威海 264210)
洗涤条件对重组TATm-survivin(T34A)包涵体纯度的影响
张海毅
(威海职业(技术)学院,山东威海 264210)
目的:确定重组TATm-survivin(T34A)包涵体的洗涤条件。方法:将补料分批发酵得到的重组大肠杆菌破碎,得到TATm-survivin(T34A)粗制包涵体,探索pH、化学物质、尿素浓度、洗涤次数对包涵体洗涤的影响。结果:得到重组TATmsurvivin(T34A)包涵体的最佳洗涤条件为洗涤液成分为pH10.0甘氨酸-氢氧化钠缓冲液(20mmol/L),内含100μmol/L巯基乙醇、0.5%Triton X-100、0.5mol/L尿素、1mol/L氯化钠和2.5mmol/L EDTA;洗涤次数为4次。结论:利用优化的洗涤条件进行洗涤后,包涵体的纯度达到85%左右,整体的回收率达到80%以上。
重组TATm-survivin(T34A);包涵体;洗涤条件
重组抗癌药物TATm-survivin(T34A)经大肠杆菌表达纯化后,能够进入细胞内部发挥作用,诱导肿瘤细胞的凋亡,具有进一步研发的价值和良好的产业化前景[1-2]。然而,在摇瓶到生物反应器的放大过程中发现,摇瓶优化的包涵体纯化复性方法已经不适用于发酵罐中得到的包涵体,按照原纯化方法得到的重组蛋白纯度明显下降,大大影响了重组蛋白的质量。
TATm-survivin(T34A)重组大肠杆菌发酵后,表达的TATm-survivin(T34A)以不溶物聚集物即包涵体的形式存在,需要在体外对TATm-survivin(T34A)包涵体进行复性。包涵体的处理过程包括包涵体收集、纯化和复性。为得到较为纯化的包涵体蛋白,需要对包涵体进行洗涤。洗涤同时还可以去除大肠杆菌外膜蛋白OmpT(37kDa),后者在4~8mol/L尿素中具有蛋白水解酶活性,在包涵体的溶解和复性过程中可导致重组蛋白质的降解[3]。研究表明,包涵体的纯度越高,越有利于后续的纯化和复性[4],所以包涵体的洗涤非常重要,不可忽视。针对上述重组抗癌药物TATm-survivin(T34A)放大过程中出现的问题,发现补料分批培养得到的粗制包涵体,与比摇瓶中杂蛋白多,增加了包涵体洗涤的难度,因此有必要摸索包涵体洗涤的最佳条件,为后续包涵体的纯化复性提供高纯度的精制包涵体。
1 材料与方法
1.1 实验材料
TATm-survivin(T34A)重组大肠杆菌细胞:补料分批发酵后得到的菌体,具体发酵条件参考[5]。
1.2 实验方法
1.2.1 包涵体的制备
将补料分批发酵后得到的细胞培养液于8 000r/min、4℃下离心10min收集菌体。称取3g湿菌体悬浮于20mL细胞破碎液(20mmol/L Tris-HCl,pH=7.5)中,超声破碎150次(400W,开3s,停3s),于8 000r/min、4℃下离心10min,得到的沉淀为粗包涵体。将粗包涵体重悬于不同包涵体洗涤液中洗涤,于8 000r/min、4℃下离心10min,重复此步收集沉淀为精制包涵体。
1.2.2 包涵体的洗涤
将粗包涵体重悬于不同包涵体洗涤液中洗涤,于8 000r/min、4℃下离心10min,重复此步收集沉淀为精制包涵体。
1.2.3 包涵体的溶解
将精制包涵体溶解于10mL 8mol/L尿素溶液(20mmol/L Tris-HCl,pH8.5,内含 100μmol/L巯基乙醇)中,振荡混合。于8 000r/min、4℃下离心15min,去掉少量不溶物,上清即为溶解的包涵体,于4℃保存。
1.2.4 包涵体纯度的测定
SDS-PAGE的浓缩胶浓度为5%,分离胶浓度为15%,以考马斯亮蓝R-250染色显示蛋白条带,进行扫描定量。
1.2.5 蛋白浓度的测定
蛋白浓度测定采用考马斯亮蓝染色法(Bradford)[6],BSA为标准品。
2 结果与讨论
本研究以1mol/L氯化钠和2.5mmol/L EDTA溶液作为基础洗涤液。选择这两种物质作为基础成分,一方面这两种物质在洗涤过程中不会溶解目标蛋白,另一方面高盐洗涤可以去掉杂蛋白污染物,同时又提高了溶液的离子强度,增加了去垢能力,EDTA则可以用来抑制金属蛋白酶。在此基础上对包涵体洗涤液pH、化学物质、尿素浓度及洗涤次数进行了优化。
2.1 洗涤缓冲液pH值对包涵体洗涤效果的影响
配制不同pH的缓冲液,即磷酸氢二钠-磷酸二氢钠缓冲液(20mmol/L,pH=7.0)、Tris-HCl缓冲液(20mmol/L,pH=8.0)、甘氨酸-氢氧化钠缓冲液(20mmol/L,pH=9.0,pH10.0)。洗涤缓冲液pH值对包涵体洗涤效果的影响结果见图1和图2。从图中可以很明显地看出,随着洗涤液pH的升高,更多的杂蛋白被去除,包涵体的纯度增加,上清液中也有少许目标蛋白损失。当洗涤液pH值为10.0时,包涵体的纯度最高(59.6%),目标蛋白有87%被保留。可见,极端pH可以起到增溶杂蛋白的作用,有利于包涵体的洗涤。

图1 pH对包涵体洗涤的影响

图2 pH对包涵体洗涤收率和纯度的影响
2.2 化学物质对包涵体洗涤效果的影响
配制pH=10.0甘氨酸-氢氧化钠缓冲液(20mmol/L),分别添加100μmol/L巯基乙醇、0.5%Triton X-100、0.001% SDS进行洗涤,结果如图3所示。从图3可以看出,与对照相比,这3种物质对包涵体的洗涤效果均有促进作用。其中,添加巯基乙醇洗涤后,包涵体纯度达到65.8%,添加Triton X-100和SDS后,包涵体纯度分别为62.8和63.2%。巯基乙醇作为一种还原剂,常常用来打开包涵体中含有的一些链间二硫键和链内的非活性二硫键;非离子型去垢剂Triton X-100用来去除不溶的膜碎片和膜蛋白;阴离子去污剂SDS可以破坏蛋白的疏水键,去除通过疏水作用与包涵体结合的杂质。残留的SDS在随后的分离纯化中不易彻底去除,而且在洗涤效果上与Triton X-100相当,因此在洗涤液中不添加SDS,只添加巯基乙醇和Triton X-100。
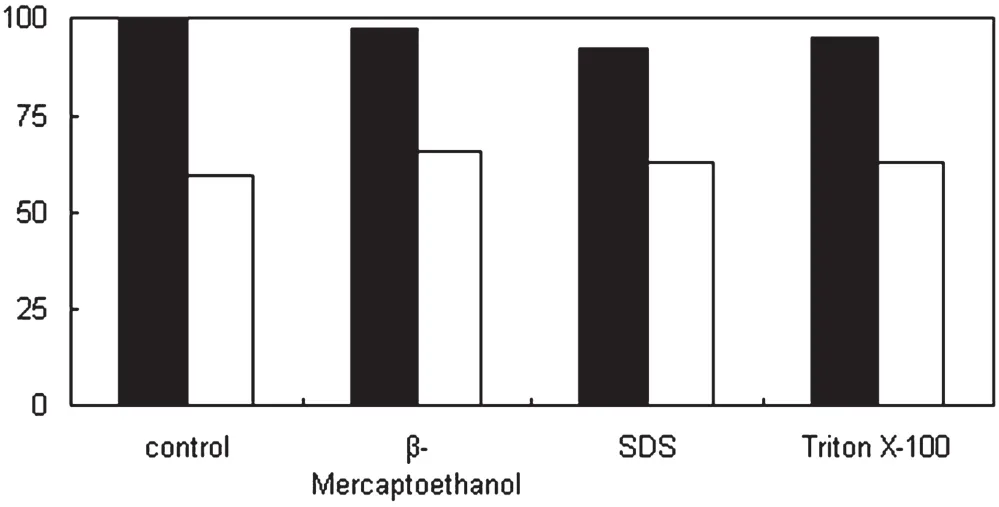
图3 化学物质对包涵体洗涤收率和纯度的影响
2.3 尿素浓度对包涵体洗涤效果的影响
低浓度的变性剂(如尿素)常常被用于包涵体的洗涤。为了进一步提高包涵体的纯度,不同浓度的尿素被添加到洗涤液中。配制pH=10.0甘氨酸-氢氧化钠缓冲液(20mmol/L),内含100μmol/L巯基乙醇和 0.5%Triton X-100,分别添加 0.5、1、1.5、2mol/L尿素进行洗涤,结果如图4所示。从图4可以看出,随着尿素浓度的增加,包涵体的纯度没有明显提高,当尿素浓度从1.5mol/L增加到2mol/L时,目标蛋白收率由98%降到89%,表明包涵体中部分目标蛋白被溶解。因此,选择添加尿素浓度为0.5mol/L。经过一系列的优化后,最终的包涵体洗涤液组分为pH=10.0甘氨酸-氢氧化钠缓冲液(20mmol/L),内含100μmol/L巯基乙醇、0.5%Triton X-100、0.5mol/L尿素、1mol/L氯化钠和2.5mmol/L EDTA。
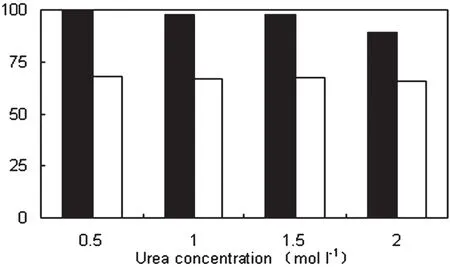
图4 尿素浓度对包涵体洗涤收率和纯度的影响
2.4 洗涤次数对包涵体洗涤效果的影响
采用上述优化后的洗涤液配方洗涤包涵体,并考察了洗涤次数对包涵体纯度和收率的影响,结果如图5、图6所示。从图中可以看出,当洗涤次数从1次增加到3次时,包涵体的纯度并没有明显增加,继续增加洗涤次数,包涵体的纯度有了明显的提高;洗涤4次和洗涤5次相比,包涵体纯度变化不大(从83.9%增加到85.6%),而目标蛋白的损失增加(94%降低到83%)。由此确定最佳洗涤次数为4次。

图5 洗涤次数对包涵体洗涤的影响

图6 洗涤次数对包涵体洗涤收率和纯度的影响
3 结论
经过优化的洗涤液配方4次洗涤后,包涵体的纯度达到85%左右,整体的回收率达到80%以上。将洗涤后的精制包涵体溶解于8mol/L尿素中,溶解后的最大蛋白浓度约为4mg/mL,目标蛋白的回收率大于95%。
[1]郑文云,马兴元,魏东芝,等.重组HIV-TATm-Survivin(T34A)蛋白制备及其促癌细胞凋亡活性研究[J].生物工程学报,2006,22(2):285-292.
[2]Ma X,Zheng W,Wei DZ,et al.Construction,expression,and purification of HIV-TAT-survivin (T34A) mutant:a pro-apoptosis protein in Escherichia coli[J].Protein Expr Purif,2006,47(1):36-44.
[3]方敏,黄华樑.包涵体蛋白体外复性的研究进展[J].生物工程学报,2001,17(6):608-612.
[4]王增,马会勤,张文,等.包涵体蛋白的分离和色谱法体外复性纯化研究进展[J].中国生物工程杂志,2009,29(7):102-107.
[5]Haiyi Zhang,Yu Zheng,Qinghai Liu,et al.Development of a fed-batch process for the production of anticancer drug TATm-survivin(T34A)in Escherichia coli[J].Biochemical Engineering Journal,2009,43(2):163-168.
[6]Bradford MM.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72:248-254.
Effect of washing conditions on the purity of recombinant TATm-survivin(T34A)inclusion bodies
Zhang Hai-yi
(Weihai Vocational College,Shandong Weihai 264210)
objective:To determine the washing condition of recombinant TATm-survivin(T34A) inclusion bodies(Ibs).Methods:RecombinantEscherichia colicells obtained from the fed-batch fermentation were disrupted.The crude inclusion bodies were harvested.Different washing conditions were tested to explore the effect on Ibs wash,which included pH,chemical substances,urea concentrations and washing times.Results:The optimal washing condition was determined.The Ibs purgation buffer (20mmol/L glycine-sodium hydroxide buffer of pH 10.0) contained 100μmol/L mercaptoethanol,0.5%Triton X-100,0.5mol/L urea,1mol/L sodium chloride and 2.5mmol/L EDTA.The washing time was optimized to be four.Conclusions:After Ibs wash with the optimal condition,the Ibs purity is calculated to about 85% with a yield of above 80%.
Recombinant TATm-survivin(T34A);Inclusion bodies;Washing conditions
Q81 文献标志码:A
2096-0387(2017)06-0018-04
张海毅(1980—),女,山东威海人,博士,讲师,研究方向:蛋白质的表达与纯化。

