肌肉钙黏蛋白突变体构建和细胞内定位分析
刘燕,冯利兴
(1.复旦大学生命科学学院,上海 200433;2.华东师范大学化学与分子工程学院,上海 200241)
肌肉钙黏蛋白突变体构建和细胞内定位分析
刘燕1,冯利兴2*
(1.复旦大学生命科学学院,上海 200433;2.华东师范大学化学与分子工程学院,上海 200241)
为研究肌肉钙黏蛋白(M-cadherin)三个钙离子结合位点对肌肉钙黏蛋白在细胞内定位的影响,以鼠肌肉钙黏蛋白基因及其钙离子结合位点突变序列为模板,利用PCR技术将其扩增后插入pEGFP-N1载体,使其与绿色荧光蛋白(GFP)融合表达。转染HEK293细胞后,Western Blot检测蛋白的表达,激光共聚焦显微镜观察肌肉钙黏蛋白及不同钙离子结合位点突变体在HEK293细胞中的定位。结果显示,肌肉钙黏蛋白三个钙离子结合位点分别突变之后,第二个钙离子结合位点突变会导致肌肉钙黏蛋白细胞内定位发生改变,使蛋白在细胞内的分布发生改变。该研究为深入研究肌肉钙黏蛋白的结构和功能提供了基础 。
肌肉钙黏蛋白;钙离子结合位点;细胞内定位
钙黏蛋白是一类钙离子依赖的介导细胞间黏附的跨膜糖蛋白,介导钙离子依赖的细胞间黏附。肌肉钙黏蛋白(M-cadherin)主要表达于骨骼肌细胞中[1],故而命名为肌肉钙黏蛋白。它表达于发育中的骨骼肌、二次肌生成等[2-3],此外,也发现在肌肉神经接点、肌肉神经和中枢神经系统的两个区域,即脊髓和小脑中也有表达[4-5]。从结构上看,肌肉钙黏蛋白与其他钙黏蛋白一样,主要由胞外、跨膜及胞内肽段三部分组成。氮端的胞外结构域介导亲同性结合,胞内肽段即胞质内的尾巴部分与连环蛋白结合,继而与肌动蛋白连接于细胞骨架上,因此与胞外结构域耦联介导动态的细胞内张力[6]。
细胞黏附蛋白影响细胞的形状、极性、细胞骨架形成、细胞运动、增殖、细胞存活、细胞分化、细胞结构的完整性及功能[7-8]。肌肉钙黏蛋白作为一种黏附蛋白,可以与胞内的连环蛋白形成两种类型的复合物[9]:一种是钙黏蛋白-连环蛋白复合物与细胞骨架相连,特别是肌动纤维系统[10];另一种是肌肉钙黏蛋白-连环蛋白复合物与微管相互作用,这是一种成肌细胞特异性行为[11]。
因为钙黏蛋白是依赖钙离子发挥功能,所以研究者们普遍认为在钙黏蛋白的胞外段是存在钙离子结合位点的。研究发现,钙黏素家族的蛋白都至少有一个或多个钙黏素重复序列 。一个钙黏素重复序列是一个独立的折叠序列,这个序列约有110个氨基酸,在这110个氨基酸中具有保守序列的模序,这些保守序列分别是天冬氨酸-精氨酸-谷氨酸(DRE)、天冬氨酸-X-天冬酰胺-天冬氨酸-天冬酰胺-丙氨酸-脯氨酸-X-苯丙氨酸(DXNDNAPXF,X代表任意氨基酸)和天冬氨酸-X-天冬氨酸(DXD)[12],钙黏蛋白通过这些模序来结合钙离子。在肌肉钙黏蛋白中也存在这样的钙离子结合模序,从其氨基酸序列推测,肌肉钙黏蛋白的胞外结构域含有三个钙离子结合位点。
目前,人们对肌肉钙黏蛋白的结构和功能的了解并不深入。比对发现人和鼠的肌肉钙黏蛋白的保守性达到86%,其中钙离子结合模序完全保守。鉴于钙离子结合位点的重要性及保守性,在本文中,笔者构建了鼠肌肉钙黏蛋白及三个钙离子结合位点与绿色荧光蛋白融合表达的突变质粒,通过观察肌肉钙黏蛋白在HEK293细胞内的定位试图找到对肌肉钙黏蛋白细胞内定位影响最大的钙离子结合位点,为深入研究肌肉钙黏蛋白的功能和结构提供基础。
1 材料与方法
1.1 细胞及试剂
HEK293由本实验室提供;pEGFP-N1载体由本实验室保存;KOD plus DNA聚合酶购自TOYOBO公司;限制性内切酶包括NheI、KpnI,T4 DNA Ligase均购自NEB公司;鼠抗M-cadherin 单抗购自美国Millipore公司;兔抗GFP单抗购自美国CST公司;辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG和山羊抗鼠IgG(二抗)均购自北京中杉金桥生物技术有限公司;琼脂糖凝胶纯化回收试剂盒、DNA产物纯化试剂盒、质粒小量快速提取试剂盒、1kb plus DNA ladder均购自天根生化科技有限公司;DH5α感受态细胞由实验室制备,DMEM高糖培养基和胎牛血清(fetal bovineserum,FBS)均购自美国Gibco公司;细胞裂解液(20mM HEPES,pH7.6,0.5mM EDTA,pH8.0,20%甘油,100mM KCl,0.5% Tween20);免疫印迹显色试剂盒购自美国的Thermo fisher scientific公司。
1.2 实验方法
1.2.1 PCR扩增反应
以本实验室保存的质粒为模板,第一个钙离子结合位点为55、56、110、112、143、145、146位氨基酸,第二个钙离子结合位点为第162、163、218、220、251、253、254位氨基酸,第三个钙离子结合位点为第270、328、330、367、369、370位氨基酸,突变钙离子结合位点的两到三处氨基酸序列。设计1对引物扩增目的基因。上游F:5'-CGGCTAGCCTAGC GAATTCCCTCTATGGGTTC-3',下 游 R:5'-GGGGT ACCGACTGATGTCCATACATGTCCGCC-3';反 应 条件:94℃ 30s,58℃ 30s,68℃ 3min,扩增30个循环;68℃延伸10 min。使用DNA产物纯化回收试剂盒回收PCR产物。
1.2.2 质粒的构建及鉴定
将回收的PCR产物与pEGFP-N1载体用Nhe I和Kpn I进行双酶切。回收载体和插入片段后进行连接反应,连接产物转化入DH5α感受态细胞中,挑选单克隆,扩大培养,提取质粒,酶切鉴定,将测序正确的扩大培养,提取DNA质粒待用。
1.2.3 HEK293细胞转染
将预先培养的HEK293细胞接种于六孔板,待长至密度为70%左右,进行转染。每个孔取4μg质粒,加入96μL水;取 100μL 2×CaCl2混匀,200μL 2× HBS逐滴加入到混合液体中,总体积为400μL。室温静置30min后,加入含1.5mL 10%血清的新鲜DMEM培养液的六孔板中,在5%CO2、37℃恒温培养箱中培养48h,同时设置阴性对照。
1.2.4 Western Blot
收集转染了pEGFP-N1 空载体和pEGFPN1-M-cadherin、pEGFP-N1-M-cadherin-mut1、pEGFP-N1-M-cadherin-mut2、pEGFP-N1-M-cadherin-mut3重组质粒以及未转染的细胞,裂解细胞提取蛋白,加入5×SDS上样缓冲液沸水煮10min。配制10%聚丙烯酰胺凝胶,每孔20μL蛋白裂解液,120V恒压电泳2h,90V恒压转膜2h,用TBST配制的5%脱脂牛奶封闭膜1h,分别加入M-cadherin抗体(1∶1 000)、GFP抗体(1∶2 000),4℃孵育过夜,TBST洗3次,每次10min。加入1∶10 000稀释二抗,室温孵育1h,TBST洗3次,每次10min。LAS4000冷光/生物发光影像分析仪显色。
1.2.5 激光共聚焦显微镜观察
接种HEK293细胞至六孔板,细胞爬片生长24h后,细胞密度约为60%,将pEGFP-N1空载体和 pEGFP-N1-M-cadherin、pEGFP-N1-M-cadherinmut1、pEGFP-N1-M-cadherin-mut2、pEGFP-N1-M-cadherin-mut3重组质粒分别进行转染,每孔转染质粒总量为4μg。48h后,4%多聚甲醛固定,4℃过夜。PBS洗3次,每次5min。DAPI用PBS按1∶1 000稀释,对细胞核进行染色5 min,PBS洗3次,每次5 min。封片剂封片,激光共聚焦显微镜(Leica TCS SP5)下观察。
2 结果
2.1 肌肉钙黏蛋白结构域划分以及质粒构建策略
肌肉钙黏蛋白(M-cadherin)是一个跨膜糖蛋白,分为4个部分:信号肽、胞外段(EC)、跨膜区域(TM)以及胞内段(CP)。其中,胞外段又可分为 5个区域,即EC1、EC2、EC3、EC4、EC5(见图1a)。将M-cadherin及其钙离子结合位点突变体克隆到载体pEGFP-N1中,构建策略见图1b。M-cadherin有三个钙离子结合模序,分别把三个钙离子结合模序天冬氨酸-精氨酸-谷氨酸(DRE)模序、天冬氨酸-X-天冬酰胺-天冬氨酸-天冬酰胺-丙氨酸-脯氨酸-X-苯丙氨酸(DXNDNAPXF,X代表任意氨基酸)模序和天冬氨酸-X-天冬氨酸(DXD,X代表任意氨基酸)模序突变为丝氨酸-丙氨酸-苏氨酸(SAT)模序,突变序列以及突变位置见图1c。

图1 重组质粒构建策略
2.2 pEGFP-N1-M-cadherin及其钙离子结合位点突变体质粒的构建
构建pEGFP-N1-M-cadherin及其钙离子结合位点突变质粒pEGFP-N1-M-cadherin-mut1、pEGFP-N1-M-cadherin-mut2、pEGFP-N1-M-cadherin-mut3,经双酶切,1%琼脂糖电泳初步鉴定,证明肌肉钙黏蛋白(M-cadherin)及其钙离子结合位点突变序列成功装入载体,见图2。重组质粒经测序分析,证实肌肉钙黏蛋白序列及3个钙离子结合位点序列均正确,插入方向和碱基序列均正确。

图2 酶切鉴定重组质粒结果
2.3 肌肉钙黏蛋白及其钙离子结合位点突变质粒的过表达
肌肉钙黏蛋白的表达具有组织特异性,HEK293细胞本身不表达肌肉钙黏蛋白。将构建的重组质粒转入HEK293细胞中,使肌肉钙黏蛋白与绿色荧光蛋白融合表达,通过绿色荧光蛋白的表达可检测肌肉钙黏蛋白的表达。收集细胞,抽提蛋白,Western Blot检测肌肉钙黏蛋白过表达情况,同时以空载体pEGFP-N1为阴性对照。结果显示,肌肉钙黏蛋白抗体检测到的蛋白大小与绿色荧光蛋白抗体检测到的大小一致,均为150kD(如图3),表明构建的质粒在HEK293中成功融合表达了肌肉钙黏蛋白与绿色荧光蛋白及钙离子结合位点突变蛋白与绿色荧光蛋白。

图3 Western Blot检测肌肉钙黏蛋白及钙离子结合位点突变蛋白在HEK293中的表达
2.4 激光共聚焦显微镜观察肌肉钙黏蛋白及钙离子结合位点突变体蛋白的表达与定位
将制作好的样本在显微镜下观察,可以明显观察到肌肉钙黏蛋白主要集中于细胞膜,在细胞质内也有表达,但主要集中于靠近细胞膜的一点,呈现极性。第一个和第三个钙离子结合位点突变的蛋白与未突变的肌肉钙黏细胞内定位极为相似;第二个钙离子结合位点突变的蛋白也定位于细胞膜上,但胞质内的定位呈散在分布,失去极性,而pEGFP-N1是全细胞表达,见图4。
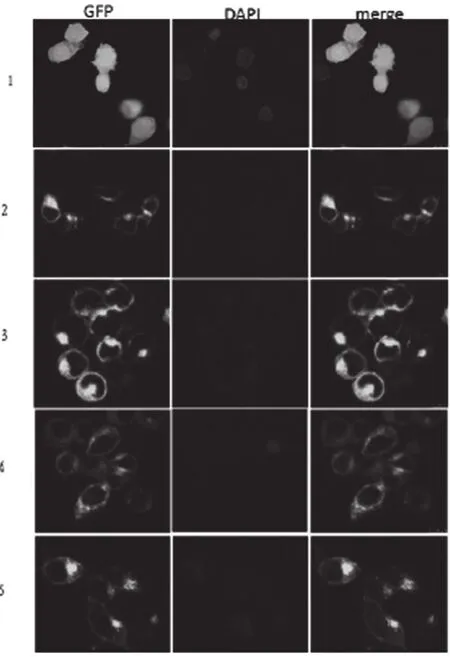
图4 肌肉钙黏蛋白(M-cadherin)及其钙离子结合位点突变蛋白细胞内定位
3 结论
本文成功构建了肌肉钙黏蛋白及其钙离子结合位点突变重组质粒,利用其与绿色荧光(GFP)融合表达,在本身不表达该蛋白的HEK293细胞中过表达该蛋白及其突变体蛋白,直观地观察到肌肉钙黏蛋白在细胞内的分布和定位情况。发现它们均能定位在细胞膜上,但除了在细胞膜上定位之外,有一部分蛋白在细胞质内呈簇聚集,这可能与该蛋白在不同发育时期,不同细胞内定位相关。并发现肌肉钙黏蛋白(M-cadherin)的第二个钙离子结合位点的突变对其定位产生了影响,主要表现在蛋白不呈簇聚集。第一个和第三个钙离子结合位点的突变对肌肉钙黏蛋白的定位均无影响。这证明了第二个钙离子结合位点可能是维持肌肉钙黏蛋白刚性的一个极其重要的位点。,为深入研究肌肉钙黏蛋白的结构和功能奠定了基础和提供了可能。
[1]Donalies M,Cramer M,Ringwald M,et al.Expression of M-cadherin,a member of the cadherin multigene family,correlates with differentiation of skeletal muscle cells[J].Proc Natl Acad Sci,1991,88:8024-8028.
[2]Hazan RB,Norton L.The epidermal growth factor receptor modulates the interaction of E-cadherin with the actin cytoskeleton[J].J Biol Chem.1998,273(15):9078-9084.
[3]Kaupmann K,Becker-Follmann J,Scherer G,et al.The gene for the cell adhesion molecule M-cadherin maps to mouse chromosome 8 and human chromosome 16q24.1-qter and is near the E-cadherin(uvomorulin) locus in both species[J].Genomics,1992,14(2):488-490.
[4]Koch AW,Bozic D,Pertz O,et al.Homophilic adhesion by cadherins[J].Curr Opin Struct Biol,1999,9(2):275-281.
[5]CifuentesDiaz C,Goudou D,Padilla F,et al.M-cadherin distribution in the mouse adult neuromuscular system suggests a role in muscle innervation[J].European Journal of Neuroscience,1996,8(8):1666-1676.
[6]Kuch C,Winnekendonk D,Butz S,et al.M-cadherin-mediated cell adhesion and complex formation with the catenins in myogenic mouse cells[J].Exp Cell Res,1997,232(2):331-338.
[7]Moore R,Walsh FS.The cell adhesion molecule M-cadherin is specifically expressed in developing and regenerating,but not denervated skeletal muscle[J].Development,1993,117(4):1409-1420.
[8]Nagafuchi A,Takeichi M.Cell binding function of E-cadherin is regulated by the cytoplasmic domain[J].EMBO J.,1988,7(12):3679-3684.
[9]Nagar B,Overduin M,Ikura M,et al.Structural basis of calciuminduced E-cadherin rigidification and dimerization[J].Nature,1996,380(6572):360-364.
[10]Nose A,Tsuji K,Takeichi M.Localization of specificity determining sites in cadherin cell adhesion molecules[J].Cell,1990,61(1):147-155.
[11]Ozawa M,Engel J,Kemler R.Single amino acid substitutions in one Ca2+binding site of uvomorulin abolish the adhesive function[J].Cell,1990,63(5):1033-1038.
[12]Pokutta S,Herrenknecht K,Kemler R,et al.Conformational changes of the recombinant extracellular domain of E-cadherin upon calcium binding[J].Eur J Biochem,1994,223(3):1019-1026.
Construction of M-cadherin and its Calcium Binding Sites Mutations and Analysis of Their Intracellular Localization
Liu Yan1,Feng Li-xing2*
(1.School of Life Sciences,Fudan University,Shanghai 200433;2.School of Chemistry and Molecular Engineering,ECNU,Shanghai 200241)
In order to study effect of the three calcium binding sites of M-cadherin on intracellular localization,M-cadherin and its mutations was used as template,the M-cadherin and its mutations coding sequence were amplified by PCR and respectively inserted into the vector pEGFP-N1,they fusion expressed with EGFP.The expression in HEK293 was detected by western blot and localization of EGFP fusion expression was observed by laser scanning confocal microscopy.The results showed that three different calcium binding sites were mutated separately,the second one can cause M-cadherin intracellular localization changed,then changed the intracellular pattern of the protein.This study provides the foundation for further study the function and structure of M-cadherin.
M-cadherin;Calcium binding sites;Intracellular localization
Q78 文献标志码:A
2096-0387(2017)06-0024-05
国家自然科学基金(81373964);上海市科委科技创新行动计划(15140904800)。
刘燕(1987—),女,四川广元人,硕士在读,研究方向:成体肌肉干细胞的命运决定。
冯利兴(1983—),男,河北邯郸人,硕士,助理研究员,研究方向:药理学和蛋白质组学。

