酵母型生物絮凝剂产生菌的筛选及培养基优化
陈成,钟雨雪,夏祥,邱成书,陈存,谢翼飞*
(1.成都师范学院化学与生命科学学院,四川成都611130;2.中国科学院成都生物研究所,四川成都610041)
酵母型生物絮凝剂产生菌的筛选及培养基优化
陈成1,钟雨雪1,夏祥2,邱成书1,陈存1,谢翼飞2*
(1.成都师范学院化学与生命科学学院,四川成都611130;2.中国科学院成都生物研究所,四川成都610041)
目的:获得高效的酵母菌型絮凝剂。方法:以代表性的高岭土悬浊液、养殖场废水、土壤上清液、藻液、硫酸铜溶液、发酵废水作为测试废水,筛选具有絮凝活性的菌种。结果:筛选出3株具有絮凝活性的菌种,其中酵母1-4絮凝效果较好且适用范围较广;对酵母1-4菌培养基的碳源、氮源、碳氮比进行优化,确定最适碳源为甘露醇,最适氮源为氯化铵,碳氮比5∶1为最佳。结论:用醇降法提取优化培养所得的絮凝剂,产率为5.0g/L,经紫外吸收光谱和茚三酮反应初步判断絮凝剂的主要成分为蛋白质。
酵母菌;生物絮凝剂;高岭土悬浊液;培养基优化
生物絮凝剂是一类天然高分子絮凝剂,是通过微生物发酵、分离提取而得到的一种高效、无毒且易降解的新型污水处理剂[1]。与传统絮凝剂相比,具有安全性高、生物降解性良好、易于固液分离、无二次污染、用量少等优点[2-5],能快速絮凝各种颗粒物质,广泛用于去除水体中的悬浮物质[6]、COD[7]、重金属[8-9]、腐殖酸[10]等,在废水脱色、高浓度有机物去除等方面效果显著[11-13],有着很大的研究价值和应用前景。
我国对生物絮凝剂的研究起步相对较晚,目前多数处于菌种的筛选阶段。虽然生物絮凝剂在水处理方面有着突出的优越性,但从规模化生产和应用角度来看,还存在着一系列亟待解决的问题,如高效絮凝剂产生菌的筛选和培育、絮凝活性的提高、寻找廉价的培养基等。研究发现,能够产生絮凝剂的微生物种类繁多,包括细菌、放线菌、真菌、霉菌、酵母菌和某些藻类等[14],但现有的研究以细菌为主,对酵母型生物絮凝剂研究相对较少。不同菌种产生的絮凝成分差别较大,而不同的培养条件也会对絮凝效果和产量产生较大的影响。本文以酵母型絮凝剂产生菌为研究对象,在筛选生物絮凝剂产生菌株的基础上,采用高岭土悬浊液模拟待处理的废水,对高活性菌株的培养基进行优化,力求获得高效高产量的酵母型产絮菌及培养条件。
1 材料与方法
1.1 材料与试剂
无水乙醇(AR,上海精细化工试剂有限公司)、酵母膏(BR,北京奥博星生物)、胰蛋白胨(BR,北京奥博星生物)、YPD培养基(BR,北京奥博星生物)、CuSO4(AR,天津美琳),其余试剂皆购于天津市科密欧化学试剂有限公司,纯度为分析纯。
1.2 仪器与设备
高速离心机:蜀科TG-16;电子天平:梅特勒-托利多A1-104;六联搅拌器:磁力数显控温搅拌器HJ-6A;电热恒温培养箱:DHP-600;恒温振荡器:IS-R0V1;pH计:雷磁PHB-4;双光束紫外可见分光光度计:普析TU-1901。
1.3 方法
1.3.1 高效酵母型生物絮凝剂产生菌的筛选
YPD培养基:酵母膏10g、蛋白胨20g、葡萄糖20g、琼脂粉 20g、H2O 1 000mL,115℃灭菌 30min。
发酵培养基:葡萄糖20.0g、蛋白胨0.5g、酵母膏 0.5g、(NH4)2SO40.2g、K2HPO45.0g、KH2PO42.0g、MgSO40.2g、NaCl0.1g、1 000mL,pH=8.0,115 ℃ 灭菌30min。
种子培养基:蛋白胨5.0g、酵母膏15.0g、氯化钠4.0g、葡萄糖 10.0g、H2O 1 000mL、pH=7.0,115℃灭菌30min。
将实验室保存的酵母菌种接种到YPD培养基,28℃恒温活化培养10h后接种到50mL液体发酵培养基,28℃、180r/min振荡培养24h。向6个烧杯中分别加入高岭土悬浊液、养殖场废水、CuSO4溶液、发酵废水、藻液、土壤上清液各20mL,再分别加入0.2mL发酵液,1mL1%CaCl2,快速搅拌1min,慢速搅拌4min,观察絮凝效果。
1.3.2 培养基优化
(1)碳源优化。分别以淀粉、甘露醇、柠檬酸、柠檬酸钠、葡萄糖作为碳源,将菌种接入种子培养基,28℃180r/min恒温振荡培养10h。取菌液接种到发酵培养基培养24h后,以20mL高岭土悬浊液为测试液,加入1mLCaCl2混匀后静置10min,测定上清液在550nm下的吸光度(OD550)。将菌液稀释10倍后,测定其在600nm下的吸光度(OD600)。
(2)氮源优化。分别以(NH4)2SO4、尿素、酵母膏、酵母膏尿素混合物、NH4Cl作为氮源,在碳源最优条件下,其余操作同上。
(3)碳氮比优化。调节C/N比分别为10∶1、5∶1、1∶1、1∶5、1∶10进行发酵培养,在碳源、氮源最优条件下,其余操作同上。
1.3.3 絮凝剂成分的分析
向150mL预冷的无水乙醇中加入50mL发酵液,于-4℃条件下静置8h,6 000r/min离心20min,弃去上清液,将沉淀放于烘箱中用40℃烘干至恒重。所得絮凝剂用紫外可见分光光度计扫描其吸收光谱。
2 结果与讨论
2.1 高效酵母型絮凝剂产生菌的筛选
实验分离纯化出酵母型菌株20株,以高岭土悬浊液、养殖场废水、CuSO4溶液、发酵废水、藻液、土壤上清液6种代表性废水做筛选,选出的菌种絮凝效果实用性与适用性比单一废水筛选更强。实验结果见表1。酵母1-4、酵母1-7、酵母1-8有明显的絮凝活性,三者絮凝情况对比如图1所示。可以看出,酵母1-4菌对土壤上清液、藻液、高岭土悬浊液等都有明显的效果,适用范围较广,且絮凝效果优于酵母1-7与酵母1-8。
2.2 培养基优化
以絮凝效果最好的酵母1-4菌为菌种优化发酵培养基配方。碳源优化结果见表2,OD550越小上清液越澄清,发酵液絮凝效果越好,OD600数值越高表明发酵液中菌种生长状况越好。以甘露醇作为碳源,OD550数值最低,絮凝效果最好,其OD600数值仅次于葡萄糖,菌种生长状况较好。因而,兼顾絮凝效果与菌种生长情况,确定甘露醇为最适碳源。
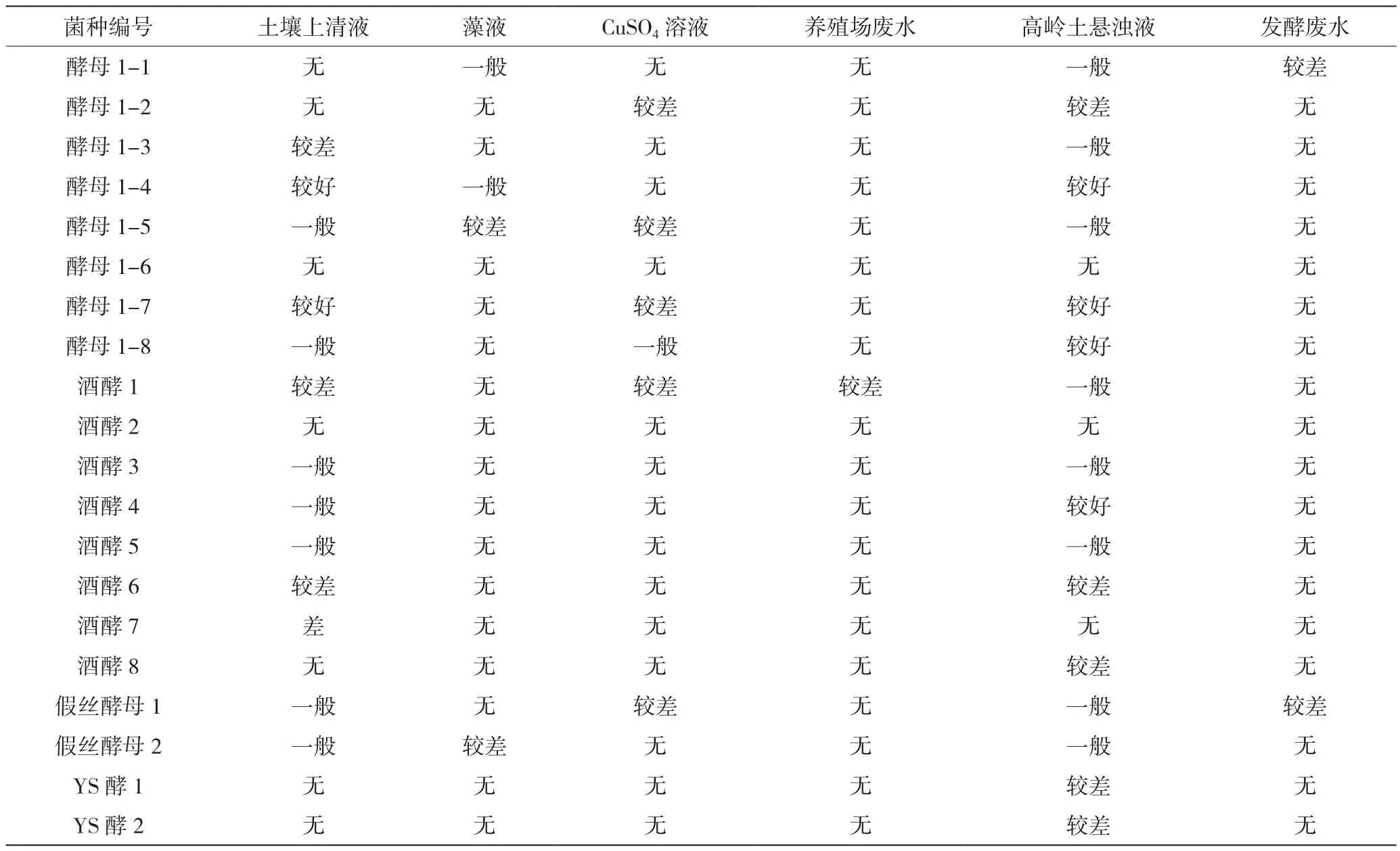
表1 菌株絮凝效果

图1 三株酵母菌的絮凝效果
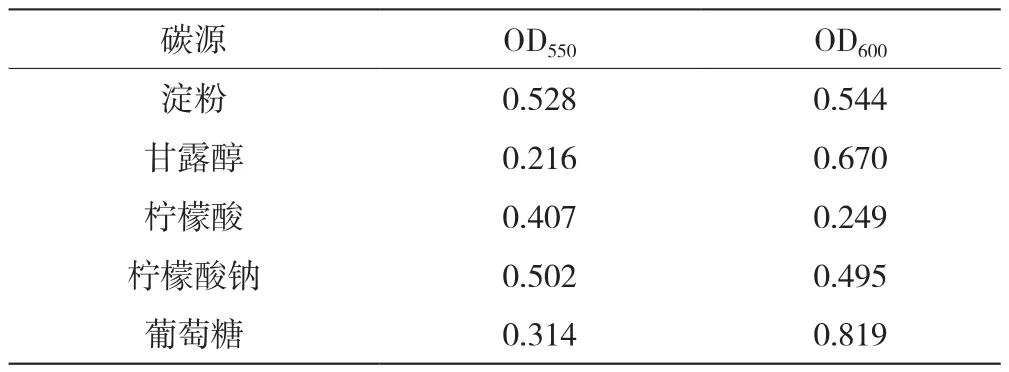
表2 碳源优化结果
以甘露醇作为碳源,(NH4)2SO4、尿素、酵母膏、酵母膏尿素混合物、NH4Cl作为氮源,絮凝效果和菌种生长情况见表3。以NH4Cl作为培养基氮源,测得OD550最低,絮凝效果最好,OD600数值最高,菌种生长状况最好。因而确定NH4Cl作为最佳氮源。
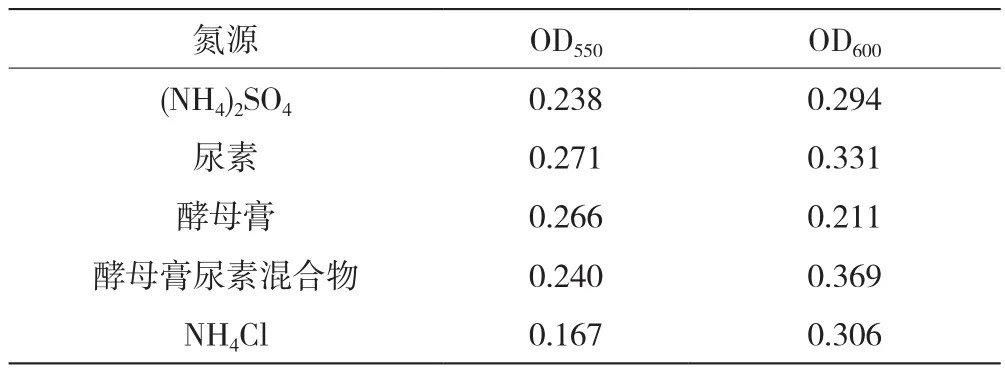
表3 氮源优化结果
在碳源为甘露醇,氮源为NH4Cl的条件下,优化培养基的碳氮比,测得OD550、OD600值见表4。比较可得当碳氮比为5∶1时,OD550最低,OD600最高,絮凝效果最好且菌种生长状况最好。故优化后的发酵培养基的碳源为甘露醇,氮源为NH4Cl,碳氮比为5∶1。
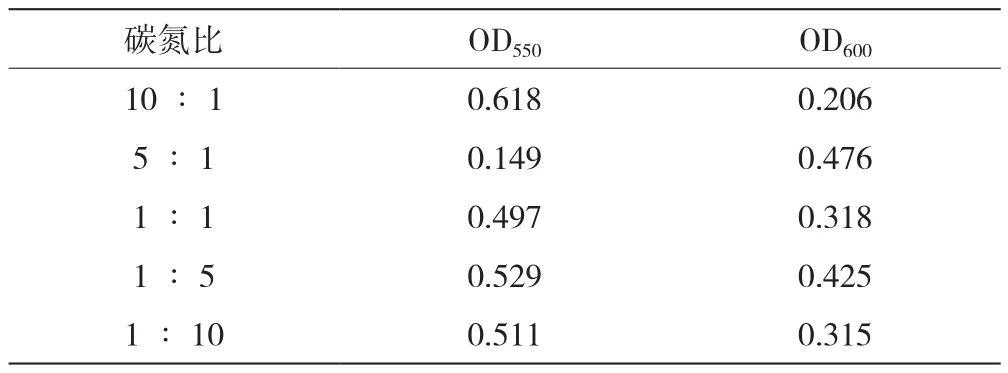
表4 碳氮比优化结果
2.3 絮凝剂成分的初步鉴定
采用醇降法分离提取优化培养24h的酵母1-4菌所产出的絮凝剂,测得产量为每50mL发酵液0.25g。利用紫外可见分光光度计测得絮凝剂于260nm处有吸收峰,茚三酮反应呈紫色,可初步确定酵母1-4菌株产生的絮凝剂主要成分为蛋白质。
3 结论
从实验室保藏菌种中分离纯化出的20株酵母菌,并筛选出3株具有较好絮凝效果的酵母菌,即酵母1-4、酵母1-7、酵母1-8,其中酵母1-4絮凝效果最优且适用范围更广。以酵母1-4菌为菌种优化发酵培养基配方,考虑絮凝效果与菌种生长情况下,优化后发酵培养基的碳源为甘露醇,氮源为NH4Cl,碳氮比为5∶1。采用醇降法分离提取酵母1-4产出的絮凝剂,产量为每50mL发酵液0.25g。利用紫外可见分光光度计测得絮凝剂于260nm处有吸收峰,且茚三酮反应呈紫色,证明絮凝剂主要成分为蛋白质。
[1]何宁,李寅,陈坚,等.生物絮凝剂的最新研究进展及其应用[J].微生物学通报,2005,32(2):104-108.
[2]Nakamura J,Miyashiro S,Hirose Y. Purification and chemicalanalysis of microbial cell flocculant produced by Aspergillus sojae AJ7002[J]. Agricultural and Biological Chemistry,1976,40(3):619-624.
[3]H.Salehizadeh,M.Vossouhi,LAlemzadeh.Some investigations on bioflocculant production bacteria[J].Biochemical Engineering Journal,2000,5(1):39-44.
[4]H Salehizadeh,SAShojaosadati.Extracellular biopolymeric flocculants recent trends and biotechnological importance[J].Biotechnology Advances,2001,19(5):371-385.
[5]孙秀娟,刘均洪,焦绪栋,等.一株海水藻类培养液的絮凝活性及机理分析[J].安徽农业科学,2013,41(1):281-283.
[6]杨开,康健雄,张永波,等.微生物絮凝剂用于污水强化一级处理[J].中国给水排水,2002,18(2):43-45.
[7]宫小燕,王曙光,栾兆坤,等.微生物絮凝剂产生菌的筛选和优化以及在水处理中的应用[J].应用与环境生物学报,2003,9(2):196-199.
[8]邵颖,叶玉汉.聚合铝-壳聚糖复合絮凝剂的絮凝性能及其在重金属废水中的应用[J].宁波大学学报(理工版),2002,15(1):83-85.
[9]朱恋,王熳,张灿,等.多糖生物絮凝剂在酸性煤矿废水处理中的应用[J].给水排水,2013(s1):327-330.
[10]Salehizade H,Shojaosadati S A.Isolation and characterization of a bioflocculant produced by Bacillus firmus[J].Biotechnology letters,2002,24(1):35-40.
[11]朱晓江,尹双凤,桑军强.微生物絮凝剂的研究和应用[J].中国给水排水,2001,17(6):19-22.
[12]任宏洋,王新惠,刘达玉.复合菌利用酱油废液制备生物絮凝剂及其絮凝特性分析[J].中国环境科学,2010,30(8):1050-1055.
[13]赵起政,路宏科,彭涛.马铃薯淀粉废水高活性絮凝菌的分离鉴定[J].中国酿造,2015,34(2):76-81.
[14]刘金亮,姜彬慧,赵鑫.一株高效絮凝剂产生菌的分离和鉴定[J].东北大学学报(自然科学版),2016,37(5):706-710.
Screening and Medium Optimization of High-efficiency Flocculant-producing Yeast
Chen Cheng1,Zhong Yu-xue1,Xia Xiang2,Qiu Cheng-shu1,Chen Cun1,Xie Yi-fei2*
(1.School of Chemistry and Life Science,Chengdu Normal University,Sichuan Chengdu 611130;2.Chengdu Institute of Biology,Chinese Academy of Sciences,Sichuan Chengdu 610041)
Objective:To obtain an efficient yeast flocculant.Methods:the flocculation activity test for kaolin suspension,farm wastewater,soil supernatant,algae solution,copper sulfate solution and fermentation wastewater.Results:Three flocculant-producing yeasts were screened,in whichYeast1-4 has the highest flocculation efficiency and could be applicable to for more kinds of wastewater.The medium constituents of Yeast1-4 was optimized and the results showed that,the optimum carbon source was mannitol,the optimum nitrogen source was ammonium chloride and the optimum C/N ratio was 5∶1.Conclusion:Under this conditions,the flocculantyield of Yeast1-4 is 5.0g/L.The main ingredient of flocculant is identified to be protein by UV spectroscopy andninhydrin reaction.
Yeast;Bioflocculant;Kaolin suspension;Medium optimization
X172 文献标志码:A
2096-0387(2017)06-009-04
四川省教育厅科研项目(17ZB0072);四川省大学生创新创业训练计划(107260127)。
陈成(1984—),女,四川南充人,博士在读,讲师,研究方向:水处理技术。
谢翼飞(1977—),男,江苏武进人,博士,副研究员,研究方向:环境微生物。

