应用无约束全身体积描记系统检测小鼠肺功能
赵 玮, 俞 冰, 张水娟, 贾永良, 谢强敏
(1. 浙江中医药大学附属第一医院, 浙江省中医院, 杭州 310006;2. 浙江中医药大学药学院, 杭州 310053; 3. 浙江大学呼吸药物研究实验室, 杭州 310058)
应用无约束全身体积描记系统检测小鼠肺功能
赵 玮1, 俞 冰2, 张水娟2, 贾永良3, 谢强敏3
(1. 浙江中医药大学附属第一医院, 浙江省中医院, 杭州 310006;2. 浙江中医药大学药学院, 杭州 310053; 3. 浙江大学呼吸药物研究实验室, 杭州 310058)
目的 建立Buxco无创肺功能仪检测小鼠哮喘模型肺功能的方法。方法 雌性ICR小鼠20只随机分为正常对照组和哮喘模型组,用卵白蛋白(OVA)氢氧化铝凝胶皮下多点注射加腹腔注射致敏小鼠和反复吸入抗原攻击建立哮喘模型。用乙酰甲胆碱(Mch)梯度浓度雾化吸入激发支气管收缩反应,Buxco无创肺功能仪检测和记录激发过程中呼吸常规指标和气道阻力参数-增强呼吸间歇(Penh)的变化。结果 与对照组比较,哮喘模型组小鼠随Mch激发的雾化吸入浓度增大呼吸频率(F)逐渐减慢、吸气时间(Ti)和呼气时间(Te)逐渐延长、Penh值显著增加。结论 Buxco无创肺功能仪检测Mch诱导的小鼠哮喘模型气道高反应性(AHR)呈现出良好的量效关系,是一个测定气道高反应的良好工具。
小鼠; 肺功能; 哮喘; 气道高反应性(AHR); 无创肺功能仪; 无约束全身体积描记
气道高反应性(airway hyperresponsiveness,AHR)、气道炎症和可逆的气道阻塞是支气管哮喘的特征[1]。AHR的发生与神经源性异常和气道炎症有关[2]。动物模型开发在研究AHR发生与发病机制方面提供了一个方法,那些不合适或不可能在患者身上执行的防治气道炎症和AHR的方法和受试药物可以通过这些动物模型来实现[3,4]。
目前虽然已有电刺激离体气管平滑肌收缩性,或通过静脉注射乙酰甲胆碱(Mch)或5-羟色胺诱导支气管收缩测定肺阻力和肺顺应性、或测量气道峰值开启压力等三种不同的测量小鼠气道功能改变的方法[5],但这些方法有其局限性,如整体试验中麻醉药物的影响,麻醉深浅和麻醉药物对AHR的神经源和气道炎症的影响,实验人员手术操作技术上的要求和耗时,麻醉或手术后动物存活困难不能长期跟踪研究等因素。无约束全身体积描记法(whole-body plethysmograph, WBP)可以对清醒自由活动的小动物进行肺功能及气道反应相关的测试,避免了创伤性气管切开术及麻醉的影响,使实验过程简便快捷,并适合长期跟踪研究[6]。本研究采用本实验室传统方法,使用卵白蛋白(OVA)加佐剂氢氧化铝凝胶皮下注射致敏小鼠和反复吸入抗原攻击建立哮喘模型[7]。用Mch梯度浓度雾化吸入激发支气管收缩反应,WBP系统(Buxco®)检测和记录激发过程中呼吸常规指标和气道阻力的变化。
1 材料与方法
1.1 实验动物
SPF级5周龄雌性ICR小鼠,体质量18~20 g,购自上海斯莱克实验动物有限公司[SCXK(沪)2012-0002],饲养于浙江大学实验动物中心SPF级动物设施[SYXK(浙)2012-0178],明暗各12 h,喂养常规饲料和高温高压灭菌水。
1.2 仪器
无约束全身体积描记系统(Non-invasive whole-body plethysmograph system, WBPs),购自美国Buxco Electronics, Inc. Troy, NY。系统包括: 全身体积描记器,相应数量的传感器,偏流仪(每台可供4只体描箱),雾化给药系统(每台可同时向8只体描箱给药),主控仪及安装在其插槽内的前置放大器和USB数模转换器,分析软件(FinePointe,Buxco原装工作软件,版本号: 2.3.1.0),及相关配件。带有温度和湿度探头的传感器,对实验时体描箱内的温度湿度进行精确测定,可大为提高潮气量等参数的精度。其特点为无须手术,动物清醒无约束,处于自然活动状态;实验结束后动物存活,是长期跟踪研究的理想实验方式; 可对多只动物同时测试,是进行筛选实验的最佳选择; 呼吸速率、潮气量、呼气峰值、吸气峰值以及代表气道阻力的参数-增强呼吸间歇(Penh)与经典肺功能测试结果具有高度相关性。Pari Boy N雾化器: 购自德国百瑞有限公司,雾化粒径平均中位直径(MMD) 3.5 μm,68%粒径<5μm。
1.3 药品
OVA(V级,美国Sigma公司,A5503-25G,批号: 076K7045)。Mch (美国Sigma公司,批号:MKBS3120V)。质量分数1%氢氧化铝凝胶: 自行制备。将OVA溶解到质量分数1%的氢氧化铝凝胶中,配成1g/L的OVA氢氧化铝凝胶溶液。
1.4 建立小鼠哮喘模型
20只小鼠随机分为2组,哮喘模型组小鼠注射1 g/L的OVA氢氧化铝凝胶溶液,两后脚掌、后腹股沟各注射0.025 mL; 颈部注射0.1 mL; 背部注射0.1 mL; 腹腔注射0.2 mL。首次注射后14日,腹腔注射相同浓度的OVA氢氧化铝胶溶液0.2 mL加强致敏。第21日开始抗原攻击,将致敏小鼠放置于密闭的有机玻璃盒内,用Pari Boy N雾化器雾化吸入10 g/L OVA生理盐水溶液30 min, 隔日1次,连续4周。正常对照组小鼠致敏和抗原攻击与模型组相同,以注射无菌生理盐水代替OVA和氢氧化铝胶溶液。在小鼠12周龄时测定肺功能。
1.5 无创肺功能检测
连接好WBPs (图 1)后,进行呼吸校准,校准过程中通过对密闭腔体内注入一定量的气体,对流量和压力进行校准。校准通过后,将4只清醒状态小鼠分别放进4个体描箱中,密闭,打开氧气阀,小鼠自主活动适应5 min。在此期间,打开电脑软件Finepointe,选择所需要的测定程序并创建文件夹、设置好程序中各步骤时间、测量参数、所需药物剂量等参数,并设置实验分组、组内编号。待小鼠适应期结束后开始记录小鼠呼吸的基础值,包括呼吸频率(F)、潮气量(TV)、分钟通气量(MV)、吸气时间(Ti)、呼气时间(Te)、吸气峰流速(PIF)、呼气峰流速(PEF)、呼吸中断(Tb)、呼气松弛时间(Tr, 即呼气相描记箱内压力衰减为最大压力的36%所用时间)、中期流速(EF50,呼气量达50%的流速)、呼吸间歇(Pause)和Penh,记录时间为3 min。FinePointe间隔2 s自动选取波形读出数据,实验结束后,可直接导出3min内的数据统计值。

图1 无约束全身体积描记系统Figure 1 Non-invasive whole-body plethysmograph system
1.6 支气管激发试验(BPT)
基础值测定完成后, 将配置成不同浓度的Mch溶液(0 g/L、0.78 g/L、1.56 g/L、3.125 g/L、6.25g/L、12.5 g/L、25 g/L)由低到高雾化吸入,时间为2min,反应、记录时间为3 min,恢复时间为1min。
1.7 统计学处理
Pause是一个计算值,Pause =(Te - Tr)/Tr; 代表气道阻力的Penh也是一个计算值,Penh = Pause×(PEF/PIF),具体测量和计算见图 2[5]。结果以(x- ± s)表示,用SPSS 18.0统计软件进行分析。同组小鼠BPT前后呼吸数据的比较采用配对t检验分析,而模型组和正常组小鼠之间的比较采用单因素方差分析,P<0.05表示差异具有统计学意义。
2 结果
2.1 BPT前后小鼠肺功能各测量值的变化
在应用Mch进行支气管激发试验的过程中, 随着Mch浓度的增加, 正常对照组和模型组小鼠均逐渐出现张口呼吸、呼吸变慢、幅度加深、出现腹式呼吸等, 呼吸波形随之改变, 模型组小鼠呼吸波变化更为明显(图 3)。激发试验后(图4), 模型组小鼠的肺功能测定值中Penh、EF50、TV、Pause值较正常对照组小鼠有明显上升(P<0.05), 其他数值无明显变化。正常对照组小鼠用Mch进行激发前后比较, Penh、EF50、Pause和PEF值明显升高(P<0.05或P<0.01), Tr值则明显降低(P<0.05),其余肺功能测定值均无明显变化。而哮喘模型组小鼠除MV、PIF无明显变化外, 其余肺功能测定值均有显著变化,其中Penh、EF50、TV、Pause、PEF、Te和Ti值明显升高(P<0.05或P<0.01), F、Tr和Tb值明显降低(P<0.01)。
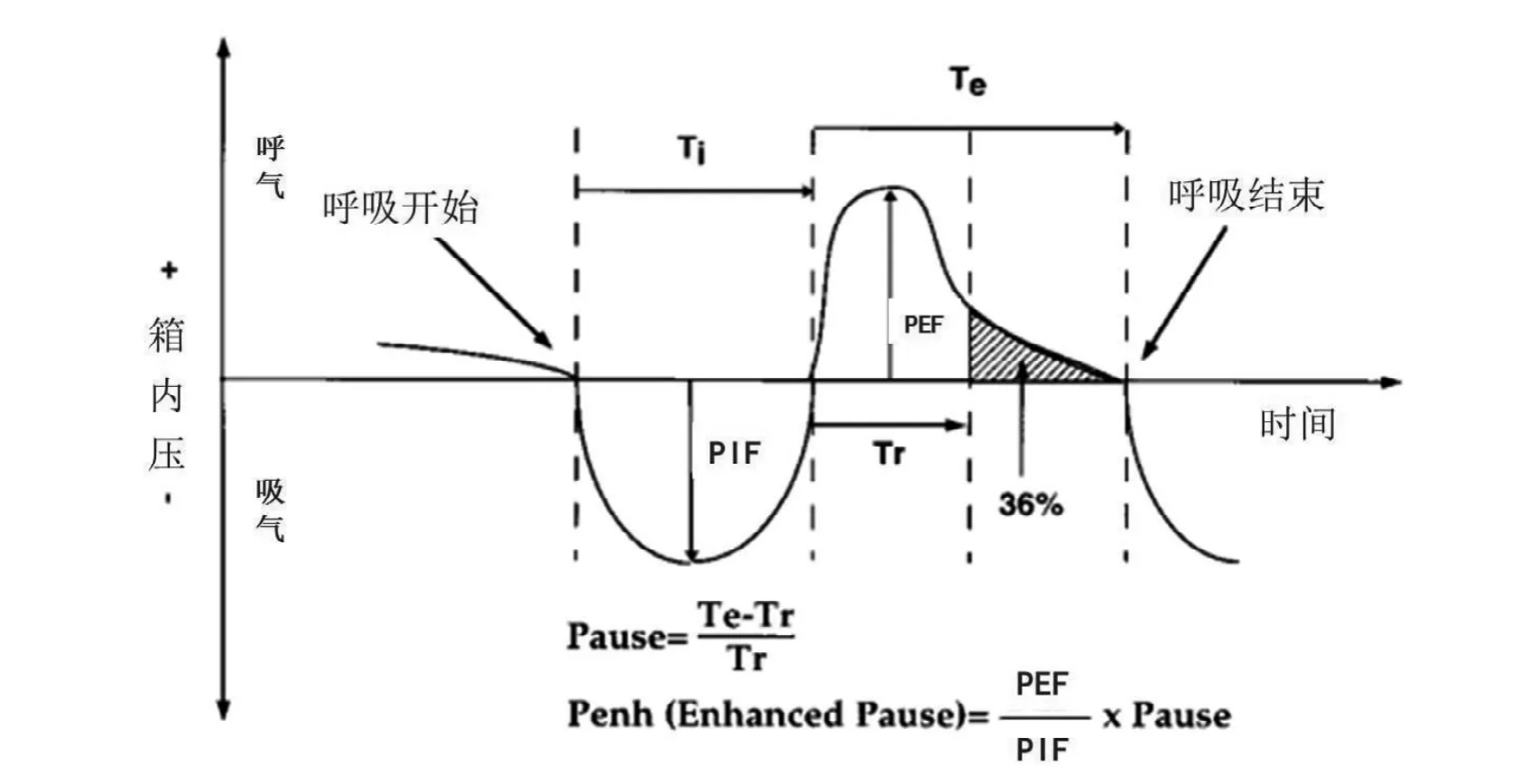
图2 无约束全身体积描记系统的数据测量和计算方法Figure 2 Methods of data measurement and calculation from non-invasive whole-body plethysmograph system
2.2 小鼠气道反应性的变化
由图5可见,正常对照组和哮喘模型组小鼠气道Penh值都呈逐步升高的趋势,但哮喘模型组小鼠的气道Penh值升高的幅度高于正常组小鼠,在Mch 6.25 g/L、12.5 g/L、25 g/L时的Penh值较正常组明显增高(P<0.01或P<0.001)。
3 讨论

图3 支气管激发试验前后呼吸波形的变化Figure 3 The changes of respiratory waveform before and after bronchial provocation test
研究动物呼吸功能测定方法已有较长历史。在早期的小动物肺功能测定中,通常采用呼吸流量换能器和生物信号采集系统相连,通过气道内气流流速、潮气量和跨肺压计算得出动物的气道阻力和肺顺应性[8,9]。虽然采用此方法能准确测定出动物的气道阻力和肺顺应性,但是无法测定Ti、Te、PIF、PEF等参数,且此系统操作难度较大,不利于推广使用。而Buxco公司和FlexiVent公司分别研发的无创小动物肺功能测定系统,可在非麻醉无创(清醒)条件下测定动物肺功能,所测得的肺功能参数Penh基本相似于麻醉有创条件下测得的气道阻力。有创肺功能检测需在麻醉、气管插管的动物身上进行,系统能检测标准和最大压力-容积曲线,以得出相应的参数,如肺活量、肺顺应性和肺阻力,此方法灵敏、具有特异性,但也存在众所周知的缺点,即容易导致动物的死亡,尤其不利于动物的跟踪研究。无创肺功能测定方法是将清醒动物放在体积描记盒内,通过肺功能仪实时监测多种指标, 包括F、TV、PEF、Penh等,对动物无损伤,可多次检测。无创肺功能仪自应用以来,面临着一些争议,有学者认为无约束体积描记法在敏感性上不如有创肺功能检测系统,其呼吸波形和Penh值受环境因素影响较大,尤其是描记箱内温湿度的变化,会对实验结果产生较大的影响[10-15]。虽然存在争议,但还是得到了多数人的认可,目前广泛应用于哮喘模型AHR的测定[16-18]。

图4 支气管激发试验前后肺功能指标的变化Figure 4 The changes of respiratory parameters before and after bronchial provocation test (BPT)

图5 乙酰甲胆碱诱导小鼠哮喘模型AHR中Penh值的变化Figure 5 The changes of airway resistance (Penh) in methacholine-induced airway hyperresponsiveness in the asthmatic model of mice
Penh是一个无单位的计算值,反映气道阻力的大小。统计Penh变化百分比的计算方法为:(Mch激发的Penh值 - NS激发的Penh值)/ NS激发的Penh值×100%。本研究通过应用Mch进行激发实验后测得的参数表明, Penh、EF50、TV、Pause与正常组比较有差异,其中Penh值变化尤其明显,随着Mch浓度的升高,小鼠气道反应性逐步升高,Penh值也随之逐步增高,与小鼠哮喘模型AHR呈现出良好的量效关系,是一个测定AHR的良好指标。本研究得到的Penh变化结果也同文献报道一致[11,19,20]。
根据作者对仪器的使用体会,在检测中需注意以下问题: 在每次测试前均需进行机器的呼吸定标,保证机器的良好状态。实验室应保持安静,小鼠放入描记箱后要给予足够的适应时间,消除由于小鼠恐慌、烦躁带来的呼吸变化,而且在检测过程中尽量减少实验人员的走动,降低对小鼠的影响。其主要原因在于无创肺功能的指标是在完全清醒的动物中测量的,动物运动会引起波形基线的波动,影响实验结果。虽然无创肺功能仪新设计的防噪系统和计算机软件可以过滤部分干扰,但还是要创造安静的检测环境,以减少参数的波动。在进行Mch激发支气管高反应性的过程中,需要注意Mch的起始浓度,动物的品系不同其气道反应性不尽相同,尽量选择较低的浓度开始。在正式试验前,应该进行预试验。此外,每次实验完成后,用生理盐水雾化来清洗雾化装置,消除雾化装置中的药物残留,并清洁描记箱内部,消除残留药物后再进行下一只动物的实验。
综上所述,无创肺功能检测仪使用方便有效,可以持续检测,观察动态变化过程; 可应用于大规模的动物实验和药物筛选,尤其适合检测需要跟踪研究的慢性肺部疾病模型动物的肺功能变化。本研究表明,Penh值在检测Mch诱导的小鼠哮喘模型高反应性时呈良好的量效关系,是一个可以很好地反映AHR的动物肺功能指标。
[1] GINA (Global Initiative for Asthma). Global strategy for asthma management and prevention[DB/OL]. 2016 update.http://www.ginasthma.org.
[2] Lauzon AM, Martin JG. Airway hyperresponsiveness;smooth muscle as the principal actor [J]. F1000Res, 2016, 5(F1000 Faculty Rev):306.
[3] Mullane K, Williams M. Animal models of asthma: reprise or reboot [J]. Biochem Pharmacol, 2014, 87(1):131-139.
[4] 张星东. 过敏性哮喘动物模型在致敏、哮喘发作和气道高反应性等方面的应用研究[J]. 中国比较医学杂志, 2012,22(9):1-7.
[5] Hoymann HG. Invasive and noninvasive lung function measurements in rodents [J]. J Pharmacol Toxicol Methods,2007, 55(1):16-26.
[6] Hamelmann E, Schwarze J, Takeda K, et al. Noninvasive measurement of airway responsiveness in allergic mice using barometric plethysmography [J]. Am J Respir Crit Care Med,1997, 156(3 Pt1):766-775.
[7] Xu L, Dong XW, Shen LL, et al. Simvastatin delivery via inhalation attenuates airway inflammation in a murine model of asthma [J]. Int Immunopharmacol, 2012, 12(4):556-564.
[8] Xie QM, Zeng LH, Zheng YX, et al. Bronchodilating effects of bambuterol on bronchoconstriction in guinea pigs [J]. Acta Pharmacol Sin, 1999, 20(7):651-654 .
[9] 李和权, 谢强敏, 邵传森. 一种新的小鼠气道反应测定方法[J]. 中国病理生理杂志, 2007, 23(1):203-205.
[10] Zhang Q, Lai K, Xie J, et al. Dose unrestrained single-chamber plethysmography provide a valid assessment of airway responsiveness in allergic BALB/c mice? [J]. Respir Res,2009, 10(1):61.
[11] Lomask M. Further exploration of the Penh parameter [J]. Exp Toxicol Pathol, 2006, 57(suppl 2):13-20.
[12] Bates JH, Irvin CG. Measuring lung function in mice: the phenotyping uncertainty principle [J]. J Appl Physiol, 2003,94(4):1297-1306.
[13] Lundblad LK, Irvin CG, Adler A, et al. A reevaluation of the validity of unrestrained plethysmography in mice [J]. J Appl Physiol, 2002, 93(4):1198-1207.
[14] Mitzner W, Tankersley C. Interpreting Penh in mice [J]. J Appl Physiol, 2003, 94(2):828-831.
[15] Petak F, Habre W, Donati YR, et al. Hyperoxia-induced changes in mouse lung mechanics: forced oscillationsvs. barometric plethysmography [J]. J Appl Physiol, 2001, 90(6):2221-2230.
[16] Verheijden KA, Henricks PA, Redegeld FA, et al. Measurement of airway function using invasive and non-invasive methods in mild and severe models for allergic airway inflammation in mice [J]. Front Pharmacol, 2014, 5:190.
[17] Kim SR, Kim DI, Kang MR, et al. Endoplasmic reticulum stress influences bronchial asthma pathogenesis by modulating nuclear factor κB activation [J]. J Allergy Clin Immunol,2013, 132(6):1397-1408.
[18] Yadav UC, Aguilera-Aguirre L, Boldogh I, et al. Aldose reductase deficiency in mice protects from ragweed pollen extract (RWE)-induced allergic asthma [J]. Respir Res, 2011,12(1):145.
[19] Chong BT, Aqrawal DK, Romero FA, et al. Measurement of bronchoconstriction using whole-body plethysmograph:comparison of freely moving versus restrained guinea pigs[J]. J Pharmacol Toxicol Methods, 1998, 39(3):163-168.
[20] 李斌恺, 赖克方, 洪燕华, 等. 支气管哮喘小鼠气道反应性无创检测方法的建立[J]. 中华哮喘杂志, 2009, 3(4):243-247.
Measurement of Lung Function by Using Non-invasive Whole-body Plethysmograph System in Mice
ZHAO Wei1, YU Bing2, ZHANG Shui-juan2, JIA Yong-liang3, XIE Qiang-min3
(1. Zhejiang Provincial Hospital of TCM, Hangzhou 310006, China;2. College of Pharmaceutical Science, Zhejiang Chinese Medical University, Hangzhou 310053, China;3. Zhejiang Respiratory Drugs Research Laboratory, Zhejiang University, Hangzhou 310058, China)
ObjectiveTo establish a method for testing pulmonary function by Buxco’s non-invasive whole-body plethysmography (WBP) in mice.MethodsTwenty female ICR mice were randomly divided into control group and asthmatic model group. Each mouse in model group was subcutaneously injected (multisites) and intraperitoneally injected (one site) with ovalbumin (OVA) which was dissolved in aluminium hydroxide adjuvant. OVA-sensitized mice were challenged by inhalation of antigen. For bronchial provocation test, various concentration of methacholine (Mch) aerosolized by a jet nebulizer.Respiration parameters and lung resistance, showed as the value of enhanced pause (Penh) were measured by the WBP before and after Mch challenge.ResultsCompared with control group,bronchial challenge of Mch dose-dependently induced significant deceleration of frequency of breathing(F) and increases of inspiration time (Ti), expiration time (Te) and the value of Penh in OVA-sensitized mice.ConclusionsThe results proved that the WBP of pulmonary function presented a dose-dependent on testing Mch-challenged airway hyperresponsiveness (AHR) in mice. It may be a potential testing method for AHR.
Mice; Pulmonary function; Asthma; Airway hyperresponsiveness;Non-invasive lung function detector; Whole-body plethysmography
Q95-33
A
1674-5817(2017)05-0383-07
10.3969/j.issn.1674-5817.2017.05.008
2017-04-20
浙江省公益性技术应用研究计划(实验动物)项目(No.2015C37087)
赵 玮(1977-), 女, 硕士, 研究方向: 抗炎免疫药理学。E-mail: 13216701316@163.com
张水娟(1980-), 女, 博士, 实验师, 研究方向: 抗炎免疫药理学。E-mail: zsj@zcmu.edu.cn

